Введение
Аллергия – это состояние повышенной чувствительности организма к определенному веществу или веществам (аллергенам).
На сегодняшний день аллергия является проблемой общественного здравоохранения глобальных масштабов. Согласно данным экспертных оценок Европейской академии аллергии и клинической иммунологии (EAACI) в среднесрочной перспективе (15 лет) более половины населения Европы будет страдать тем или иным видом аллергии.
Каждый третий житель России подвержен аллергии, по данным Института иммунологии Федерального медико-биологического агентства России (г. Москва), прямые затраты на лечение одного больного составляют от 160 до 1900 долларов США в год. На сегодняшний день Международным Союзом Иммунологических Обществ (IUIS) зарегистрировано более 150 аллергенов. В зависимости от происхождения аллергены относятся к разным типам: бытовые (моющие средства, бытовая химия, косметика и т. д.), пыльцевые (пыльца растений, домашняя пыль и т. д.) и пищевые вещества. Одной из наиболее распространенных форм аллергических заболеваний (до 80 %) является пищевая аллергия. В странах ЕС прямые затраты на лечение пищевой аллергии составляют от 1,1 до 1,5 млрд. евро в год. Примерно в ту же сумму оцениваются непрямые затраты, обусловленные увеличением числа дней нетрудоспособности и снижением производительности труда. Таким образом, пищевая аллергия является серьезной медико-социальной проблемой [6].
В настоящее время известно более 170 различных видов продуктов питания, для которых зарегистрированы проявления пищевой аллергии. Основной причиной аллергии является нарушение функционирования иммунной системы, связанное с непереносимостью отдельных компонентов пищи, в частности, молочных белков, содержащихся в коровьем молоке и продуктах его переработки. В целях снижения антигенных свойств молочное сырье можно подвергнуть тепловой обработке. Однако термоденатурация способна приводить как к разрушению областей антигенных детерминант, так и агрегации белковых молекул, экспонированию ранее скрытых антигенных детерминант [10].
Наиболее перспективным подходом для снижения аллергенности молочных продуктов является биокаталитическая конверсия молочных белков, направленная на получение их гидролизатов с заданными молекулярно-массовым распределением и остаточной антигенностью. Особенностью действия протеолитических ферментов является их специфичность по отношению к типу пептидной связи, что позволяет получать гидролизаты с различной степенью гидролиза белка [1, 7].
Цель исследования
В данном исследовании целью является подбор оптимальных параметров ферментативного гидролиза казеина энзиматической системой, состоящей из термолизина, карбоксипептидазы А и лейцинаминопептидазы.
Материалы и методы исследования
В качестве исходного сырья использовали казеин, который является доступным и ценным в биологическом отношении источником белка, а также наиболее адаптирован к физиологическим особенностям детского организма по сравнению с другими белками [5].
Метод исследования – белковый электрофорез по Лэммли. Для анализа гидролизатов использовали денатурирующий ПААГ (12 % – разделяющий и 4 % фокусирующий) с 0,1 % DS-Na. Форез проводили на однократном электродном буфере с добавлением 0,1 % DS-Na при 15 мА. Гель окрашивали 0,2 % Кумасси R250, приготовленного на ледяной уксусной кислоте, при повышенной температуре в течение 7–10 мин, затем трижды отмывали дистиллированной водой.
Результаты и их обсуждение
Известно, что казеины, в отличие от некоторых глобулярных белков, хорошо расщепляются протеиназами в нативном состоянии, поскольку уже в нативном состоянии имеют мало упорядоченную конформацию, подобную дезорганизованной структуре денатурированных глобулярных белков [3, 4, 9]. Это объясняется очень низким содержанием α-спиралей и низкой структурной организацией основных компонентов казеина, что обусловлено высоким содержанием пролина в этих белках – от 8,5 до 16 %, что, по-видимому, деформирует его в беспорядочный клубок [8].
В работе использовали энзиматическую систему, состоящую из эндо- и экзопептидаз. В качестве эндопептидазы использовали термолизин, расщепляющий полипептидную цепь по аминокислотным остаткам с гидрофобной боковой цепью. К таким аминокислотам относятся изолейцин, лейцин, валин, фенилаланин, метионин и аланин.
В качестве экзопептидаз использовали карбоксипептидазу А и лейцинаминопептидазу, катализирующие отщепление аминокислотных остатков с карбоксильного и аминного конца молекулы белка, соответственно.
Из литературных данных известно, что оптимальными параметрами работы используемых ферментов является температура 50±1°С и рН 7,5 [2]. В связи с этим гидролиз вели при данных условиях, варьируя фермент-субстратное соотношение и продолжительность процесса.
К основным показателям целенаправленных гидролизатов казеина относятся: степень гидролиза при определенных фермент-субстратных соотношениях и продолжительность при оптимальных параметрах работы ферментов. В связи с этим определен состав девяти гидролизатов казеина. Полученные результаты исследований представлены в табл. 1.
Таблица 1
Состав и свойства гидролизатов, полученных в результате обработки термолизином, карбоксипептидазой А и лейцинаминопептидазой
|
Показатель |
Контроль |
Фермент-субстратное соотношение, при продолжительности гидролиза |
||||||||
|
1:150 |
1:100 |
1:50 |
||||||||
|
4,00±±0,05 |
8,00±±0,05 |
24,00±±0,05 |
4,00±±0,05 |
8,00±±0,05 |
24,00±±0,05 |
4,00± ±0,05 |
8,00±±0,05 |
24,00±±0,05 |
||
|
Степень гидро-лиза, % |
0 |
30,87±1,44 |
49,04±2,71 |
69,32±3,24 |
53,68±3,51 |
70,51±3,29 |
90,40±4,30 |
37,18±1,71 |
48,86±2,67 |
63,32±2,94 |
|
рН |
7,50 |
7,41 |
7,36 |
7,28 |
7,39 |
7,35 |
7,29 |
7,37 |
7,32 |
7,28 |
Полученные результаты свидетельствуют о том, что термолизин обладает выраженной протеолитической активностью. Данные фермент-субстратного соотношения и продолжительность гидролиза 8±0,05 ч. являются наиболее оптимальными. При уменьшении или увеличении концентрации субстрата (при фермент-субстратном соотношении 1:150 или 1:50) наблюдается снижение скорости реакции. Возможно, это связано с образованием неэффективных комплексов, в которых к активному центру фермента присоединены две или несколько молекул субстрата.
Анализ полученных данных свидетельствует о том, что наиболее рациональным фермент-субстратным соотношением является 1:100, при рекомендуемой литературными источниками температуре 50±1°С и рН 7,50±0,01. Величина рН реакционной смеси изменяется незначительно и находится в пределах оптимальной работы ферментов.
Для наиболее детального анализа гидролиза определено молекулярно-массовое распределение в зависимости от фермент-субстратного соотношения и продолжительности ферментации. На рис. 1 и табл. 2 представлены результаты молекулярно-массового распределения пептидов, полученных методом электрофореза в полиакриламидном геле.
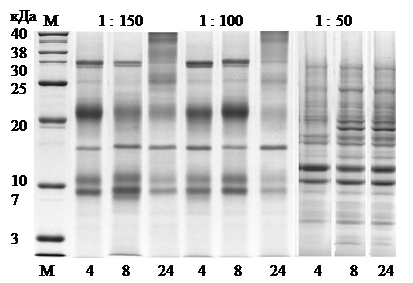
Рис. 1. Электрофорез в полиакриламидном геле гидролиза термолизином, карбоксипептидазой А и лейцинаминопептидазой при фермент-субстратных соотношениях 1:50, 1:100 и 1:150 при продолжительности гидролиза 4,00±0,05, 8,00±0,05, 24,00±0,05 ч, температуре 50±1°С и рН 7,50±0,01 (М – маркер, массовая доля белка 2,0 мг/мл в буфере 0,5М трис-HCl)
Таблица 2
Характеристика пептидов, полученных в результате гидролиза термолизином, карбоксипептидазой А и лейцинаминопептидазой
|
Фермент-субстратное соотношение |
Характеристика компонентов |
||
|
4,00±0,05 |
8,00±0,05 |
24,00±0,05 |
|
|
1 |
2 |
3 |
4 |
|
1:150 |
27,67 10,56 |
27,67 10,32 |
29,61 5,39 |
|
26,93 2,80 |
27,24 2,96 |
24,35 22,91 |
|
|
14,54 5,23 |
14,82 8,38 |
14,74 18,23 |
|
|
10,68 16,51 |
10,96 18,70 |
10,61 19,22 |
|
|
8,73 16,78 |
9,02 25,48 |
8,79 9,51 |
|
|
|
27,30 16,51 |
27,40 7,17 |
30,00 18,96 |
|
26,93 3,44 |
26,93 2,86 |
27,30 3,40 |
|
|
1:100 |
19,10 42,02 |
19,35 49,90 |
24,35 18,93 |
|
14,54 8,62 |
14,54 5,48 |
19,61 23,57 |
|
|
10,40 14,42 |
10,34 17,47 |
14,54 24,64 |
|
|
8,51 14,97 |
8,45 17,14 |
10,61 10,50 |
|
|
27,30 16,51 |
27,40 7,17 |
30,00 18,96 |
|
|
26,93 3,44 |
26,93 2,86 |
27,30 3,40 |
|
|
19,10 42,02 |
19,35 49,90 |
24,35 18,93 |
|
|
1:50 |
26,93 13,30 |
26,93 11,40 |
26,93 12,35 |
|
20,83 10,98 |
25,59 2,30 |
22,99 6,66 |
|
|
17,71 10,68 |
24,35 2,28 |
20,63 9,94 |
|
|
15,81 5,97 |
23,04 6,82 |
19,74 2,50 |
|
|
12,16 21,72 |
20,73 1,67 |
16,60 5,70 |
|
|
9,69 13,98 |
18,36 6,74 |
15,60 8,02 |
|
|
6,52 2,18 |
16,64 5,40 |
13,44 2,67 |
|
|
5,00 7,18 |
14,90 5,04 |
9,69 10,44 |
|
|
|
13,37 5,85 |
8,03 3,01 |
|
|
|
6,52 3,51 |
5,44 7,57 |
|
|
|
2,42 4,60 |
5,23 1,47 |
|
|
|
1,00 2,10 |
|
|
Данные, представленные на рис. 1 и табл. 2, свидетельствуют о том, что гидролизаты казеина, полученные с использованием энзиматической системы, состоящей из термолизина, карбоксипептидазы А и лейцинаминопептидазы, характеризуются высоким содержанием низкомолекулярных фракций, количество которых увеличивается в процессе реакции.
Таким образом, обобщая результаты эксперимента, нами выбраны оптимальные параметры проведения реакции гидролиза: при температуре 50±1°С, фермент-субстратном соотношении 1:100 и продолжительности процесса 8,00±0,05 ч.
Работа выполнена в рамках исполнения Государственного контракта №12.527.11.0008 от 04.06.2012 года по теме «Разработка технологии получения гипоаллергенных функциональных молочных продуктов», заключённым между Министерством образования и науки РФ и ГНУ ВНИМИ Россельхозакадемии по федеральной целевой программе «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы».
Рецензенты:
Просеков Александр Юрьевич, доктор технических наук, профессор, ректор ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г. Кемерово.
Попов Анатолий Михайлович, доктор технических наук, профессор, проректор по научно-инновационной работе ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г. Кемерово.



