Введение
Объектом данного исследования является олигопептидаза В из Serratia рroteаmaculans. Олигопептидаза В (OpdB) – это трипсиноподобная сериновая пептидаза, присутствующая в древних одноклеточных эукариотах: трипаносомах Trypanosoma сruzi, T. brucei и T. evansi [5; 6], а также в лейшманиях Leishmania major и L. amazonensis [5]. Гены, кодирующие этот фермент, также обнаружены в таких грамотрицательных патогенных бактериях, как Escherichia coli [10], Moraxella lacunata [5], Salmonella enterica Serovar Typhymirium, микобактериях Mycobacterium tuberculosis и Mycobacterium leprae [8], а также в спирохетах Treponema denticola [5]. При трипаносомных инфекциях (болезнь Шагаса, африканская сонная болезнь) олигопептидазы В являются важными факторами вирулентности [5]. Бактериальные OpdB значительно менее изучены, однако предполагается, что они также могут быть важными мишенями для антимикробной химиотерапии [8].
Нами была обнаружена новая трипсиноподобная протеиназа (PSP) из психротолерантного грамотрицательного микроорганизма Serratia рroteamaculans 94 [1]. Фермент был идентифицирован как ранее неизвестная олигопептидаза В; проведено секвенирование гена OpdB S. proteamaculans 94, сконструирован продуцент E. coli BL-21 (DE3) pOpdB и разработан препаративный метод получения рекомбинантного фермента (His6-PSP) [4]. Проведен детальный субстратный и ингибиторный анализ PSP, изучено влияние ионов кальция, рН и температуры на активность фермента [2; 3]. Показано, что PSP является психрофильным ферментом, то есть адаптированным к пониженным температурам [2]. Все ранее изученные олигопептидазы В отличает высокая стабильность к повышенным температурам [6; 10]; психрофильные олигопептидазы В ранее известны не были.
Ферменты, выделенные из психрофильных организмов, обладают более высокой каталитической эффективностью (как правило, не только при 20–25°С, но и при температурах, близких к 0°С) и меньшей термостабильностью, чем их мезофильные аналоги [7]. Молекулярные основы функционирования психрофильных ферментов до сих пор не известны.
Целью данного исследования явилось определение влияния различных факторов на термостабильность PSP.
Материалы и методы
В работе использовали р-нитроанилид Na-бензоил-D,L-аргинина (BAPNA) (Sigma, США); Tris, NaCl, глицерин, Ds-Na («ICN», США); диметилсульфоксид (ДМСО) (Fluka, Германия); акриламид, персульфат аммония, N,N'-метиленбисакриламид, N,N,N,N'-тетраметилэтилендиамин, белковые стандарты для электрофореза (Bio-Rad, США); трипсин бычий лиофилизованный производства завода медицинских препаратов (Санкт-Петербург, Россия). Остальные реагенты – отечественного производства, классификации ос.ч. или х.ч.
Рекомбинантный фермент (His6- PSP) получен по разработанной нами методике [4].
GroEL E. coli любезно предоставлен В.И. Муронцом и Е.В. Шмальгаузен (Институт физико-химической биологии им. А.Н. Белозерского МГУ им. М.В. Ломоносова).
Для концентрирования и разделения смесей белков использованы приборы для ультрафильтрации Centricon (Millipore, США).
Электрофорез в ПААГ в присутствии Ds-Na по Лэммли проводили с использованием ячейки для электрофореза Mini-Protean 3 (Bio-Rad, США). Концентрация разделяющего геля составляла 12%, концентрирующего – 4%. Гели окрашивали с помощью Кумасси G-250.
Нагревание аликвот препаратов ферментов (50 мкл) проводили в микропробирках (Sarstedt, Германия) при заданной температуре на термостате Термит («ДНК-технология», Россия).
Изучение активности ферментов проводили спектрофотометрически с использованием в качестве субстрата BAPNA. В кварцевую кювету шириной 1 см вносили 0,1 М Tris-HСl-буфер, рН 8,0 (буфер А), содержавший 50 мМ СаСl2; 30 мкл 10 мМ раствора BAPNA в ДМСО и 5 мкл пробы препарата PSP или 40 мкл трипсина. Общий объем инкубационной смеси – 1,5 мл. Мониторинг гидролиза BAPNA проводили на спектрофотометре Beckman DU-70 (США), регистрируя увеличение оптического поглощения при 405 нм (25°C), происходящее при образовании свободного п-нитроанилина (De405 10400 М-1см-1).
Результаты и их обсуждение
Ранее нами было обнаружено, что кажущийся температурный оптимум PSP находится при 25°C, так как при более высоких температурах фермент достаточно быстро инактивируется [2].
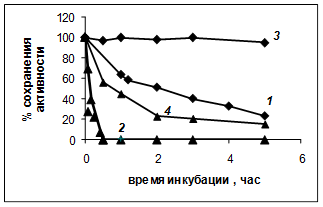
Рис. 1. Температурная инактивация PSP (0,65 мкМ; 50 мкг/мл – 1, 2 )
и трипсина (50 мкг/мл – 3, 4 ) в буфере А. 1, 3 – 37°С; 2, 4 – 45°С.
В данном исследовании мы изучили скорость инактивации PSP в зависимости от температуры и состава среды. Было показано, что при инкубации в 0,1 М Tris-НСl-буфере pH 8,0 (буфер А) уже при 37°C фермент достаточно быстро утрачивает активность (рис. 1, кривая 1). Скорость денатурации фермента резко возрастает при 45°C (рис. 1, кривая 2).
Сравнение скорости инактивации PSP и мезофильного фермента трипсина служит доказательством психрофильности исследуемого фермента, полная инактивация которого при 45°С наблюдалась уже в течение первых 30 мин (рис. 1, кривая 2) в отличие от сравнительно устойчивого в этих условиях трипсина (рис. 1, кривые 3 и 4).
Было изучено влияние состава используемого для инкубации буфера на скорость инактивации PSP при 37°С. В ходе экспериментов неожиданно было обнаружено, что внесение в буфер 50%-ного глицерина практически полностью стабилизирует PSP, предотвращая его инактивацию (рис. 2А, кривая 4) так, что такие препараты фермента могут храниться при 37°С в течение нескольких суток без заметной потери активности. Стабилизирующее влияние глицерина заметно и при более высоких температурах: 45 и 50°С, где в обычных условиях фермент практически сразу инактивируется (рис. 3 , кривые 1 и 2 соответственно.). Термостабилизирующее влияние глицерина при 45°С заметно и для трипсина (рис. 3, кривая 3 по сравнению с кривой 4 рис. 1).
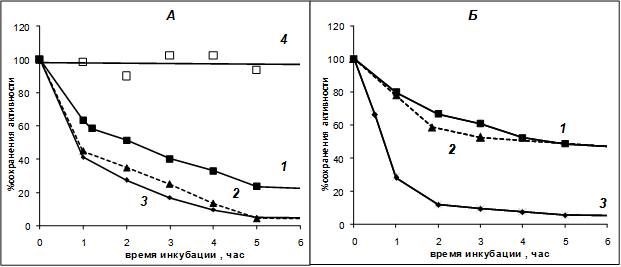
Рис. 2. А - Инактивация PSP (0,65 мкМ) в различных средах при 37°С. Б – такая же инактивация комплекса PSP-GroEL (0,65 мкМ). 1 - 0,1 М Tris-НСl-буфер pH 8 (буфер А); 2 - 0,01 М Tris-НСl-буфер pH 8; 3 - буфер А + 50 мM CaCl2; 4 - 0,1 М буфер А + 50% глицерина
Достаточно неожиданным (и противоположным по характеру) явился также обнаруженный в ходе данного эксперимента эффект ионов кальция на термостабильность PSP. Оказалось, что в присутствии 50 мM CaCl2 инактивация фермента значительно ускорялась (рис. 2А, кривая 3). В наших предыдущих работах [1; 4] была обнаружена некоторая стабилизация растворов PSP, по аналогии с родственным ему трипсином, ионами кальция при длительном хранении, поэтому запасные растворы этого фермента (в 50%-ном глицерине для предотвращения замерзания при -20°С) всегда содержали 50 мM CaCl2 . Эффект ионов кальция на активность и стабильность PSP требует дальнейшего изучения.
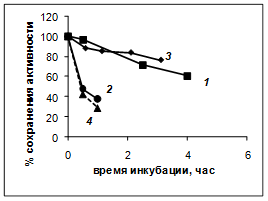
Рис. 3. Инактивация 1, 2 - PSP (0,65 мкМ; 50 мкг/мл); 3 - трипсина (50 мкг/мл) и 4 -комплекса PSP-GroEL (1 мкМ) в буфере А, содержащем 50%-ный глицерин. 1, 3 – 45°С; 2, 4 – 50°С
Достаточно неожиданным (и противоположным по характеру) явился также обнаруженный в ходе данного эксперимента эффект ионов кальция на термостабильность PSP. Оказалось, что в присутствии 50 мM CaCl2 инактивация фермента значительно ускорялась (рис. 2А, кривая 3). В наших предыдущих работах [1; 4] была обнаружена некоторая стабилизация растворов PSP, по аналогии с родственным ему трипсином, ионами кальция при длительном хранении, поэтому запасные растворы этого фермента (в 50%-ном глицерине для предотвращения замерзания при -20°С) всегда содержали 50 мM CaCl2 . Эффект ионов кальция на активность и стабильность PSP требует дальнейшего изучения.
Также была выявлена зависимость скорости температурной инактивации PSP при 37°С от молярности используемого буфера: в более разбавленном 0,01 М Tris-НСl-буфере термостабильность фермента заметно понижается (рис. 2А, кривая 2).
Интересной особенностью фермента PSP, обнаруженной на начальных этапах исследований, явилось выделение его в виде трудноразделяемого комплекса с шаперонином типа GroEL S. рroteаmaculans [4]. Фермент в составе этого комплекса активен. Характер связи PSP с шаперонином неизвестен. Молекула бактериального шаперонина GroEL, в частности из E. coli, состоит из 14 идентичных субъединиц с массой 57 кДа каждая. Субъединицы образуют две кольцевые структуры по семь субъединиц, формирующие цилиндр с внутренней полостью. GroEL назван молекулярным шапероном благодаря способности связывать находящиеся в ненативной конформации белковые цепи и способствовать достижению ими нативной структуры. При этом в процессе фолдинга денатурированных белков наряду с GroEL принимают участие АТФ, ионы магния и кошаперон GroES, состоящий из семи идентичных субъединиц с массой 10 кДа каждая [9]. О взаимодействии шаперонинов с нативными, активными белками ранее известно не было. Напротив, образовав прочный комплекс с денатурированным ферментом, например глицеральдегид-3-фосфат дегидрогеназой, GroEL в присутствии GroES, АТФ и Mg2+ затем освобождает реактивированный фермент [9]. Поэтому следует предположить, что обнаруженный нами комплекс GroEL S. proteаmaculans с активным ферментом PSP относится к другому, неизвестному типу.
В данном исследовании мы поставили эксперимент, обратный разрушению природного комплекса PSP-GroEL – образование искусственного комплекса из имеющегося в нашем распоряжении рекомбинантного фермента (His6-PSP), и GroEL E. сoli.
Комплекс PSP с шаперонином GroEL E. сoli получен путем смешивания эквивалентных объемов растворов GroEL (1,67 мкМ) и PSP (6 мкМ). Ультрафильтрация на Centricon-100 c пределом исключения 100 кДа при многократном промывании буфером А, содержащим 50% глицерина, и последующим концентрированием позволила отделить свободный PSP (78 кДа, в фильтрате) от высокомолекулярного прочного комплекса PSP с GroEL (14 субъединиц по 57 кДа плюс 78 кДа, в концентрате) (рис. 4). Активность PSP в концентрате после доведения объема до исходного объема GroEL соответствовала 1,5 мкМ фермента. Таким образом, получен комплекс PSP-GroEL(1:1); одна олигомерная молекула GroEL E. сoli (57 кДа × 14) связывает одну молекулу PSP (78 кДа).
Особый интерес вызывает влияние шаперонинов на процессы денатурации белков в клетке, в т.ч. теплового шока. При изучении термоденатурации глицеральдегид-3-фосфат дегидрогеназы было обнаружено, что присутствие эквимолярных количеств GroEL не влияет на процесс [9]. Авторы исследования показали, что при этом происходит необратимое связывание денатурированного белка с шаперонином, препятствующее образованию агрегатов белка. Предполагается, что такое необратимое связывание приводит к блокированию «неправильным белком» шаперона, создающее препятствия фолдингу нормальных белков. Эти процессы могут лежать в основе развития таких патологических процессов, связанных с агрегацией белков, как болезнь Альцгеймера и прионных болезней.
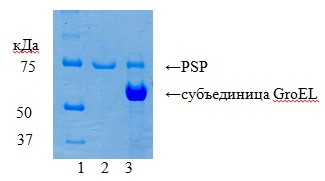
Рис. 4. Белковый состав комплекса PSP- GroEL по данным электрофореза в 12%-ном ПААГ в восстанавливающих условиях. 1 – белковые стандарты; 2 – фильтрат; 3 – концентрат при ультрафильтрации смеси PSP и GroEL на Centricon-100.
Очевидно, что психротолерантный микроорганизм S. рroteamaculans в процессе жизнедеятельности часто подвергается тепловому шоку, что объясняет высокое содержание белка теплового шока GroEL в гомогенате его биомассы при получении PSP [1; 4]. Образование комплекса психрофильного фермента PSP с шаперонином при этом не может быть случайным процессом. Мы предположили, что одной из причин такого комплексообразования может явиться защита этого белка от термоденатурации.
Наши экспериментальные данные подтвердили это предположение. Комплекс PSP-GroEL оказался более устойчив к денатурации при 37°С, чем нативный фермент, как в 0,1 М так и в 0,01 М Tris-НСl-буфере, (рис. 2Б, кривые 1 и 2 по сравнению с соответствующими кривыми рис. 2А). Однако внесение 50 мM CaCl2 полностью снимало эту термостабилизацию: в присутствии ионов кальция комплекс PSP-GroEL денатурировал даже несколько быстрее, чем свободный фермент (рис. 2 А и Б, кривые 3). При 50°С денатурация комплекса PSP-GroEL также не отличается от денатурации свободного PSP, даже в 50 %-ном глицерине (рис. 3, кривые 2 и 4).
Выводы
- Подтверждена психрофильная природа исследуемого фермента – PSP.
- Изучены факторы, влияющие на термостабильность PSP. Впервые обнаружена стабилизация фермента глицерином и дестабилизация ионами Ca2+ и буферными растворами низкой молярности.
- Получен прочный комплекс PSP-GroEL E. сoli (1:1). Выявлена стабилизация фермента PSP шапероном, в отличие от глицеральдегид-3-фосфат дегидрогеназы [9].
- Разработана экспериментальная база для дальнейшего исследования фермента.
Работа выполнена при финансовой поддержке РФФИ (грант 10-04-01381).
Рецензенты
Ротанова Т.В., д.х.н., профессор, ведущий научный сотрудник ФГУ науки Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова, РАН, г. Москва.
Севастьянова Г.А., д.б.н., профессор ФГБОУ ВПО «Московский педагогический государственный университет», г. Москва.



