На сегодняшний день накоплены убедительные данные о губительном воздействии чрезмерного потребления алкогольных напитков на продолжительность жизни населения, его смертность, работоспособность, социально-культурное поведение [4].
Уровень потребления алкоголя в России в пересчете на чистый этанол составляет 15-18 литров в год на человека, что превышает средние европейские показатели примерно на 50% [2].
Этанол в силу своих химических свойств и особенностей биотрансформации оказывает токсическое и наркотическое воздействие на живой организм. Одним из наиболее важных и загадочных последствий потребления алкоголя является абстинентный алкогольный синдром. Такое состояние длится обычно не более суток, но может продолжаться и дольше. При этом наблюдаются многочисленные изменения в балансе гормонов, медиаторов и других биологических веществ в живом организме. Также это приводит к учащению пульса и повышенной нагрузке на сердце, что может вызвать инсульт или сердечный приступ. Существенно, что человек, злоупотребляющий алкогольными напитками, не ощущает потребности в пище, а для купирования недугов, связанных с интоксикацией, организму требуется новая порция этилового спирта, возникает алкогольная зависимость [1].
Негативные последствия потребления этилового спирта связаны с накоплением высокой концентрации высокотоксичного вещества - ацетальдегида. Токсическое и наркотическое действие уменьшается по мере его окисления. Основным местом метаболической трансформации этанола является печень и эпителий желудка. Метаболическое окисление алкоголя происходит с участием мультиферментной системы, состоящей из двух ферментов: цитозольной алкогольдегидрогеназы (АДГ) и митохондриальной ацетальдегидрогеназы (АЛДГ) [3].
Скорость катаболизма алкоголя и альдегида уксусной кислоты различна у каждого человека и определяется генетическим фактором.
В нашей стране продукты питания и препараты, направленные на снижение токсического действия этанола и продуктов его метаболизма (ацетальдегида) на живой организм, в достаточном количестве и ассортименте не производятся. В связи с этим создание конкурентоспособных отечественных гармонизирующих ингредиентов, предназначенных для связывания и выведения токсических продуктов метаболизма этилового спирта из организма, является актуальным и практически важным.
Целью настоящего исследования явилась разработка технологии получения этанол-метаболизирующей системы, обеспечивающей биокаталитическое окисление спирта.
Объект и методы исследований
В качестве объекта исследований были выбраны дрожжи Saccharomyces cerevisiae, обладающие высокой каталитической активностью по отношению к этиловому спирту и ацетальгидегиду.
Культивирование дрожжей осуществляли в периодическом биореакторе объемом 5,0 л на питательной среде с использованием молочной сыворотки в течение 18 ч при температуре 36±2 °С, рН среды 4,8±0,2, перемешивании 500±5 об/мин и аэрации воздуха 30±0,2 л/ч. По окончании процесса культивирования дрожжи отделяли от культуральной жидкости центрифугированием в течение 15±1 мин при 15000±100 об/мин, промывали дистиллированной водой.
Определение биомассы дрожжей осуществляли как разницу биомассы до и после культивирования. Для количественной характеристики культивирования дрожжей пользовались показателем - удельной скоростью роста, которая характеризует часовой прирост на единицу растущей биомассы.
Для выделения этанол-окисляющего мультиферментного комплекса дрожжи S. cerevisiae измельчали на планетарной шаровой мельнице РМ 400 в присутствии стеклянных шаров марки Glass beads approximately 80 mesh. Особенности трансформации дрожжей рода S. cerevisiae изучали в электронном микроскопе JTM-100Ex (JEOL) с увеличением в 8000-10000 раз методом негативного контрастирования.
Каталитическую активность АДГ оценивали по скорости окисления кофермента никотинамиддинуклеотида восстановленного (НАДН), которую регистрировали на самописце спектрофотометра по убыли величины оптической плотности при длине волны 340 нм. Каталитическую активность альдегиддегидрогеназы (АЛДГ) определяли методом Б.М. Кершенгольц и Е.В. Серкиной [5], регистрируя начальную скорость образования НАДН при окислении ацетальдегида с образованием уксусной кислоты.
Содержание белка определяли на анализаторе общего азота (белка) «Rapid N cube», работающего по методу сжигания пробы Дюма с регистрацией общего азота на детекторе теплопроводности.
Концентрирование этанол-окисляющей мультиферментной системы проводили методом ультрафильтрации, через полиамидные мембраны УПМ 67.
С целью очистки концентрата от контаминирующей микрофлоры был применен способ микрофильтрации с использованием мембран марки фирмы «Millipore» с диаметром пор 0,22 мкм. Процесс микрофильтрации проводили при температуре 19±2 °С под разрежением 0,1-0,3МПа.
Далее для более полной очистки ферментного комплекса от инертных белков и белков, молекулярная масса которых более 100 кДа, был применен метод ионообменной хроматографии (ИОХ) на колонке с карбоксиметилцеллюлозой (КМ-целлюлозой) и диэтиламиноэтилцеллюлозой (ДЭАЭ-целлюлозой). КМ-целлюлоза, благодаря своей функциональной группе, обладает свойствами слабого анионообменника, а ДЭАЭ-целлюлоза - свойствами слабого катионообменника.
Степень чистоты на каждой стадии получения и очистки ферментного комплекса определяли электрофоретическим способом в полиакриламидном геле (ПААГ).
Специфичность белковой фракции к этиловому спирту и ацетальдегиду проверяли путем сравнения аминокислотного состава с коммерческими препаратами. Определение аминокислотной последовательности проводили на автоматическом секвенаторе, работающем по методу Эдмана, основанному на обработке исследуемого белка фенилизотиоцианата, что приводит к отщеплению одной аминокислоты с N-конца последовательности и последующей ее идентификацией с помощью жидкостной хроматографии под давлением.
Степень микробиологической чистоты оценивали путем подсчета колоний, выросших на чашках Петри с питательными средами. В качестве питательных сред использовали мясо-пептонный агар, картофельный и солодовый агары.
Общую бактериальную обсемененность ферментного препарата рассчитывали как среднее арифметическое число колоний микроорганизмов на 1 г препарата для всех разведений.
Достоверность экспериментальных данных определяли методом математической статистики на ЭВМ.
Изоэлектрическую точку ферментов определяли методом изоэлектрического фокусирования на установке фирмы «BioRat».
Молекулярную массу полученного АДГ и АЛДГ определяли методом гель-фильтрации на хроматографе FPLC с использованием тестовых белков.
Результаты исследований
Технологическая схема получения этанол-метаболизирующей системы (ЭМС), обеспечивающей биокаталитическое окисление этилового спирта, включает следующие стадии: приемку и оценку качества сырья, культивирование дрожжей на питательной среде с добавлением молочной сыворотки, трансформацию (разрушение) клеток, экстракцию, осаждение белковой фракции ацетоном, диализ, ультра- и микрофильтрацию, ионообменную хроматографию с использованием сорбентов карбоксиметилцелюллозы (КМ-целлюлозы) и диэтиламиноэтилцеллюлозы (ДЭАЭ-целлюлозы), смешивание компонентов (никотинамиддинуклеотид восстановленный, никотинамиддинуклеотид окисленный, раствор фосфатного буфера и раствор агрозы), полимеризацию, измельчение, хранение и реализацию.
Согласно технологической схеме, представленной на рисунке 1, процесс выработки ЭМС начинается с приемки сырья и проверки его качественных показателей согласно действующей документации.
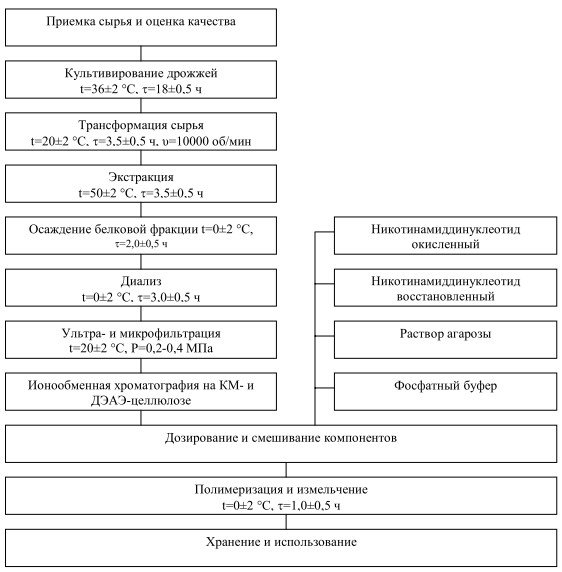
Рис. 1. Технологическая схема получения ЭМС.
В производстве ЭМС используют следующее сырье:
- никотинамиддинуклеотид окисленный (США, фирма-производитель МР Biomedicals, концентрация 97%); никотинамиддинуклеотид восстановленный (США, фирма МР Biomedicals, концентрация 97%); дрожжи S. сerevisiae по ГОСТ 171-81; мелассная питательная среда по ГОСТ 171-81; молочная сыворотка по ОСТ 10-02-02-3; агароза (98%, фирма-производитель «BioWhittaker»); питьевая вода по ГОСТ Р 51232-98; натрий фосфорнокислый однозамещенный по ГОСТ 24576; натрий фосфорнокислый двузамещенный по ГОСТ 4172-76.
Отобранное для производства ЭМС сырье направляют на культивирование в периодическом режиме в биореакторе при температуре 36±2 °С и рН 4,5-5,0 при перемешивании 500±5 об/мин и аэрации воздуха 30±0,2 л/ч.
По достижении стационарной фазы культивирование дрожжей прекращают. Для этого биомассу дрожжей отделяют от питательной среды сепарированием при двукратной промывке суспензии водой для удаления остатков среды, бактерий и примесей. На заключительном этапе дрожжи фильтруют на вакуум-фильтрах и охлаждают до температуры 10±2 °С. С целью наиболее полного извлечения белковых веществ дрожжевое сырье подвергают трансформации на шаровой мельнице РМ 400 с использованием стеклянных шаров марки Glass beads approximately 80 mesh в течение 3,5±0,5 ч. Полученный гомогенат экстрагируют в фосфатном буфере (рН 9,5) в течение 3,0±0,5 ч. Осаждение белковых фракций проводят при температуре 0±2 °С ацетоном с выдержкой по 30±5 мин. Для более полного извлечения белковой фракции процесс осаждения повторяют дважды.
Для удаления органического растворителя и низкомолекулярных примесей из полученной фракции проводят очистку методом диализа против дистиллированной воды в течение 3,0±0,5 ч при температуре 0±2 °С и постоянном перемешивании. По окончании очистки методом диализа образовавшийся сгусток удаляют на сепараторах и проводят концентрирование полученной белковой фракции с последующей очисткой от контаминирующей микрофлоры методом микрофильтрации на мембранах с диаметром пор 0,22 мкм.
С целью получения этанол-метаболизирующей системы, состоящей из двух ферментов (алкогольдегидрогеназы и альдегиддегидрогеназы), проводят ионообменную хроматографию с использованием КМ-целлюлозы и ДЭАЭ-целлюлозы.
В белковую фракцию добавляют компоненты согласно рецептуре, приведенной в таблице 1, перемешивают, полимеризуют и измельчают при температуре 0±2 °С. После этого полученный ЭМП хранят при температуре 0±2 °С и используют по назначению.
Таблица 1 - Рецептура этанол-метаболизирующего ферментного препарата
|
Компоненты |
Значение, кг |
|
Алкогольдегидрогеназа |
0,4 |
|
Альдегиддегидрогеназа |
3,0 |
|
Никотинамиддинуклеатид |
74,0 |
|
Никатинамиддинуклеотид восстановленный |
74,0 |
|
Раствор фосфатного буфера, рН 8,5 |
293,6 |
|
Агароза |
55,5 |
|
Вода |
499,5 |
|
Итого |
1000,0 |
Выводы
Проведенные исследования позволили разработать технические условия на ЭМС и зарегистрировать его за номером ТУ 9291-144-02068315-2011.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ.
Рецензенты
Попов Анатолий Михайлович, доктор технических наук, профессор, проректор по научно-инновационной работе ФГБОУ ВПО «КемТИП», г. Кемерово.
Крупин Алексей Владимирович, доктор технических наук, профессор, генеральный директор ОАО ХК «СДС-Алко», г. Кемерово.



