Нарушение функции анастомоза и отводящей петли может быть следствием некорректно выполненной операции: относительно высоко наложенного анастомоза, его малых или избыточных размеров, деформации и сужения приводящей или отводящей петли вблизи соустья [8]. Эти изменения выявляют при рентгенологическом исследовании. В литературе имеются данные о применении эхографии в распознавании острой кишечной непроходимости, в диагностики нарушений эвакуации приводящей петли они единичные [7, 8].
Целью исследования явилось создание способа энтеро-энтероанастомоза при гастрэктомии, снижающего риск развития синдрома приводящей петли, острого панкреатита.
Материал и методы исследования
С 1992 года по 2011 год в хирургическом отделении Областного онкологического диспансера г. Пензы выполнено 569 гастрэктомий по поводу рака желудка. Показаниями к такой операции были: 1) распространенная опухоль средней и верхней третей желудка, а также субтотальное и тотальное поражение органа; 2) мультифокальное поражение органа; 3) ситуации, в которых по объему и локализации поражения желудка технически возможна его резекция, но необходимая лимфаденэктомия требует полного удаления органа. Всем больным произведена стандартная диссекция в объеме D2.
Мы провели сравнительный анализ гастрэктомий у 72 больных раком желудка. Применяли гастрэктомию с наложением муфтообразного пищеводно-кишечного анастомоза в модификации Сигала.
Средний возраст больных в группах составил 61,2±8,7 год. Среди больных были 42,3 % женщины и 57,7 % мужчины. При изучении гистологического строения опухолей заметно преобладание аденокарциномы разной степени дифференцировки - 86,2 % наблюдений.
Пациенты были разделены на 2 группы в зависимости от способа наложения энтеро-энтероанастомоза при гастрэктомии. Между группами не было выявлено значимых различий по полу, возрасту, характеру сопутствующей патологии. 1 группа - 42 пациента, оперированных традиционным методом, энтеро-энтероанастомоз по Braun. 2 группа - 30 пациентов, оперированных предложенным способом наложения энтеро-энтероанастомоза при гастрэктомии. (Способ энтеро-энтероанастомоза при гастрэктомии / А. Л. Чарышкин, В. Ю. Гудошников. Решение о выдаче патента от 23.11.2011 г. по заявке № 2010154844, приоритет от 31.12.10), разработано на кафедре факультетской хирургии Института медицины экологии и физической культуры Ульяновского государственного университета (ИМЭиФК УлГУ). Заключение этического комитета ИМЭиФК УлГУ от 12.11.2009 г. проведение клинических исследований по применению способа энтеро-энтероанастомоза при гастрэктомии, предполагаемая эффективность и безопасность научно обоснованы. Все пациенты давали информированное добровольное согласие на медицинское вмешательство. Производилась гастрэктомия с наложением позадиободочного эзофагоэнтероанастомоза (рис. 1) по Сигалу. Под брыжейкой поперечноободочной кишки на расстоянии примерно 60 см от эзофагоэнтероанастомоза, ниже связки Трейца 3 на 3-4 см формировали энтеро-энтероанастомоз.
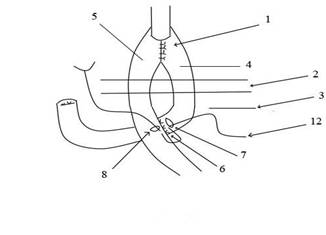
Рисунок 1. Формирование энтеро-энтероанастомоза (1 - эзофагоэнтероанастомоз, 2 - поперечноободочная кишка, 3 - связка Трейца, 4 - приводящая петля тонкой кишки, 5 - отводящая петля тонкой кишки, 6 - наружный ряд задней губы энтеро-энтероанастомоза, 7 - отверстие в поперечном направлении на приводящей петле 4 тонкой кишки, 8 - отверстие в поперечном направлении на отводящей петле 5 тонкой кишки)
Особенности разработанного энтеро-энтероанастомоза заключаются в следующих оригинальных этапах формирования анастомоза: 1. Энтеротомию проводят поперечно, путем рассечения серозной оболочки приводящей и отводящей петли тонкой кишки на расстоянии 18-20 мм, затем мышечный, подслизистый и слизистый слои (рис.2) вскрываются точечным проколом 2-3 мм, при этом слизистый слой расширяется зажимом в поперечном направлении, до 18-20 мм. 2. Энтеро-энтероанастомоз формируется таким образом, что из слизистого и подслизистого слоев отводящей петли тонкой кишки образуются створки арефлюксного клапана (рис. 2), а серозные оболочки приводящей и отводящей петель тонкой кишки точно и надежно сопоставляются друг с другом, обеспечивая герметичность соустья.
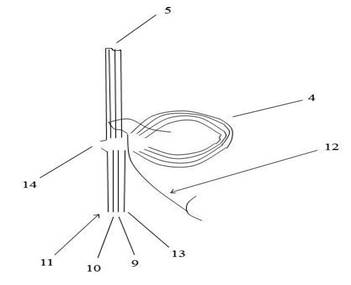
Рисунок 2. Формирование внутреннего ряда арефлюксного энтеро-энтероанастомоза
9 - мышечный слой отводящей петли 5 тонкой кишки, 10 - подслизистый слой отводящей петли 5 тонкой кишки, 11 - слизистый слой отводящей петли 5 тонкой кишки, 12 - синтетическая рассасывающаяся нить, 13 - серозная оболочка отводящей петли 5 тонкой кишки, 14 - створки арефлюксного клапана
Полученные результаты формирования арефлюксного энтеро-энтероанастомоза изучали с помощью ультразвукового (УЗИ), эндоскопического и рентгенологического методов исследования.
При сравнении полученных параметров нами использовался t-критерий Стьюдента для независимых парных выборок и х2-тест. Достоверными признавались различия с уровнем доверительной вероятности не менее 95 % с учетом поправки Бонферрони для множественных сравнений.
Результаты исследования и их обсуждение
Клинические проявления синдрома приводящей петли наблюдались в первой группе у 3 (7,1 %) пациентов, на R-скопии и R-граммах у данных больных наблюдали рефлюкс контрастного вещества (сульфат бария) из отводящей петли в приводящую, во второй группе клиники синдрома приводящей петли не было.
Ультразвуковое исследование в первые двое суток послеоперационного периода достоверных различий в размерах приводящей петли в обеих группах не выявило. УЗИ признаки на 3, 5, 10 сутки после операции показали следующие результаты.. Увеличение диаметра приводящей петли свыше 2,5 см и толщины ее стенки свыше 3 мм соответствуют УЗИ признакам кишечной непроходимости [6], данные размеры выявлены у 26 пациентов (61,9 %) в первой группе и у 3 пациентов (10 %) во второй группе, при этом диаметр и толщина стенки отводящей петли в обеих группах были меньшего размера. В первой группе больных диаметр приводящей петли составлял 3,2±0,6 см, толщина стенки 3,4±0,2 мм, во второй группе соответственно 1,6±0,4 см, толщина стенки 2,1±0,2 мм, различия достоверны (p<0,05). У пациентов с диаметром приводящей петли свыше 2,5 см при выполнении УЗИ наблюдали рефлюкс жидкости из отводящей петли в приводящую.
Во 2-ой группе парез кишечника наблюдался у 3 (10 %) больных, в 1-ой группе у 26 (61,9 %) человек. Парез кишечника достоверно чаще встречался в 1-ой группе и купировался на 7,4 ± 0,4 сутки послеоперационного периода, во второй группе на 3,5 ± 0,3 сутки. Тошнота и рвота купировались на 4,8 ± 0,5 сутки в группе сопоставления и на 2,3 ± 0,3 сутки в группе исследования, диспептические явления достоверно купировались раньше во второй группе.
Повышение амилазы крови отмечалось у 13 (30,9 %) больных 1-ой группы и у 3 (10 %) больных 2-ой группы. Уровень амилазы крови снижался и нормализовался на 6,5 ± 0,3 сутки в первой группе, во второй группе на 3 сутки.
Осложнения чаще встречались в первой группе пациентов: синдром приводящей петли - у 3 пациентов (7,1 %), острый панкреатит - у 10 (23,8 %), панкреонекроз - у 3 пациентов (7,1 %), пневмония - у 3 пациентов (7,1 %).
Во всех наблюдениях при панкреонекрозе были выполнены релапаротомия, холецистостомия, санация и дренирование брюшной полости.
Во второй группе пациентов синдрома приводящей петли не было, острый панкреатит у 3 пациентов (10 %), пневмония - у 1 пациента (3,3 %).
Гнойные осложнения возникли у 9 (21,4 %) больных (нагноение раны, абсцессы брюшной полости) 1-ой группы, и у 3 (10 %) больных 2-ой группы.
Послеоперационная летальность в первой группе составила 7,1 %. Причины послеоперационной летальности: острая сердечно-сосудистая недостаточность - у 2 больных (4,7 %), панкреонекроз - у 1 больного (2,4 %). Послеоперационной летальности во второй группе не было.
Ультразвуковое исследование у больных после гастрэктомии позволяет выявить на раннем этапе нарушения эвакуации из приводящей петли, следить за динамикой и прогнозировать течение.
Мы считаем в большинстве наблюдений нарушения эвакуации из приводящей петли у больных после гастрэктомии с энтеро-энтероанастомозом, по Braun, в послеоперационном периоде были функционального характера и вызваны изменениями нейрогенной и гуморальной стимуляции двенадцатиперстной и тощей кишки, нарушениями их координированной деятельности, рефлюксом содержимого отводящей петли в приводящую. Эти нарушения приводили к снижению перистальтики вплоть до ее полного отсутствия и развития эвакуаторных нарушений.
Таким образом, формирование арефлюксного энтеро-энтероанастомоза у больных после гастрэктомии позволяет исключить повреждения продольной и поперечной мускулатуры тонкой кишки, формируется клапанная функция устья энтеро-энтероанастомоза и при прохождении перистальтической волны препятствует рефлюксу кишечного содержимого в приводящую петлю, что снижает риск развития нарушения эвакуации приводящей петли и количество ранних послеоперационных осложнений.
Рецензенты:
Белый Л.Е., д.м.н., профессор кафедры госпитальной хирургии ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.



