Введение
Резекция дистальных отделов желудка с удалением пилорического жома является одним из наиболее часто выполняемых видов операций при новообразованиях желудка различного гистологического типа [1–3]. Наиболее частыми способами восстановления желудочно-кишечной непрерывности остаются технические вариации классических способов Бильрот Ⅰ и Бильрот Ⅱ и Y-образная реконструкция по Ру (Roux-en-Y). Эти способы не лишены существенных недостатков и в ряде случаев сопряжены с развитием пострезекционных патологических синдромов, обозначаемых как болезни оперированного желудка, в связи с чем поиск метода реконструкции, оптимального в функциональном плане, не теряет своей актуальности.
Одним из дискутабельных моментов является целесообразность и методика восстановления пассажа через двенадцатиперстную кишку (ДПК). Показано, что реконструкция по Б-II сопряжена с высокой частотой и выраженностью желчного рефлюкс-гастрита, демпинг-синдрома, риском развития рака культи желудка [4, 5]. При реконструкции по Ру рефлюксные синдромы развиваются реже [6, 7], но нередко возникают нарушения опорожнения культи желудка, демпинг-синдром. Учитывая ключевую роль ДПК в регуляции секреторной и моторно-эвакуаторной функции желудочно-кишечного тракта, восстановление дуоденального пассажа представляется важным моментом улучшения функциональных результатов дистальной резекции желудка (ДРЖ) [8, 9]. На первый взгляд, наиболее простым и очевидным способом восстановления дуоденального пассажа после ДРЖ является прямой гастродуоденальный анастомоз (способ Б-I). Однако при раке желудка (РЖ) способ Б-1 традиционно не получил широкого распространения в связи с техническими сложностями соединения маленькой культи желудка с ДПК, а также из онкологических соображений, в частности из-за опасений ранней инвазии в поджелудочную железу при местном рецидиве опухоли [10].
Цель исследования – разработка способа восстановления желудочно-кишечной непрерывности при ДРЖ с сохранением пассажа пищи через ДПК и оценка непосредственных результатов операции в сравнении с реконструкцией методом Ру.
Материал и методы исследования
В исследование включены 62 больных гистологически верифицированным РЖ, которым была выполнена ДРЖ в отделении абдоминальной онкологии Клинического онкологического диспансера г. Краснодара в 2020–2024 гг. Включены пациенты старше 18 лет, с РЖ Ⅰ–Ⅲ стадий при условии информированного добровольного согласия на участие. Критериями исключения были признаки диссеминации опухолевого процесса. Участники были рандомизированы на две группы: Ⅰ – ДРЖ с реконструкцией методом двойного тракта (МДТ), Ⅱ – ДРЖ с реконструкцией по Ру. Использование способа одобрено Независимым этическим комитетом при ФГБОУ ВО КубГМУ Минздрава России, 19.01.2022. Группы не имели статистически значимых различий по гендерному и возрастному составу, индексу массы тела, характеристикам опухоли по системе TNM и стадиям (табл. 1).
Таблица 1
Общая характеристика больных раком желудка, включенных в исследование
|
Показатель |
Группа |
Значимость |
|
|
I (n =27) |
II (n = 35) |
||
|
Пол, абс. (%) |
|||
|
Мужской |
16 (59,3%) |
24 (68,6%) |
0,577*
|
|
Женский |
11 (40,7%) |
11 (31,4%) |
|
|
Возраст, среднее (СО) |
60,6 (13,5) |
63,2 (9,4) |
0,379** |
|
Индекс массы тела, среднее (СО) |
25,1 (4,3) |
26,8 (5,9) |
0,215** |
|
Глубина инвазии опухоли, абс. (%) |
|||
|
Tis |
1 (3,7%) |
0 (0,0%) |
0,337*
|
|
T1 |
3 (11,1%) |
5 (14,3%) |
|
|
T2 |
8 (29,6%) |
11 (31,4%) |
|
|
T3 |
10 (37,0%) |
12 (34,3%) |
|
|
T4 |
5 (18,5%) |
7 (20,0%) |
|
|
Состояние лимфоузлов, абс. (%) |
|||
|
N0 |
15 (55,6%) |
17 (48,6%) |
0,662* |
|
N1 |
7 (25,9%) |
7 (20,0%) |
|
|
N2 |
3 (11,1%) |
8 (22,9%) |
|
|
N3 |
2 (7,4%) |
3 (8,6%) |
|
|
Стадия, абс. (%) |
|||
|
I |
11 (40,7%) |
10 (28,6%) |
0,710* |
|
II |
11 (40,7%) |
15 (42,9%) |
|
|
III |
5 (18,5%) |
10 (28,6%) |
|
Примечание. Группа I – с реконструкцией двойной тракт; II – с реконструкцией по Ру; * – Хи-квадрат Пирсона, асимптотическая значимость (двусторонняя); ** – t-критерий для независимых выборок, СО – стандартная ошибка среднего.
Составлена авторами на основе полученных данных в ходе исследования
Группы были сопоставимы по характеру и тяжести сопутствующей патологии. Комбинированные операции выполнены в одном случае в группе Ⅰ и в трех случаях в группе Ⅱ, разница статистически незначима.
Проводили сравнительную оценку длительности хирургического вмешательства, кровопотери, кроме того, оценивали косвенные параметры онкологической эффективности и безопасности, сравнивая общее количество удаленных лимфатических узлов, узлов с наличием метастазов, чистоту краев резекции (частоту R1 резекции). Послеоперационный период оценивали по клиническим параметрам, продолжительности послеоперационного нахождения в стационаре, характеру и тяжести послеоперационных осложнений, послеоперационной летальности. Статистическая обработка количественных и качественных показателей выполнена методами анализа таблиц сопряженности с использованием критерия χ2 Пирсона и t-теста для независимых выборок с применением программного пакета SPSS Statistics 23.0 для Windows.
Описание хирургической технологии. ДРЖ выполняется согласно техническим стандартам, принятым для патологии, по поводу которой проводят операцию, формируется культя желудка. Далее, на расстоянии 15–25 см дистальнее дуоденоеюнального перехода, обычно в проекции второго-третьего тощекишечных сосудов, пересекаются и перевязываются аркадные тощекишечные сосуды, тощая кишка пересекается. Пересечение тощей кишки выполняют линейным сшивающе-режущим аппаратом, аборальный конец пересеченной тощей кишки перемещают впередиободочно в верхний этаж брюшной полости. Линию степлерного шва перитонизируют непрерывным серо-серозным швом монофиламентной рассасывающейся нитью. Формируют гастроеюноанастомоз однорядным непрерывным швом монофиламентной рассасывающейся нитью. Анастомозированную кишку позиционируют дугообразно, подводя к дуоденальной культе, которая прошита линейным степлером на предыдущем этапе операции. Степлерный шов отсекают, вскрывают просвет ДПК. На расстоянии 25–35 см аборальнее гастроэнтероанастомоза (вариативность обусловлена индивидуальными анатомическими особенностями), между проксимальным отделом пересеченной ДПК и отводящей петлей тощей кишки формируют дуоденоеюноанастомоз «конец ДПК в бок тощей кишки» однорядным непрерывным швом монофиламентной нитью. Реконструкцию завершают восстановлением непрерывности кишечника путем формирования еюноеюноанастомоза между приводящим (оральным) отделом тощей кишки и отводящей (аборальной) Ру-петлей по типу «конец в бок» однорядным непрерывным швом монофиламентной рассасывающейся нитью, анастомоз формируют на расстоянии 20–25 см от дуоденоеюноанастомоза. Итогом реконструкции является создание двух параллельных путей пассажа пищевого комка из культи желудка – первого через отводящую петлю тощей кишки и второго через дуоденоеюноанастомоз, ДПК и далее через еюноеюноанастомоз в отводящую петлю тощей кишки (рисунок). На используемый способ оформлена заявка на патент, в настоящее время проходит этап экспертизы по существу.
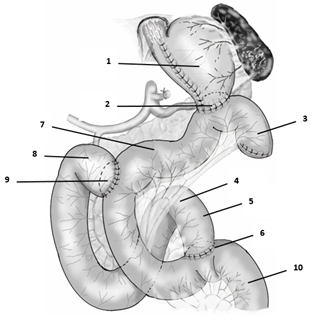
Схема дистальной резекции желудка с реконструкцией двойной тракт:
1 – культя желудка; 2 – гастроеюноанастомоз; 3 – аборальный конец пересеченной тощей кишки; 4 – дуоденоеюнальный переход; 5 – приводящий (оральный) отдел тощей кишки; 6 – еюноеюноанастомоз; 7 – отводящая петля тощей кишки; 8 – двенадцатиперстная кишка; 9 – дуоденоеюноанастомоз; 10 – отводящий отдел Ру-петли
Примечание: составлен авторами на основе полученных данных в ходе исследования
Результаты исследования и их обсуждение
Характеристика основных параметров операции и послеоперационного периода представлена в табл. 2. По продолжительности операции, средней кровопотере межгрупповых различий не отмечено. Значимых интраоперационных осложнений (инцидентов) в обеих группах не было. Патоморфологическое исследование проксимального края резекции показало отсутствие опухоли (R0) у всех пациентов обеих групп, дистальный край (дуоденальный) был расценен как микроскопически положительный (R1) у одного больного (3,7%) группы Ⅰ и у двоих (5,7%) – группы Ⅱ, различие статистически недостоверно (p=0,268).
Количество удаленных лимфатических узлов – показатель, характеризующий адекватность лимфодиссекции – статистически не различалось в группах ДРЖ с реконструкцией МДТ и ДРЖ по Ру.
Таблица 2
Характеристика параметров операции и послеоперационного периода
|
Показатель |
Группа |
Значимость |
|
|
I |
II |
||
|
Продолжительность операции, мин, средн. (СО) |
151,7 (36,5) |
156,6 (49,8) |
0,670* |
|
Кровопотеря, мл, средн. (СО) |
161,1 (64,1) |
177,1 (66,8) |
0,342* |
|
Количество удаленных лимфоузлов, средн. (СО) |
20,5 (8,8) |
17,2 (7,0) |
0,114* |
|
Длительность послеоперационной госпитализации, дней, средн. (СО) |
8,4 (2,2) |
8,4 (2,8) |
0,921* |
|
Летальность, абс. (%) |
0 (0,0%) |
1 (2,9%) |
0,376** |
|
Осложнения, абс. (%) |
0 (0,0%) |
2 (5,7%) |
0,207** |
Примечание: группа I – с реконструкцией двойной тракт; II – с реконструкцией по Ру; * – t-критерий для независимых выборок; ** – Хи-квадрат Пирсона, асимптотическая значимость (двусторонняя); СО – стандартная ошибка среднего.
Составлена авторами на основе полученных данных в ходе исследования
Течение послеоперационного периода у пациентов после ДРЖ с реконструкцией МДТ не имело существенных отличий от такового у больных после ДРЖ по Ру по параметрам активизации больных, восстановления перистальтики, начала энтерального питания. Длительность послеоперационного пребывания в стационаре статистически значимых различий между группами не имела. Летальных исходов после ДРЖ с реконструкцией МДТ не было, в контрольной группе отмечен один летальный исход (2,9%) в результате тромбоэмболии легочной артерии. Послеоперационные осложнения в первой группе зарегистрированы не были, в группе Ⅱ осложнения отмечены у двоих пациентов (5,7%), различия между группами по летальности и осложнениям статистически не значимы.
Результаты проведенных ранее исследований свидетельствуют об определенных преимуществах редуоденизации при дистальной резекции желудка в сравнении с выключающими ДПК способами. Еюнопластика интерпозицией тонкокишечного сегмента, ввиду ее технической сложности, применялась в небольшом количестве исследований, с малым числом выборок, при этом исследователи отмечают функциональное превосходство этого метода над гастродуоденостомией по Бильрот Ⅰ [11, 12]. Преимущества реализуются в более низкой частоте желчного рефлюкс-гастрита, а также в лучшем восстановлении алиментарного статуса и качества жизни в послеоперационном периоде [13, 14]. Несмотря на это, ДРЖ с еюнопластикой в хирургической практике выполняется достаточно редко, основная доля современных исследований принадлежит азиатским авторам [15–17]. Отечественные хирургические школы также продолжают исторически приоритетные исследования в данной области [18].
Разработанный в данном исследовании способ ДРЖ с реконструкцией методом двойного тракта сочетает в себе технические приемы методов Бильрот Ⅰ и реконструкции по Ру; такое сочетание, по нашему мнению, нивелирует негативные свойства и реализует функциональные преимущества каждого из этих способов. Выполненное исследование подтвердило хирургическую безопасность операции, полученные результаты свидетельствуют о том, что ДРЖ с реконструкцией методом двойного тракта не имела статистически значимых отличий от стандартной ДРЖ по Ру по длительности операции, величине кровопотери, частоте интраоперационных и послеоперационных осложнений.
Поскольку операции выполнялись у пациентов со злокачественными новообразованиями, для нас важным критерием оценки была онкологическая адекватность операции, ее соответствие критериям онкологической радикальности. Показатели, косвенно отражающие онкологическую радикальность и безопасность, – чистота краев резекции, количество удаленных лимфоузлов – не отличались от аналогичных в группе стандартной резекции по Ру, что позволяет рекомендовать методику двойного тракта для использования у пациентов с РЖ. Следует учитывать то, что в действующих клинических рекомендациях по лечению РЖ способ реконструкции после ДРЖ оговаривается в рекомендательном плане и выбор его конкретного метода остается на усмотрение оперирующего хирурга.
Заключение
ДРЖ с реконструкцией методом двойного тракта сопоставима со стандартной резекцией желудка по Ру по длительности операции, величине кровопотери, частоте интраоперационных и послеоперационных осложнений, параметрам онкологической адекватности операции. Это позволяет рекомендовать описанный способ для использования в практике у больных РЖ. Отдаленные функциональные результаты способа требуют дальнейшего изучения.



