Введение
Множественная миелома является злокачественным лимфопролиферативным заболеванием, которое часто сопровождается развитием полинейропатии (ПНП), а применяемая для лечения миеломной болезни химиотерапия может индуцировать или усугублять ПНП, создавая терапевтические трудности и значительно снижая качество жизни пациентов. В последние годы наблюдается значительный рост интереса к изучению неврологических осложнений, связанных с онкологическими заболеваниями, в частности ПНП, возникающими на фоне терапии множественной миеломы. Возникновение ПНП, как одного из наиболее распространенных осложнений, связывают с терапией бортезомибом, ингибитором протеасом, который является основным компонентом в лечении множественной миеломы. Ретроспективные исследования, проводимые за последние 10 лет, показывают, что ПНП возникает у 30–50% пациентов, получающих лечение множественной миеломы с использованием бортезомиба [1–3]. В связи с успешным применением противоопухолевой терапии (в частности, химиотерапии) предполагается уменьшение смертности от онкологических заболеваний [4], однако данный (разумеется, положительный) факт может привести к росту количества неврологических осложнений. В связи с этим возрастает и количество исследований, направленных на поиск диагностических и профилактических мер в отношении развития химиоиндуцированной полинейропатии (ХИПН) [5]. На развитие ХИПН, помимо лекарственного воздействия, могут оказать влияние старший возраст пациентов, вредные привычки, сопутствующие заболевания (нарушение функции почек, щитовидной железы, сахарный диабет и др.), наследственный фактор [6, 7]. Предшествующее химиотерапевтическое лечение по поводу других заболеваний (в анамнезе) также может явиться предиктором развития неврологических осложнений [8, 9]. При этом данные других авторов [10] не подтверждают влияние возраста и наличия сахарного диабета на клинические проявления ХИПН. По данным мировой литературы, частота развития ПНП варьирует от 30до 50%, что подчеркивает высокую встречаемость данного осложнения среди больных множественной миеломой [11].
Бортезомиб-индуцированная полинейропатия (БИПН) является преимущественно дозозависимой токсической лекарственной ПНП, характеризующейся диффузным поражением различных типов волокон периферических нервов [12]. Для химиоопосредованной ПНП характерно поражение тонких волокон и начало клинических проявлений с нижних конечностей, однако описано множество клинических случаев, демонстрирующих клиническую гетерогенность патологической картины [13]. При этом важным является представление о клинических проявлениях ПНП при использовании конкретных химиотерапевтических препаратов для своевременной диагностики нейрогенного токсического воздействия. В ряде случаев диагностика начальных (порой субъективных) признаков БИПН диктует необходимость смены схем противоопухолевой терапии.
Бортезомиб является противоопухолевым препаратом первой линии в терапии множественной миеломы и представляет собой дипептид, в котором вместо карбоновой кислоты содержится борная. Именно благодаря наличию атома бора бортезомиб может связываться с участком протеасомы, катализирующей расщепление основных белков жизненного цикла клетки; таким образом реализуется противоопухолевое действие препарата. Нейротоксическое действие препарата обусловлено его воздействием на повышение активности некоторых сфинголипидов (сфингозин-1-фосфат, церамид), обладающих провоспалительным действием. Важно подчеркнуть, что указанная активация сфинголипидов также может повысить их воздействие на ноцицепторы, уменьшая тем самым порог болевого восприятия [14, 15].
Таким образом, нейротоксичность химиопрепаратов и, в частности, бортезомиба является результатом как прямого токсического воздействия на нейрон, так и опосредованного следствия повреждения глии, периневрального воспаления и иных механизмов, способствующих формированию разнообразных клинических проявлений ХИПН.
В исследовании представлена характеристика БИПН у пациентов с множественной миеломой, проходивших стационарное лечение в специализированном гематологическом отделении Краевой клинической больницы в период с 2023 по 2025 г. по данным анализа медицинских карт пациентов, получавших лечение в стационарных условиях.
Цель исследования – оценка частоты развития и характеристика БИПН у пациентов с диагностированной множественной миеломой, проходивших программную химиотерапию в отделении гематологии и химиотерапии.
Задачами исследования являлись: анализ частоты развития БИПН, выявление возможных факторов риска развития БИПН.
Материал и методы исследования
Проведено ретроспективное аналитическое исследование. Авторами проанализировано 110 медицинских карт пациентов, получавших программную химиотерапию в отделении гематологии и химиотерапии ГБУЗ ПК «Ордена “Знак Почета” Пермская краевая клиническая больница» с 2023 по 2025 г. Диагноз был установлен в соответствии с действующими клиническими рекомендациями по диагностике и лечению пациентов с множественной миеломой на основании плазмоклеточной инфильтрации костного мозга, выявлении парапротеина в сыворотке крови и/или в разовой порции мочи путем иммунофиксации, наличия CRAB-критериев (C (calcium) – уровень общего сывороточного кальция в сыворотке ≥ 2,65 ммоль/л (≥ 11,5 мг/дл), R (renal) – уровень креатинина сыворотки крови > 177 мкмоль/л (или > 2 мг/дл) или расчетный показатель клиренса креатинина < 40 мл/мин, A (anemia) – снижение уровня гемоглобина ≥ 20 г/л от нижней границы нормы (130 для мужчин и 120 для женщин) или уровень гемоглобина < 100 г/л, B (bones) – один или более остеолитический очаг, выявленный при рентгенографии, КТ или ПЭТ/КТ. При плазмоклеточной инфильтрации костного мозга менее 10% должно выявляться более одного очага поражения костей). Все пациенты в качестве первой линии терапии получали специфическую терапию в виде курсовой химиотерапии по протоколу VCD (Бортезомиб, Циклофосфамид, Дексаметазон). Бортезомиб вводился подкожно в 1, 4, 8, 11 дни каждого курса в дозировке 1,3 мг/м2. Согласно клиническим рекомендациям, назначалось проведение 6–8 подобных курсов химиотерапии с последующим рестадированием пациентов. В качестве первичной профилактики неврологических осложнений всем пациентам на амбулаторном этапе в период между курсами химиотерапии назначалась тиоктовая кислота в виде капсул 600 мг в дозировке 600 мг/сутки.
В выборку вошли мужчины (n=56) и женщины (n=54) в возрасте от 35 до 86 лет. Средний возраст пациентов составил 65,34±1,05 года. Пациенты были распределены на две равные группы (n=55): моложе и старше 65 лет. Разделение на данные группы обусловлено тем, что одним из доказанных факторов риска развития БИПН является возраст старше 65 лет [12].
Критерии включения: наличие достоверного диагноза множественной миеломы без предшествующего химиотерапевтического лечения, бортезомиб-содержащие курсы химиотерапии в качестве первой линии, отсутствие ПНП до начала химиотерапии, письменное информированное согласие пациента на исследование.
Оценка степени тяжести нейротоксичности проводилась при помощи шкалы National Cancer Institute Common Terminology Criteria for Adverse Events (NCI-CTCAE) 2017 г. [16], которая используется в работе гематологического отделения, а также прописана в клинических рекомендациях по диагностике и лечению пациентов с множественной миеломой для коррекции дозы бортезомиба при выявлении полиневральных нарушений. Нежелательные явления по данной шкале представляют собой оценку параметров побочных эффектов лекарств, применяемых для лечения рака [17]. Используемый вариант (5,0) содержит оценку как сенсорного, так и моторного компонентов ПНП. Отдельно выделяли наличие сопутствующих заболеваний (сахарный диабет, артериальная гипертензия) как возможных факторов, влияющих на возникновение ХИПН. Все пациенты были распределены по группам в зависимости от тяжести проявлений ПНП. I степень устанавливалась на основании наличия парестезий, слабости и/или снижения рефлексов без боли или потери функции. II степень характеризовалась ограничением жизненной активности без потребности в аналгезии. ПНП III степени соответствовали выраженная боль в сочетании с нарушением функции и жизненной активности. ПНП IV степени (инвалидизирующая) не была выявлена ни у одного пациента в ходе данного исследования.
Статистическая обработка полученных данных выполнена с помощью методов описательной и непараметрической статистики с использованием компьютерных программ Microsoft Excel 2000 и STATISTICA 6.0 в среде Windows 2000. Различия между сравниваемыми показателями считали статистически значимыми при значимости p < 0,05.
Результаты исследования и их обсуждение
На основании проведенного ретроспективного анализа среди исследуемой группы пациентов развитие БИПН наблюдалось у 46 (41,8%) чел. У 15 (32,6%) из них ее тяжесть соответствовала I степени, у 23 (50,0%) и 8 (17,4%) пациентов II и III степени соответственно. IV степени токсичности у пациентов в данном исследовании, как было указано ранее, не наблюдалось. Распределение пациентов в зависимости от степени БИПН представлено в таблице. Всем пациентам проведено от двух до восьми курсов химиотерапии. У 40 (87%) пациентов первые признаки ПНП возникали во время проведения начальных трех циклов терапии. Максимальные клинические проявления констатировались к пятому курсу. Начальные клинические проявления БИПН у 6 (13%) больных возникли после четырех-пяти курсов лечения.
Распределение пациентов в зависимости от проявления БИПН
|
Степень БИПН |
Пациенты |
|
|
Мужчины, n |
Женщины, n |
|
|
I |
8 |
7 |
|
II |
11 |
12 |
|
III |
5 |
3 |
|
IV |
0 |
0 |
В исследуемой группе преобладала смешанная сенсомоторная нейропатия, которая была выявлена у 34 (73,9%) больных, в то время как изолированная сенсорная нейропатия отмечена у 12 (26,1%). У 23 (50%) пациентов с различными клиническими вариантами ПНП присутствовал болевой компонент. Однако оценка выраженности и различных компонентов боли (нейропатическая, ноцицептивная) была в значительной степени осложнена наличием остеодеструктивного синдрома у 32 (29%). При этом 66 (60,0%) пациентов получали анальгетическую терапию до начала химиотерапии. Из них 27 (45,0%) пациентов получали сильнодействующие препараты, в том числе наркотические (Трамадол, Тапентадол, Фентанил).
Особое внимание следует уделить сроку дебюта полинейропатии. Согласно данной выборке 13,2% (n=13) пациентов с полинейропатией отметили какие-либо признаки ПНП после первого курса.
В ходе исследования была проанализирована связь между наличием сопутствующих заболеваний и риском развития БИПН. Из 110 пролеченных пациентов у 65% (n=72) были выявлены сопутствующие заболевания, что значительно влияло на частоту и тяжесть неврологических осложнений. Наиболее распространенными сопутствующими заболеваниями в представленной выборке являлись гипертоническая болезнь (32%, n=35) и сахарный диабет 2 типа (27%, n=30). Частота развития БИПН напрямую коррелировала с наличием у пациента сахарного диабета (p=0,01). Так, у пациентов с сахарным диабетом БИПН I, II или III степени регистрировалась чаще в 2,7; 2,1; 2,3 раза соответственно (рисунок).
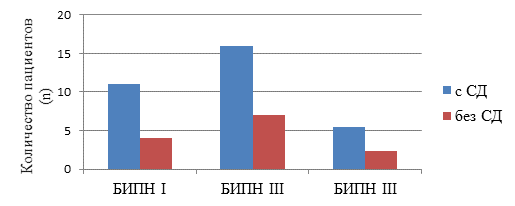
Структура БИПН в зависимости от наличия сахарного диабета (СД)
Примечание: составлен авторами по результатам данного исследования
Полученные данные подтверждают гипотезу о том, что диабет может усиливать нейротоксические эффекты, вызываемые терапией бортезомибом. Кроме того, результаты анализа показали, что артериальная гипертензия также имеет значительное влияние на развитие полинейропатии. У пациентов с повышенным артериальным давлением наблюдалась более высокая частота возникновения легкой и умеренной степени БИПН – 38% против 22% у пациентов с нормальным уровнем давления (р=0,04). Важно отметить, что сочетание гипертонии и диабета значительно увеличивало риск тяжелой формы полинейропатии (у 60% пациентов с артериальной гипертензией в сочетании с сахарным диабетом, n=3, зафиксирована БИПН III степени). Таким образом, результаты исследования подтверждают существующую связь между сопутствующими заболеваниями и риском развития БИПН [6].
В отличие от общемировой статистики, авторами в данном ретроспективном исследовании не было выявлено статистически значимого увеличения частоты БИПН у пациентов старше 65 лет (р=0,075) по сравнению с пациентами более молодой группы. Предполагается, что данные расхождения могут быть связаны с гиподиагностикой, так как зачастую пациенты старшего возраста получали от двух до четырех курсов химиотерапии амбулаторно в регионах по месту жительства без неврологического мониторинга, что диктует необходимость усовершенствования методов амбулаторного наблюдения за данной группой пациентов медицинскими работниками общего звена. Также не было получено статистически значимой связи между полом, частотой развития и степенью тяжести БИПН (р=0,926, р=0,567 соответственно).
Заключение
Полинейропатия является частым осложнением как самого течения множественной миеломы, так и ее терапии, что существенно снижает качество жизни пациента и оказывает влияние на конечную эффективность лечения. Первичная профилактика полинейропатии путем назначения тиоктовой кислоты зачастую оказывается недостаточной, что обусловливает необходимость поиска новых препаратов как для профилактики, так и для лечения БИПН. Необходим постоянный мониторинг жалоб пациента с целью раннего выявления БИПН для доклинической или ранней клинической диагностики неврологических нарушений и предупреждения развития инвалидизирующих осложнений на всех этапах ведения пациента (во время прохождения химиотерапевтического лечения в специализированном отделении, при нахождении в других отделениях многопрофильного стационара, при ведении пациента врачами поликлинического звена, во время перерывов между курсами химиотерапии).
Частота встречаемости БИПН в реальной клинической практике может существенно отличаться от мировой статистики, что обусловлено в первую очередь отсутствием единого четкого алгоритма раннего выявления и оценки динамики полиневральных нарушений у пациентов гематологического профиля. Перспективным является поиск ранних предикторов развития периферической полинейропатии у пациентов с множественной миеломой до начала терапии нейротоксичными препаратами с целью своевременной коррекции лечения и сохранения более высокого качества жизни пациентов в процессе программной химиотерапии. Авторы считают рациональным предложение об использовании балльных валидизированных диагностических шкал в процессе химиотерапии (в том числе использование опросников для пациентов для более детальной оценки наличия различных проявлений полинейропатии), что позволит заподозрить наличие у пациента ранних признаков полиневральных нарушений даже без консультации врача-невролога.



