Введение
Эпидемиологические исследования, проведенные в рамках проекта GLOBOCAN (2018), демонстрируют значимую роль неходжкинских лимфом (НХЛ) в структуре онкологической патологии. Согласно полученным данным, в 2018 году мировая заболеваемость НХЛ достигла 509 600 новых случаев, что составило 2,8% от общего числа диагностированных злокачественных новообразований. При этом показатель летальности сохраняет тревожные значения: 248 700 случаев смерти, соответствующих 2,6% от общей онкологической смертности. Подобная статистика подчеркивает необходимость дальнейшего совершенствования подходов к терапии данной группы заболеваний [1; 2].
Согласно статистическим данным, в 2023 году в РФ было зарегистрировано 17 498 новых случаев злокачественных заболеваний кроветворной и лимфатической ткани, из них 18.9% на III стадии заболевания и 19.4% на IV стадии [3]. Прогресс медицинской науки в области онкогематологии привел к созданию молекулярных таргетных препаратов, что позволило увеличить продолжительность жизни и улучшить ее качество у пациентов с онкогематологическими заболеваниями [4; 5]. Однако, несмотря на значительные достижения в терапии, в течение года с момента установления диагноза летальность остается высокой [6]. Это подчеркивает необходимость разработки более эффективных и безопасных подходов к лечению.
Цель исследования:анализ современных данных о роли вторичных метаболитов растений в терапии онкогематологических заболеваний и оценка перспектив их применения.
Материалы и методы исследования. Поиск литературы осуществлялся в базах данных PubMed, «КиберЛенинка», Google Scholar и eLIBRARY.RU на русском и английском языках за период с 2005 по 2025 г. Обоснованием для выбора данного временного периода анализа является необходимость охвата наибольшего числа публикаций, отражающих результаты экспериментальных и теоретических работ различных групп исследователей. Для поиска использовались следующие запросы: «secondary metabolites», «вторичные метаболиты растений», «hematology», «oncology», «онкогематологические заболевания». На рисунке 1 представлен отбор публикаций в соответствии с принципами PRISMA. Включены были только статьи, опубликованные в рецензируемых научных журналах, посвященные влиянию вторичных метаболитов растений на онкогематологические заболевания. Исключены работы, не относящиеся к теме исследования, а также постерные доклады, диссертации, материалы симпозиумов и конференций. На стадии первичного поиска было найдено 4800 статей в PubMed, 484 - в «КиберЛенинке», 2140 - в Google Scholar и 4110 - в eLIBRARY.RU. После применения критериев включения и исключения, а также удаления дубликатов в финальный анализ было включено 50 статей.
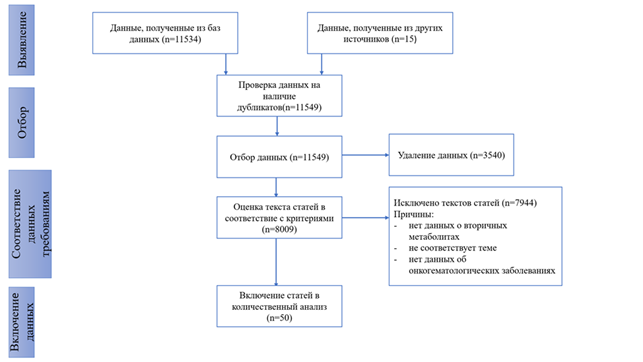
Рис. 1. Блок-схема отбора исследований в соответствии с рекомендациями PRISMA
Результаты исследования и их обсуждение
Дифференцировка В-лимфоцитов представляет собой многоэтапный процесс, нарушения которого на различных стадиях приводят к развитию лимфопролиферативных заболеваний [7]. В костном мозге стволовые клетки последовательно превращаются в про-В-клетки (D-J рекомбинация), затем пре-В-клетки (V-DJ рекомбинация) и незрелые В-лимфоциты (V-J рекомбинация легкой цепи). После миграции в лимфоузлы они проходят отбор в зародышевых центрах (гипермутагенез и переключение классов Ig), превращаясь в зрелые В-клетки или плазматические клетки [8–10].
Функционирование В-лимфоцитов поддерживается сбалансированным взаимодействием сигнальных путей, обуславливающих активацию клетки, процессы дифференцировки, пролиферации и апоптоза [11]. Эти сигнальные каскады обеспечивают развитие адаптивного гуморального иммунного ответа, поддержание клеточного гомеостаза, регуляцию взаимодействий с клетками и молекулами микроокружения. Так, пути JAK/STAT PI3K/AKT и MAPK, активация транскрипционного фактора NF-κB играют ключевую роль в осуществлении функций лимфоцитов, включая их активацию в ответ на антигенные стимулы, контроль клеточного цикла и регулирование клеточной смерти [12–14]. Нарушение этой гармонии вследствие генетических изменений или воздействия экзогенных факторов может привести к неконтролируемой пролиферации и иммортализации клеток, а также к утрате иммунного контроля, что является основой для развития неоплазий [15].
Патогенез неходжкинских лимфом связан с нарушением регуляции сигнальных путей, что приводит к бесконтрольному делению опухолевых клеток [16]. Активация пути JAK/STAT3 способствует индукции пролиферации и выживанию опухолевых клеток, а также подавлению апоптоза. NF-κB играет ключевую роль в поддержании выживания опухолевых клеток и их устойчивости к терапии [17]. Пути PI3K/AKT и MAPK усиливают клеточную пролиферацию, способствуют инвазии клеток. Молекулы Src, ErbB2 (HER2) и EGFR усиливают миграцию клеток и их устойчивость к химиотерапии. Экспрессия Bcl-xL подавляет апоптоз, а циклин D1 нарушает контроль клеточного цикла, приводя к бесконтрольному делению [18]. VEGF, TNF и TGF-β регулируют ангиогенез, развитие воспаления и опухолевый рост [19]. Взаимодействие данных молекул создает условия для выживания, пролиферации и метастазирования опухолевых клеток.
Нарушение регуляции дифференцировки В-лимфоцитов на различных этапах созревания приводит к развитию лимфопролиферативных заболеваний [20]. Фолликулярная лимфома возникает из В-клеток герминального центра, сохраняющих фолликулярную организацию ткани, но теряющих контроль пролиферации [21; 22]. Лимфома из клеток маргинальной зоны развивается при нарушении постгерминальной дифференцировки [23]. Диффузная В-крупноклеточная лимфома (ДВКЛ) формируется из В-клеток зародышевого центра с утратой регуляции роста и созревания, тогда как лимфома Беркитта характеризуется крайне высокой пролиферативной активностью тех же клеток-предшественников [24; 25]. Вотличие от этих заболеваний,множественная миеломапроисходит из плазматических клеток (терминально дифференцированных эффекторных В-клеток, утративших поверхностный BCR и способных к секреции антител), теряющих способность к апоптозу и сохраняющих моноклональную секрецию иммуноглобулинов (рис. 2) [26; 27].
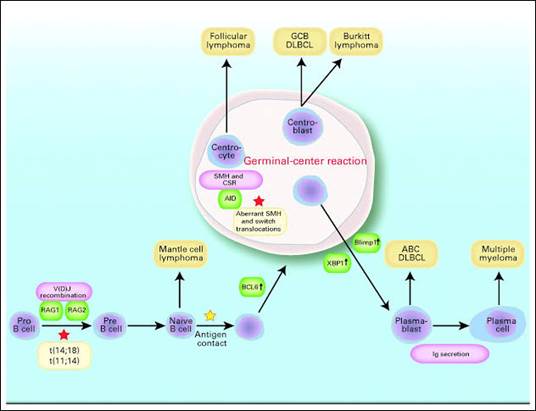
Рис. 2. Схема дифференцировки B-лимфоцитов и ассоциированных лимфопролиферативных заболеваний [26]
Примечание: GCB DLBCL – диффузная В-крупноклеточная лимфома из клеток герминативного центра, Burkitt lymphoma – лимфома Беркитта, Centrocyte – центроцит, Germinal-center reaction – реакция герминативного центра, SHM and CSR – соматический гипермутагенез и переключение классов иммуноглобулинов, AID – индуцированный активацией цитидиндезаминаза, Aberrant SHM and switch translocations – аберрантный соматический гипермутагенез и транслокации при переключении классов, Mantle cell lymphoma – мантийноклеточная лимфома, RAG1 / RAG2 – RAG1 / RAG2 (белки, осуществляющие V(D)J-рекомбинацию), аntigen contact – контакт с антигеном, Blimp1 – белок 1, индуцирующий дифференцировку В-лимфоцитов, XBP1 – X-связывающий белок 1, ABC DLBCL – активированная В-клетками диффузная В-крупноклеточная лимфома, Multiple myeloma – множественная миелома,· Plasma cell – плазматическая клетка, Ig secretion – секреция иммуноглобулина.
Современные стратегии лечения онкогематологических заболеваний включают химиотерапию, таргетные препараты (ингибиторы BTK, моноклональные антитела), иммунотерапию (CAR-T-терапия), трансплантацию гемопоэтических стволовых клеток [28–30]. Однако существующая, несмотря на прогресс, проблема резистентности и рецидивов диктует необходимость создания новых терапевтических стратегий, направленных на коррекцию функционирования сигнальных путей.
Производные растений представляют собой перспективный ресурс для разработки терапевтических средств, являясь биологически более совместимыми и коэволюционирующими с организмом человека. Они проявляют избирательную цитотоксичность по отношению к опухолевым клеткам и минимальную токсичность по отношению к нормальным клеткам [31]. Это делает их ценным источником для разработки новых эффективных и безопасных терапевтических средств.
Растительные клетки обладают уникальной способностью синтезировать не только первичные метаболиты - углеводы, аминокислоты, жирные кислоты, нуклеотиды, но и множество других соединений, не участвующих в основном обмене веществ [32]. Их принято называть вторичными метаболитами, или веществами вторичного происхождения. Вторичные метаболиты растений классифицируются на основе их химической структуры на три основных класса: терпеноиды (изопреноиды), фенольные соединения и алкалоиды (рис. 3) [33; 34]. Так, вторичные метаболиты растений - это общий термин, используемый для более чем 12 000 алкалоидов, 40 000 терпеноидов и 8000 фенольных соединений [35].
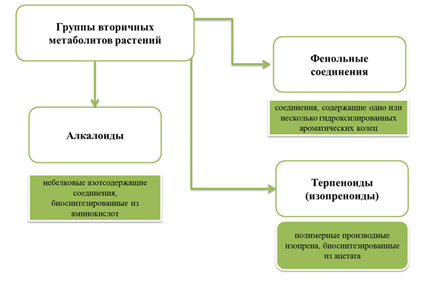
Рис. 3. Основные группы вторичных метаболитов растений [33; 34]
На сегодняшний день в онкологии уже широко применяются лекарственные препараты, созданные на основе растительных компонентов (табл. 1).
Таблица 1
Препараты растительного происхождения
|
Название соединения |
Источник (растение) |
Механизм действия |
Применение (опухоли) |
Источник литературы |
|
Паклитаксел |
Тихоокеанский тис (Taxus brevifolia) |
Связывается с микротрубочками, блокирует митоз |
Рак молочной железы, яичников, лёгких |
[36; 37] |
|
Винкристин/ Винбластин |
Барвинок розовый (Catharanthus roseus) |
Нарушает сборку микротрубочек, блокирует деление клеток |
Лимфомы, лейкозы |
[38] |
|
Иринотекан |
Камптотека китайская (Camptotheca acuminata) |
Ингибирует топоизомеразу I, вызывает разрывы ДНК |
Колоректальный рак, рак лёгкого |
[39] |
|
Этопозид |
Подофилл (Podophyllum peltatum) |
Ингибирует топоизомеразу II, вызывает повреждение ДНК и апоптоз |
Лимфомы, рак лёгкого, яичников, тестикул |
[40; 41] |
Составлено авторами на основе источников [36-41].
Алкалоиды, флавоноиды и терпеноиды активно изучаются в контексте их противоопухолевой активности, однако большинство исследований сосредоточено на их использовании для лечения солидных опухолей. В то же время потенциал вторичных метаболитов растений в лечении онкогематологических заболеваний изучен значительно меньше.
Берберин - природный алкалоид изохинолинового ряда, широко представленный в различных лекарственных растениях, включая Hydrastis canadensis, Cortex phellodendri и Rhizoma coptidis. Данное соединение традиционно используется в китайской медицине и обладает доказанной фармакологической активностью, включая антиоксидантный, противовоспалительный и противоопухолевый эффекты. Современные исследования подтвердили противоопухолевую эффективность берберина при различных злокачественных новообразованиях, в частности при гепатоцеллюлярной карциноме и колоректальном раке. Механизм действия соединения связан с модуляцией ключевых сигнальных путей (AMPK, mTOR, NF-κB; табл. 2), регулирующих клеточный метаболизм, пролиферацию, апоптоз и воспалительные процессы. Эти свойства делают берберин перспективным кандидатом для разработки новых терапевтических стратегий в онкогематологии [42–44].
Наряду с берберином значительным терапевтическим потенциалом обладает куркумин - основной биоактивный полифенол куркумы (Curcuma longa). Если механизм действия берберина связан преимущественно с модуляцией AMPK/mTOR-зависимых метаболических путей, то куркумин проявляет противоопухолевую активность через ингибирование ключевых провоспалительных и пролиферативных сигнальных каскадов, включая NF-κB, STAT3 и PI3K/Akt (табл. 2). Экспериментальные исследования демонстрируют его способность индуцировать апоптоз, подавлять ангиогенез и потенцировать эффекты химиотерапии при различных типах злокачественных новообразований. Однако, несмотря на многообещающие доклинические данные, применение куркумина в онкогематологии требует дальнейших исследований, направленных на преодоление его низкой биодоступности [45–47].
Особый интерес среди растительных метаболитов представляют биологически активные компоненты зверобоя продырявленного (Hypericum perforatum), включая гиперецин, гиперфорин и флавоноидные соединения. Эти вещества демонстрируют выраженную модулирующую активность в отношении ключевых онкогенных сигнальных путей, в частности ингибируя PI3K/Akt-каскад и подавляя NF-κB-опосредованную транскрипцию (табл. 2) [48–50]. Современные исследования указывают на перспективность включения экстрактов зверобоя в схемы комбинированной терапии, что может позволить снизить токсическую нагрузку при одновременном повышении эффективности стандартных протоколов лечения. Однако реализация этого потенциала требует дальнейшего изучения фармакокинетики и оптимальных режимов дозирования данных соединений.
Таблица 2
Новые препараты растительного происхождения
|
Название соединения |
Источник (растение) |
Механизм действия |
Источник литературы |
|
Берберин (Berberine) |
Барбарис обыкновенный (Berberis vulgaris) |
Сигнальные пути AMPK, mTOR, ингибирование транскрипционного фактора NF-κB |
[42-44] |
|
Куркумин (Curcumine) |
Куркума (Curcuma longa) |
Сигнальные пути STAT3 и PI3K/Akt, ингибирование транскрипционного фактора NF-κB |
[45-47] |
|
Гиперецин, гиперфорин (HF) |
Зверобой продырявленный (Hypericum perforatum) |
Сигнальный путь PI3K/Akt, ингибирование транскрипционного фактора NF-κB |
[48-50] |
Составлено авторами на основе источников [42-50].
Заключение. Таким образом, вторичные метаболиты растений представляют собой перспективную основу для разработки новых противоопухолевых препаратов в онкогематологии. Современные возможности молекулярной биологии, генетики, иммунологии позволяют идентифицировать новые биологически активные соединения, изучать их механизмы действия на молекулярном уровне. Несмотря на существующие ограничения, такие как низкая биодоступность, необходимость дальнейших клинических испытаний, эти соединения открывают новые возможности для создания более эффективных и безопасных схем терапии, включая комбинированное применение с традиционными противоопухолевыми препаратами. Дальнейшие исследования в этом направлении могут существенно расширить арсенал средств для лечения онкогематологических заболеваний.



