Введение
Глиобластома (ГБМ) - наиболее распространенная и агрессивная первичная опухоль головного мозга у взрослых, относящаяся к глиомам IV степени злокачественности по классификации Всемирной организации здравоохранения (ВОЗ) [1]. На ее долю приходится около 30% всех опухолей центральной нервной системы (ЦНС) и до 80% всех первичных злокачественных новообразований данной локализации [2]. Современный стандарт лечения, включающий хирургическое удаление опухоли в максимально допустимом объеме с сохранением онкофункционального баланса, с последующей лучевой терапией и адъювантной химиотерапией темозоломидом (ТМЗ), демонстрирует ограниченную эффективность. Прогноз для пациентов остается неблагоприятным: медиана общей выживаемости не превышает 15–18 месяцев с момента постановки диагноза [2; 3]. Терапевтическое действие как лучевой терапии, так и ТМЗ основано на индукции повреждений ДНК в опухолевых клетках [2]. Однако развитие резистентности, в частности за счет активации систем репарации ДНК и формирования толерантности к терапии, значительно ограничивает эффективность существующих подходов. В связи с этим поиск новых препаратов, обладающих иными механизмами действия и повышенной селективностью в отношении опухолевых клеток, представляет собой актуальную задачу.
Перспективным направлением в разработке новых противоопухолевых средств является изучение бициклических азотсодержащих гетероциклических соединений [4]. Особый интерес среди данных соединений представляют трополоновые производные, включая как природные растительные метаболиты, так и искусственно созданные аналоги. На сегодняшний день известно свыше 200 природных веществ, обладающих трополоновой каркасной структурой. Их уникальная химическая структура и широкий спектр биологической активности, включающий противоопухолевые, противовирусные и противовоспалительные свойства [5–7], обусловливают высокий фармакологический потенциал этого класса. Недавние исследования сосредоточены на синтезе новых производных трополонового ряда для реализации их терапевтического потенциала в онкологии. Многофакторный механизм действия, включающий ингибирование протеинкиназ, нарушение сборки микротрубочек и индукцию апоптоза [8], открывает значительные перспективы для создания эффективных химиотерапевтических агентов [9; 10].
Одним из таких соединений является производное трополона 2-(1,1-диметил-1H-бензо[e]индолин-2-ил)-5,6,7-трихлор-1,3-трополон (JO-122(2)), синтезированное в Южном федеральном университете. Продемонстрированная высокая цитотоксическая активность этого соединения в отношении линий опухолевых клеток A431 и H1299 [11] позволяет предположить его потенциальную эффективность против других агрессивных злокачественных новообразований, в том числе ГБМ. Известно, что различные производные трополона проявляют свою активность через разнообразные механизмы: например, хинокитиол ингибирует миграцию клеток рака легкого, воздействуя на NF-κB и матриксные металлопротеиназы [12], комплексы меди с трополоном превосходят цисплатин в моделях рака молочной железы [5], а производное трихлортрополона с заместителем хинолинового ряда показало эффективность против немелкоклеточного рака легкого [13]. В совокупности эти данные подчёркивают значительный терапевтический потенциал производных трополона.
Цель исследования: оценить противоопухолевую эффективность соединения JO-122(2) в режиме монотерапии и в комбинации с темозоломидом на модели ксенотрансплантатов глиобластомы человека U87MG.
Материалы и методы исследования
Соединение JO-122(2) было синтезировано в НИИ Физической и органической химии Южного федерального университета (Ростов-на-Дону, Россия). Темозоломид (ТМЗ) приобретен у компании «BIOCAD» (Санкт-Петербург, Россия).
Учитывая ограниченную растворимость трополона в нетоксичных растворителях, была использована специальная схема приготовления вводимого раствора. Навеску соединения JO-122(2) предварительно растворяли в 100 мкл диметилсульфоксида (ДМСО) («Биолот», Санкт-Петербург, Россия), затем полученный раствор смешивали с 1% суспензией крахмала. Общий объем вводимого препарата рассчитывали исходя из максимально допустимого для перорального введения мышам (2 мл/100 г массы тела).
Клетки линии ГБМ человека U87MG культивировали в среде DMEM (Gibco, США) с 10% FBS (Himedia, Индия), 2 мМ L-глутамином («ПанЭко», Россия), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина («Биолот», Россия).
Культивирование проводили при 37 °C во влажной среде с 5% CO2. При достижении 70–80% конфлюэнтности клетки пассировали с использованием трипсина.
Эксперименты проводили на мышах линии Balb/c Nude (возраст 5–6 недель) в SPF-виварии ФГБУ «НМИЦ онкологии» Минздрава России. Протокол исследования был рассмотрен и одобрен локальным биоэтическим комитетом ФГБУ «НМИЦ онкологии» Минздрава России (протокол № 8/218 от 22.12.2023 г.). Животных содержали в системе индивидуально вентилируемых клеток (IVC, Tecniplast, Италия) при строго контролируемых условиях: температуре 21–26 °C и относительной влажности 50–60%. Мыши имели свободный доступ к автоклавированным стерильным корму и воде.
Для формирования опухолей мышам подкожно вводили в правый бок 200 мкл суспензии, содержащей 5×106 жизнеспособных клеток U87MG в среде DMEM без сыворотки. Жизнеспособность клеток определяли методом исключения трипанового синего (>95%). Рост ксенографтов регулярно контролировали и терапию начинали, когда объем опухолей достигал пальпируемого размера (~100 мм3).
Перед началом терапевтического вмешательства животных-опухоленосителей методом рандомизации распределили на четыре экспериментальные группы (n=8 в каждой), обеспечив максимальную сопоставимость исходных объемов опухолевых узлов между группами.
• Группа 1 (контроль): животные получали эквивалентные объемы растворителя - физиологический раствор (0,9%, внутрибрюшинно, ежедневно) и 1% крахмальный гель c ДМСО (перорально, три раза в неделю).
• Группа 2 (ТМЗ): темозоломид (20 мг/кг, внутрибрюшинно, ежедневно).
• Группа 3 (JO-122(2)): JO-122(2) (60 мг/кг, перорально, три раза в неделю).
• Группа 4 (JO-122(2) + ТМЗ): JO-122(2) (60 мг/кг, перорально, три раза в неделю) в комбинации с темозоломидом (20 мг/кг, внутрибрюшинно, ежедневно).
Доза и схема введения ТМЗ были выбраны на основании литературных данных, соответствующих стандартным режимам в доклинических исследованиях на моделях глиомы [14]. Все препараты вводили без привязки к графику кормления.
Продолжительность курса терапии составила 25 дней. Объем опухоли измеряли раз в 3 дня с помощью цифрового штангенциркуля и рассчитывали по формуле:
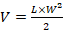 ,
,
где L - длина, а W - ширина.
Противоопухолевую эффективность оценивали с помощью показателя торможения роста опухоли (ТРО, %), который рассчитывали следующим образом:
 ,
,
где Vк - средний объем опухоли (мм³) в контрольной группе, а Vо - средний объем опухоли (мм³) в опытной группе.
На 25-е сутки эксперимента все животные были подвергнуты эвтаназии в соответствии с этическими нормами, после чего проводили извлечение опухолевых узлов для дальнейших исследований.
Статистическую обработку данных проводили с использованием программ Statistica 10.0 (StatSoft, США) и Microsoft Excel 2013. Количественные данные проверяли на нормальность распределения с помощью критерия Шапиро - Уилка. Для сравнения двух независимых групп с нормальным распределением применяли параметрический t-критерий Стьюдента. При множественных сравнениях трех и более групп использовали поправку Бонферрони для контроля общего уровня ошибки. Данные представлены в виде среднего арифметического ± стандартное отклонение (M±SD). Различия считали статистически значимыми при p<0,0083.
Результаты исследования и их обсуждение
В настоящей работе оценивалась противоопухолевая эффективность соединения JO-122(2), ТМЗ и их комбинации в отношении роста гетеротопических ксенотрансплантатов, полученных из клеточной линии ГБМ человека U87MG.
Перед началом терапии животные с имплантированными опухолями были рандомизированы в четыре группы (по 4 самца и 4 самки в каждой). Поскольку статистически значимых различий между полами по объёму опухоли и другим изученным параметрам выявлено не было, дальнейший анализ проводился по объединённым данным внутри групп с использованием усреднённых значений.
Результаты эксперимента, отражающие динамику роста опухолевых узлов, представлены на рисунке.
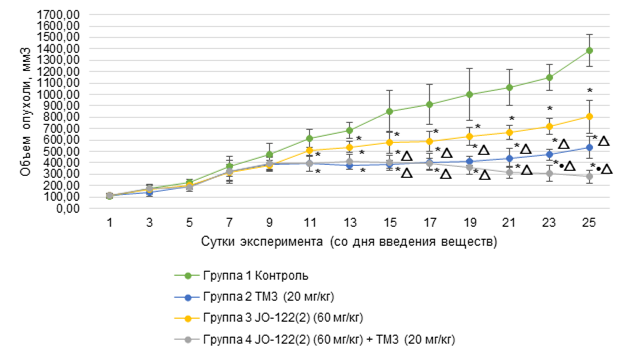
Динамика изменений средних объемов опухолевых узлов в группах с введением ТМЗ,
JO-122(2), комбинации JO-122(2) и ТМЗ и в контрольной группе
Примечание: * - статистически значимые отличия от контрольной группы (р<0,0083, поправка Бонферрони при множественных сравнениях, 4 группы); • - отличия от группы 2 ТМЗ (20 мг/кг) (р<0,0083, поправка Бонферрони при множественных сравнениях, 4 группы); △ - отличия от группы 3 JO-122(2) (60 мг/кг) (р<0,0083, поправка Бонферрони при множественных сравнениях, 4 группы).
Рисунок составлен авторами по результатам данного исследования.
Терапию начинали на 41-й день после трансплантации опухолевых клеток, когда опухоли достигали измеримого и сопоставимого размера. На момент начала введения препаратов средние объёмы опухолей составляли: в группе с воздействием ТМЗ - 115,54±18,25 мм³, в группе с комбинированным воздействием JO-122(2) и ТМЗ - 114,56±22,31 мм³, в группе с воздействием JO-122(2) - 111,25±23,80 мм³, а в контрольной группе - 105,55±18,05 мм³. Между группами на данном этапе статистически значимых различий не обнаружено (p>0,05).
На протяжении всего эксперимента наблюдался рост опухолевых узлов во всех группах. Однако достоверные различия по сравнению с контролем впервые проявились лишь на 11-е сутки терапии: в группе с ТМЗ объём опухоли был в 1,6 раза меньше, а в группе комбинации - в 1,5 раза меньше, чем в контроле (p<0,0083). Эти различия сохранялись до конца эксперимента.
К завершению исследования (на 25-е сутки) средний объём опухоли в контроле составил 1387,44±141,45 мм³. В группе монотерапии ТМЗ объём снизился до 535,02±98,50 мм³, что соответствует 61,44% ТРО и статистически достоверно отличается от контроля (p<0,0083). В группе JO-122(2) в монорежиме объём опухоли составил 803,59±146,07 мм³ (ТРО=42,08%, p<0,0083), при этом значимое подавление роста по сравнению с контролем подтвердилось лишь с 13-х суток.
Наиболее выраженный противоопухолевый эффект был достигнут при комбинированном применении JO-122(2) и ТМЗ: объём опухоли снизился до 279,14±58,94 мм³ (ТРО=79,88%, p<0,0083), что в 4,9 раза меньше, чем в контрольной группе. При этом объёмы опухолей в группе комбинации достоверно уступали таковым при монотерапии: в 2,9 раза (p<0,0083) по сравнению с группой монотерапии JO-122(2) и в 1,9 раза (p<0,0083) по сравнению с группой монотерапии ТМЗ.
Проведённые эксперименты продемонстрировали выраженное противоопухолевое действие как ТМЗ, так и нового трополонового соединения JO-122(2) в монотерапии по сравнению с контрольной группой. Однако наиболее значимый терапевтический эффект был достигнут при комбинированном применении JO-122(2) и ТМЗ. В условиях in vivo комбинация привела к максимальному снижению объёма опухолевых ксенографтов и самому высокому значению ТРО=79,88%, значительно превосходя эффективность каждого препарата по отдельности. Эти результаты позволяют предположить наличие синергического, а не просто аддитивного, взаимодействия между JO-122(2) и ТМЗ.
Механистическое объяснение наблюдаемого синергизма, по-видимому, связано с комплементарностью их воздействия на клеточный цикл. JO-122(2) преимущественно вызывает блокировку клеток в фазе G0/G1, блокируя их переход в S-фазу, тогда как ТМЗ индуцирует задержку в фазе G2/M, препятствуя митотическому делению. Такое разнонаправленное влияние на контрольные точки клеточного цикла обеспечивает более полное подавление пролиферативного потенциала опухолевой популяции. Дополнительным фактором может быть суммирование проапоптотических эффектов обоих соединений, что усиливает гибель клеток и, как следствие, приводит к выраженному торможению опухолевого роста в условиях in vivo [15-17].
Полученные результаты вписываются в более широкий контекст исследований производных трополона, которые неоднократно демонстрировали высокую цитотоксическую активность в отношении различных типов опухолей. Так, ранее было показано, что трополоновые соединения превосходят по эффективности 5-фторурацил (5-FU) в отношении клеток аденокарциномы желудка (линия AGS) [18] и почти в 10 раз - в отношении колоректального рака (линия SW620) [19]. Кроме того, они проявляют активность против первичных культур глиом [19] и подавляют рост клеток эпидермоидной карциномы A431 [20].
Механизмы, лежащие в основе потенциального синергизма между трополоновыми соединениями и ТМЗ, требуют дальнейшего изучения. Однако существует предположение, что трополоны могут индуцировать каспазозависимый апоптоз и подавлять антиапоптотические белки, такие как Bcl-2, в то время как ТМЗ вызывает апоптоз через повреждение ДНК. Кроме того, совместное применение этих препаратов может усиливать p53-зависимый апоптоз [21; 22].
Ряд исследований также продемонстрировал способность трополоновых соединений ингибировать Wnt/β-catenin-сигнальный путь, что приводит к подавлению пролиферации и миграции опухолевых клеток. Параллельно они могут стимулировать образование активных форм кислорода, вызывающих повреждение ДНК [16; 22; 23]. Цитотоксический эффект трополонов может быть также связан с их способностью усиливать стресс эндоплазматического ретикулума, что в конечном итоге приводит к гибели клеток [17].
Тем не менее, несмотря на убедительные данные, точные молекулярные механизмы взаимодействия JO-122(2) и ТМЗ требуют дальнейшего изучения. В частности, необходимо выяснить, усиливается ли p53-зависимый апоптоз при комбинированном применении, а также оценить влияние на репарацию ДНК и устойчивость опухолевых клеток к химиотерапии.
Заключение
Проведённое исследование продемонстрировало высокую противоопухолевую активность как монотерапии ТМЗ и трополоновым соединением JO-122(2), так и их комбинации в модели гетеротопических ксенотрансплантатов ГБМ U87MG. Результаты вписываются в контекст перспективности трополонов как противоопухолевых агентов, демонстрирующих высокую цитотоксичность в отношении глиом и других опухолей. Несмотря на убедительные результаты in vivo, дальнейшие исследования должны быть направлены на детальное изучение молекулярных механизмов синергизма: оценку роли p53-зависимых путей, влияния на репарацию ДНК и устойчивость клеток к терапии. Важно также провести токсикологический анализ комбинации для оценки её безопасности. Полученные данные служат основой для разработки новых стратегий комбинированной химиотерапии ГБМ, особенно в контексте преодоления резистентности к ТМЗ, что остаётся ключевой проблемой в нейроонкологии. Таким образом, JO-122(2) представляет собой перспективную кандидатуру для дальнейших доклинических исследований в составе мультикомпонентных схем терапии агрессивных опухолей ЦНС.



