Введение
Гематогенный остеомиелит позвоночника представляет собой одну из наиболее тяжёлых форм инфекционно-воспалительных заболеваний опорно-двигательной системы [1-3]. Распространённость патологии в последние десятилетия демонстрирует тенденцию к росту, что связано с увеличением продолжительности жизни, распространением инвазивных медицинских вмешательств, широким использованием длительной антибактериальной терапии и иммунодепрессивных препаратов [4; 5]. Заболевание чаще поражает лиц пожилого возраста, пациентов с сахарным диабетом, хронической почечной недостаточностью и иммунодефицитными состояниями [6; 7].
Клиническое течение характеризуется постепенным развитием деструкции межпозвонковых дисков и тел позвонков, прогрессирующей нестабильностью, формированием паравертебральных абсцессов и сдавлением спинного мозга [5; 7; 8]. Несмотря на внедрение современных методов диагностики, сроки установления диагноза остаются значительными, что усугубляет тяжесть поражения и повышает риск инвалидизации [1; 5; 9].
Хирургическое лечение остаётся методом выбора при деструктивных формах гематогенного остеомиелита позвоночника. Радикальная санация очага инфекции в сочетании с реконструкцией передней опорной колонны позвоночника является ключевым условием для достижения стойкого клинического эффекта [6; 10]. Однако даже при комплексной терапии, включающей антибактериальные препараты и различные варианты хирургических доступов, частота рецидивов остаётся высокой, достигая 20–30% [4; 7; 9]. Основной причиной является сохранение микробных ассоциаций в труднодоступных участках резекционной полости, формирование биоплёнок и снижение чувствительности возбудителей к стандартным антисептикам [11-13].
Традиционно применяемые для местной обработки растворы антисептиков, такие как хлоргексидин или повидон-йод, обладают выраженным бактерицидным эффектом, но при этом могут оказывать цитотоксическое действие на остеобласты и клеточные элементы грануляционной ткани. Это ограничивает репаративный потенциал и создаёт предпосылки для замедленного формирования костного блока [2; 6; 14]. В этой связи актуален поиск средств, обеспечивающих одновременно антимикробный эффект и биосовместимость.
Озон в форме озонированного физиологического раствора зарекомендовал себя как антисептический агент с широким спектром действия, включающим грамотрицательную и грамположительную флору [12; 15; 16]. Дополнительно показана активность в отношении грибковых микроорганизмов [14]. Его антибактериальный эффект обусловлен генерацией активных форм кислорода, нарушающих целостность клеточной стенки и подавляющих ферментативные системы микроорганизмов. При этом озон обладает выраженными антигипоксическими и проангиогенными свойствами, стимулирует локальные метаболические процессы и не оказывает подавляющего влияния на клетки костной и соединительной ткани. Эти эффекты обосновывают возможность его применения в условиях гнойно-деструктивных поражений позвоночника [13; 16; 17]. В ряде работ подчёркивается его значение как компонента комплексного лечения [13; 16; 17].
Несмотря на накопленный опыт применения озона в общей хирургии и травматологии, использование его в нейрохирургической практике остаётся недостаточно стандартизированным. Отсутствуют протоколы концентрации, времени экспозиции и объёма раствора, применяемого для санации резекционной полости при гнойном спондилите. Недостаточна также оценка влияния озона на сроки формирования костного блока и на частоту рецидивов в сравнении со стандартными антисептическими растворами [18-20].
Цель исследования
Оценка эффективности интраоперационной санации резекционной полости озонированным физиологическим раствором при хирургическом лечении гематогенного остеомиелита позвоночника.
Материалы и методы исследования
Микробиологическая верификация возбудителя.
Предоперационно выполнялся забор крови для гемокультуры при наличии лихорадки, а также пункция или дренирование паравертебрального абсцесса под контролем ультразвука или компьютерной томографии с последующим посевом материала. При необходимости дополнительно исследовались моча и мокрота для исключения вторичных очагов инфекции.
Интраоперационно до начала санации брались образцы гнойного содержимого и фрагменты некротизированных тканей. Материал помещался в стерильные контейнеры и доставлялся в бактериологическую лабораторию не позднее 2 часов после забора. Выполнялась идентификация возбудителей с определением их чувствительности к антибактериальным препаратам по международным стандартам. В случаях полимикробной флоры проводилась количественная оценка для выделения ведущего патогена.
Послеоперационно осуществлялся бактериологический контроль дренажного отделяемого на 3-и и 7-е сутки. Отрицательные результаты подтверждались повторным исследованием. При сохранении роста возбудителя проводилась коррекция антибактериальной терапии. Таким образом, протокол предусматривал три уровня микробиологической верификации: предоперационный (гемокультура, пункция или дренирование абсцесса), интраоперационный (материал из очага) и послеоперационный (контроль по дренажам).
Хирургическая методика
Хирургическое вмешательство включало поэтапный доступ в зависимости от уровня поражения, радикальную резекцию изменённых тканей до кровоточащей губчатой кости, санацию озонированным физиологическим раствором (концентрация 10 мг/л, экспозиция 30 минут с многократным обновлением раствора), реконструкцию опорного комплекса титановой сеткой с костным или цементным наполнителем с гентамицином и стабилизацию транспедикулярной фиксацией. После послойного рассечения мягких тканей и достижения очага производится выделение поражённого сегмента позвоночника. Некротизированные структуры диска и тела позвонка удаляются в пределах визуально и тактильно изменённых тканей. Резекция выполняется до появления кровоточащих участков компактного и губчатого вещества, что подтверждает радикальность санации. При необходимости резецируется часть смежных позвонков с сохранением анатомически неизменённых структур.
Формирование резекционной полости сопровождается тщательным гемостазом и временной изоляцией операционного поля стерильными салфетками. На данном этапе проводится озоновая санация. Для её выполнения используется озонированный 0,9% раствор хлорида натрия, приготовленный ex tempore с помощью медицинского генератора озонокислородной смеси. Раствор насыщается озонокислородной смесью 10 мг/л с контролем окислительно-восстановительного потенциала в пределах 650–700 мВ. Температура раствора поддерживается на уровне 20–22 °C для предотвращения термического воздействия на ткани.
Раствор натрия хлорида 0.9%, насыщенный озонокислородной смесью 10 мг/л с контролем окислительно-восстановительного потенциала в пределах 650–700 мВ, вводится в резекционную полость в объёме дозированно до заполнения объема полученной полости резекции инфекционного очага (в пределах 1-2 тел позвонков и смежных дисков). Экспозиция общая составляет 30 минут, для каждой отдельной порции раствора экспозиция 2 минуты, после чего раствор полностью эвакуируется и происходит его обновление. Полость изолируется во время экспозиции стерильными марлевыми тампонами для предотвращения контакта озонированного раствора с окружающими тканями и снижения риска ингаляционного воздействия на персонал.
После завершения этапа санации выполняется реконструкция передней опорной колонны. В зависимости от объёма дефекта используется титановая сетка, заполненная костными аутотрансплантатами, ксенокостным материалом или спейсером на основе костного цемента с добавлением гентамицина. В ряде случаев применяется комбинация - титановая сетка с цементным спейсером PMMA с гентамицином, что обеспечивает дополнительный антибактериальный эффект за счет продленного локально воздействия антибактериальным препаратом. Для стабилизации выполняется транспедикулярная фиксация смежных сегментов.
Завершающим этапом является установка активного дренажа. Первые 24–48 часов после операции проводится контроль отделяемого с последующим бактериологическим исследованием. При отсутствии признаков инфицирования дренаж удаляется в стандартные сроки.
Клинический пример
Пациент женского пола, 1959 года рождения, поступила с жалобами на выраженные боли в пояснично-грудном отделе позвоночника, ограничение подвижности и снижение переносимости физической нагрузки. Из анамнеза известно, что в течение нескольких месяцев сохранялась субфебрильная температура, отмечались нарастающие боли в спине, не купировавшиеся консервативной терапией. При обследовании, по данным МРТ, выявлен спондилит Tp2-L1 с деструкцией тел позвонков и вовлечением межпозвонкового диска, классифицированный как Pola C4.
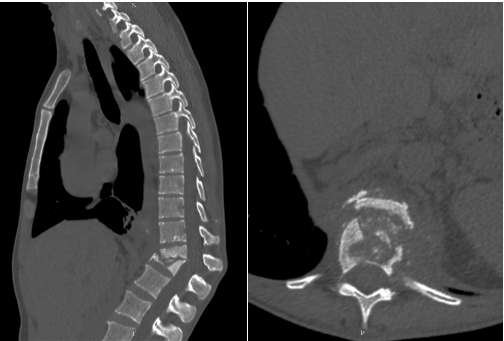
Предоперационное микробиологическое исследование включало забор крови для гемокультуры, в которой был верифицирован золотистый стафилококк. Дополнительно проведена биопсия деструктивного очага под контролем КТ, что подтвердило наличие неспецифического гнойного процесса (рис. 1). По результатам лабораторных анализов выявлены признаки системной воспалительной реакции - лейкоцитоз и повышение уровня С-реактивного белка.
Хирургическое вмешательство выполнялось одноэтапно в рамках одного наркоза. Пациентка уложена в положение на правом боку, выполнена торакофренолюмботомия слева через XI межреберье с резекцией ребра. После вскрытия паравертебрального абсцесса произведён забор содержимого для бактериологического исследования. Проведена резекция тел L1 и L2 в пределах макроскопически изменённых тканей до появления кровоточащих участков губчатого вещества.
|
Рис. 1. Компьютерная томография (сагиттальная и аксиальная проекции). Определяется деструктивный процесс тел Tp2–L1 (Pola C4) Составлено авторами по результатам данного исследования.
|
На этапе санации резекционная полость орошалась раствором натрия хлорида 0.9%, насыщенным озонокислородной смесью 10 мг/л с контролем окислительно-восстановительного потенциала в пределах 650–700 мВ, экспозиция обработки общая 30 минут, для каждой отдельной порции раствора экспозиция 2 минуты, после чего раствор полностью эвакуируется и происходит его обновление. Полость изолировалась стерильными марлевыми тампонами для предотвращения контакта раствора с окружающими тканями.
Для реконструкции передней опорной колонны использована титановая сетка, заполненная аутокостным материалом, в сочетании с цементным спейсером, содержащим гентамицин. В тела позвонков Т11-L2 бикортикально установлены спонгиозные винты (рис. 2), фиксированы на стержнях. Завершающим этапом установлены активные дренажи в резекционную полость и плевральную полость.
Послеоперационный период протекал без признаков рецидива инфекции. По данным бактериологического контроля дренажного отделяемого, на 3-и и 7-е сутки роста микроорганизмов не получено. Температура тела нормализовалась в течение первой недели. К концу 3-го месяца после операции пациентка отмечала значительное снижение болевого синдрома: уровень по VAS снизился с 8 до 2 баллов, индекс ODI - с 74% до 28%, что отражало восстановление способности к самообслуживанию и бытовой активности.
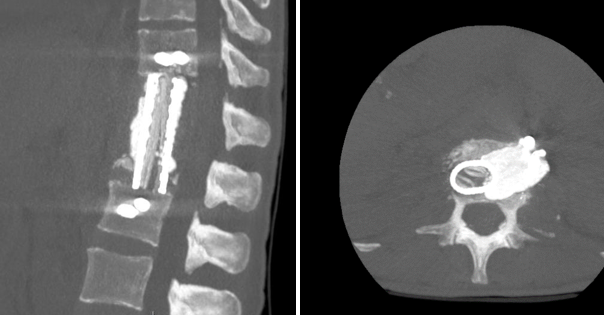
Рис. 2. Компьютерная томография (сагиттальная и аксиальная проекции). Замещение тел Tp2–L1 титановой сеткой с гентамициновым PMMA-спейсером
Составлено авторами по результатам данного исследования.
Контрольная КТ через 12 месяцев выявила признаки формирования костного блока процесса (рис. 3) в зоне реконструкции, отсутствие признаков нестабильности и рецидива гнойного. В неврологическом статусе отмечалась стабилизация, регресса очаговой симптоматики не зафиксировано. Пациентка продолжала антибактериальную терапию в течение 8 недель после операции в соответствии с чувствительностью выделенного возбудителя.

Рис. 3. Компьютерная томография (сагиттальная и коронарная проекции). Замещение тел Tp1–L1 титановой сеткой с гентамициновым PMMA-спейсером без признаков продолженной деструкции или потери высоты коррекции
Составлено авторами по результатам данного исследования.
Результаты исследования и их обсуждение
Представленный клинический пример подтверждает, что применение озонированного физиологического раствора в качестве интраоперационного антисептика позволяет достичь локальной эрадикации возбудителя и предотвратить рецидив инфекции. У пациентки отмечено быстрое снижение признаков системной воспалительной реакции, уменьшение болевого синдрома и формирование стабильного костного блока в зоне реконструкции к 12-му месяцу после операции.
В литературе подчёркивается, что одной из основных причин персистенции инфекции при гнойных поражениях позвоночника является формирование бактериальных биоплёнок, устойчивых к действию стандартных антисептиков и системных антибиотиков [8; 9; 11]. Традиционные растворы (хлоргексидин, повидон-йод) обладают выраженным бактерицидным действием, однако их использование ограничено из-за цитотоксического влияния на остеобласты и клетки грануляционной ткани, что может препятствовать полноценной репарации [2; 6; 14].
Озон в растворе натрия хлорида демонстрирует широкий спектр антимикробной активности, включая воздействие на грамположительную и грамотрицательную флору, а также на грибковые микроорганизмы [12; 15; 16]. При этом его биологические эффекты выходят за рамки антимикробного действия: озон стимулирует микроциркуляцию, улучшает тканевую оксигенацию и активирует процессы остеогенеза [13; 17; 18]. Современные обзоры подтверждают значимость этих эффектов в контексте дегенеративных и инфекционных заболеваний позвоночника, подчёркивая необходимость разработки унифицированных протоколов его применения [15; 16].
Несмотря на положительные результаты единичных наблюдений, использование озона в нейрохирургии позвоночника остаётся недостаточно стандартизированным [18–20]. Отсутствуют унифицированные рекомендации, регламентирующие концентрацию, объём и экспозицию раствора, а также длительность его применения. В этой связи необходимы дальнейшие проспективные исследования с расширенной выборкой пациентов и контрольными группами, что позволит объективно оценить долгосрочную эффективность и безопасность метода в сравнении с традиционными подходами [21; 22].
Заключение
Интраоперационная санация резекционной полости озонированным физиологическим раствором при хирургическом лечении гнойных поражений позвоночника является технически воспроизводимым и клинически оправданным этапом вмешательства. Локальное применение озона обеспечивает выраженный антимикробный эффект в условиях полимикробной обсеменённости, способствует эрадикации патогена и не оказывает ингибирующего влияния на процессы репаративной регенерации. Представленный клинический пример демонстрирует возможность достижения стойкой ремиссии, снижения выраженности болевого синдрома и восстановления функциональной активности в отдалённом периоде наблюдения.
Протокол верификации возбудителя, включающий предоперационный забор крови для гемокультуры, биопсию деструктивного очага под контролем компьютерной томографии, интраоперационный бактериологический анализ и послеоперационный контроль дренажного отделяемого, позволяет объективно оценить динамику микробной нагрузки и корректировать антибактериальную терапию.
Полученные результаты подтверждают гипотезу о том, что сочетание радикальной хирургической санации с использованием озонированного раствора и современной реконструктивной техники снижает риск рецидива инфекции и способствует формированию полноценного костного блока. Несмотря на положительные исходы, единичные наблюдения не позволяют окончательно определить эффективность метода. Для подтверждения клинической значимости озоновой санации требуется проведение проспективных исследований с расширенной выборкой и стандартизацией параметров раствора, экспозиции и объёма обработки.



