Введение
Одним из важнейших факторов, влияющих на состояние гомеостаза организма, является низкая температура [1, 2]. На воздействие холодового фактора организм отвечает сложными физиологическими реакциями, которые направлены на сохранение теплового гомеостаза. В последние десятилетия в работах исследователей установлены важные закономерности реакции организма и патоморфологическая картина органов и тканей при холодовом стрессе [3–5]. Однако многие аспекты этой проблемы остаются малоизученными. В частности, это относится к патоморфологии щитовидной железы при холодовом стрессе и механизмам гормональной регуляции температурного гомеостаза.
Железы внутренней секреции принимают активное участие в адаптации к воздействию повреждающих факторов окружающей среды. Щитовидная железа является одним из основных звеньев нейроэндокринной системы [6–8] и участвует в формировании энергетического метаболизма, термогенеза, формировании адаптивных реакций организма на действие экстремальных факторов внешней среды. Она реагирует на их воздействие функциональными и морфологическими изменениями [9–11].
В формировании адаптивной реакции организма на действие факторов внешней среды принимают активное участие тиреоидные гормоны. Они вовлекаются в реакцию стресса уже на ранних стадиях и играют основную роль в развитии общего адаптационного синдрома, описанного Г. Селье. При этом гормональная активность щитовидной железы в значительной мере определяется природой, характером и интенсивностью воздействия повреждающих факторов. Однако вопрос о закономерностях изменения функциональных резервов щитовидной железы в зависимости от действующего холодового фактора остается нерешенным.
Тучные клетки (ТК) принимают активное участие в регенерации органов и тканей после воздействия на организм различных повреждающих факторов, в том числе температурного фактора [12]. Так, после воздействия гипертермии ТК активно высвобождают серотонин, гистамин, TNFα, IL1ß, IL6, что приводит к активации микроциркуляторного русла, пролиферации макрофагов, а на поздних сроках ТК секретируют фактор EGF, который активирует фибробласты и синтез коллагена. Серотонин ТК повышает выживаемость и миграцию фибробластов и снижает апоптоз клеток, пораженных термическим фактором [13].
Строма щитовидной железы по сравнению с другими органами чрезвычайно богата ТК, обладающими высокой функциональной активностью и широким спектром медиаторов [14–16]. По современным представлениям ТК имеют решающее значение в функционировании щитовидной железы. Наряду с парафолликулярными клетками (С-клетками) они способны обеспечивать гомеостаз биогенных аминов. Медиаторы ТК оказывают активное влияние на фолликулярный аппарат щитовидной железы и на стромальный компонент как в норме, так и при патологических состояниях. В частности, ТК активируют фибробласты и эндотелий сосудов микроциркуляторного русла, а также могут воздействовать на процессы образования, накопления, активации и секреции тиреоидных гормонов в тироцитах [17]. Также в литературе имеются работы, которые показывают участие ТК в регуляции регенераторных процессов при патологии щитовидной железы.
В то же время исследования состояния тучноклеточной популяции при гипотермии немногочисленны, и поэтому значение этих клеток при воздействии холодового стресса нуждается в дальнейшем исследовании.
Цель исследования – изучить патоморфологические изменения щитовидной железы и состояние стромальных тучных клеток при однократной глубокой иммерсионной гипотермии.
Материал и методы исследования
Эксперимент был проведен на 20 половозрелых крысах-самцах линии Вистар, массой 200–240 г, полученных из вивария Федерального государственного бюджетного научного учреждения «Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук» (Новосибирск, Российская Федерация). Животные были распределены на две группы: группа 1 – контрольная (n = 10), крысы этой группы содержались в термонейтральной зоне; группа 2 – опытная, в ней животные подвергались глубокой иммерсионной гипотермии (60 мин при -20 °С) (n = 10). После окончания холодового воздействия животных декапитировали (в качестве наркоза использовали хлороформ), извлекали щитовидную железу и использовали ее для дальнейшего гистологического и морфометрического исследования. Протокол и дизайн данного исследования был обсужден и одобрен этическим комитетом ФГБОУ ВО АГМУ Минздрава России. Исследования соответствовали требованиям Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (EST №123 от 18.03.1986, Страсбург), а также Директиве 2010/63/EU по охране животных, используемых в научных целях.
Щитовидные железы, предназначенные для патоморфологического исследования, фиксировали в 10 % растворе забуференного формалина (рН – 7,2) в течение 24 ч. Проводку материала осуществляли по изопропиловому спирту с помощью автомата проводки TISSUE-TEK VIPTM6 (Sakura, Япония), далее материал просветляли в ксилоле и заливали в парафин при помощи станции парафиновой заливки TISSUE-TEK TEC 5 (Sakura, Япония). Окрашивали препараты в автомате для автоматической окраски микропрепаратов TISSUE-TEK Prisma (Sakura, Япония), затем заключали под пленку в автомате для автоматического заключения микропрепаратов TISSUE-TEK Film (Sakura, Япония). Гистологические срезы толщиной 5–7 мкм получали с использованием полуавтоматического роторного микротома Accu-Cut SRM (Sakura, Япония), срезы окрашивали гематоксилином и эозином. Также осуществляли гистохимические окраски: коллоид окрашивали Шифф-реактивом по Мак-Манусу (BioVitrum, Санкт-Петербург, Россия) и толуидиновым синим, с помощью набора реактивов фирмы BioVitrum (Санкт-Петербург, Россия) выявляли ТК.
Проводили оценку морфологических параметров фолликулов и клеток фолликулярного эпителия. У каждого животного исследовали по 20–30 клеток фолликулярного эпителия при увеличении ×400 в 3–5 полях зрения. Плотность распределения ТК проводили в 10 случайных полях зрения (площадь поля зрения составляла 0,12 мм²) при увеличении микроскопа в 400 раз. Степень дегрануляции ТК оценивали по числу клеток в состоянии дегрануляции к общему числу изученных клеток, выраженному в процентах.
Цифровые микрофотографии микропрепаратов получали с помощью микроскопа Nikon Eclipse E200 (Япония) и системы визуализации MC-LCD 4K (Россия). Морфометрию осуществляли с помощью морфометрической программы ВидеоТест – Морфология 5.2 (Санкт-Петербург, Россия).
Статистическую обработку полученных результатов проводили с помощью статистического пакета Statistica 12.0 (StatSoft, USA). Полученные данные эксперимента были представлены в виде среднего значения с указанием стандартной ошибки среднего (М±SEM). Статистическую значимость различий оценивали при уровне p < 0,05.
Результаты исследования и их обсуждение
Результаты проведенного исследования показали, что в группе контроля (интактные животные) форма фолликулов была овальной или округлой. Площадь фолликулов в среднем составила 1393,6±146,2 мкм². Коллоид в фолликулах имел гомогенную структуру и выглядел эозинофильным, надэпителиальные резорбционные вакуоли были небольшими и встречались редко. Клетки фолликулярного эпителия в фолликулах имели кубическую, реже цилиндрическую форму и располагались в один слой. Ядра фолликулярного эпителия были округлыми с грубодисперсным хроматином. Высота фолликулярного эпителия составила 7,0±0,1 мкм, площадь ядер фолликулярного эпителия – 18,6±0,5 мкм² и площадь цитоплазмы фолликулярного эпителия – 57,5±3,2 мкм² (рис. 1, а, таблица).
Морфометрические параметры щитовидной железы и тучных клеток стромы в группах исследования (М±m)
|
Параметры |
Интактные животные |
Гипотермия |
Р |
|
Высота эпителия (мкм) |
7,0±0,1 |
5,2±0,1 |
р = 0,0000001 |
|
Площадь ядра (мкм2) |
18,6±0,5 |
13,6±0,9 |
р = 0,00001 |
|
Площадь цитоплазмы (мкм2) |
57,5±3,2 |
45,5±3,2 |
р = 0,01 |
|
Площадь фолликулов (мкм2) |
1393,6±146,2 |
621,4±102,2 |
р = 0,0006 |
|
Число ТК |
10,1±0,6 |
16,0±2,8 |
р = 0,03 |
|
Число компактных ТК (%) |
83,8±2,0 |
52,3±5,6 |
р = 0,00002 |
|
Число ТК в состоянии дегрануляции (%) |
16,2±2,0 % |
47,7±5,6 |
р = 0,00002 |
При окраске толуидиновым синим в строме щитовидной железы между фолликулами и периваскулярно выявляли ТК. Они имели преимущественно округлую или вытянутую форму и небольшой размер. Среднее число ТК составило 10,1 ± 0,6 в 10 полях зрения при увеличении ×400. Число ТК, которые содержали компактно расположенные гранулы, было 83,8 ± 2,0 %, а клеток в состоянии дегрануляции было 16,2 ± 2,0 % (рис. 2, а, таблица).
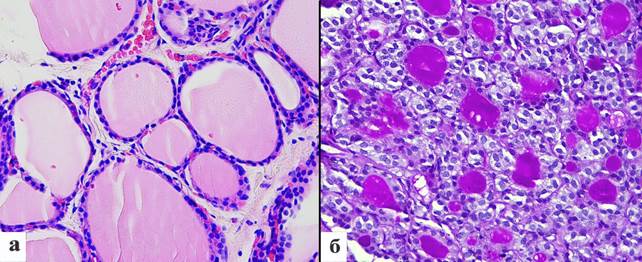
Рис. 1. Морфология щитовидной железы: а – щитовидная железа крысы в норме, окраска гематоксилином и эозином, увеличение х 400; б – уменьшение площади фолликулов щитовидной железы после проведения однократной глубокой иммерсионной гипотермии, окраска Шифф-реактивом по Мак-Манусу, увеличение х 400
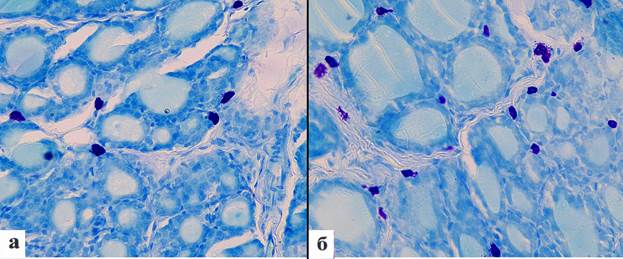
Рис. 2. Тучные клетки: а – тучные клетки в щитовидной железе интактных крыс; б – увеличение числа тучных клеток в строме щитовидной железы после проведения однократной глубокой иммерсионной гипотермии.
Окраска толуидиновым синим BioVitrum, увеличение х 400
После проведения однократной глубокой иммерсионной гипотермии по сравнению с контролем отмечали уменьшение площади фолликулов в 2,2 раза (p = 0,0006) (рис. 1, б). Базальная мембрана фолликулов выглядела утолщенной и разволокненной, местами отмечали ее разрывы. Коллоид в фолликулах приобретал резко выраженную ШИК-положительную окраску, базофильный оттенок и становился мелкоячеистым. Цитоплазма тиреоцитов также интенсивно окрашивалась в розовато-малиновый цвет. В подавляющем большинстве фолликулов была видна краевая вакуолизация фолликулов. Часто в просветах фолликулов определяли слущенные фолликулярные клетки, которые образовывали группы по 4–6 клеток. Наряду с этим отмечали резкие дистрофические изменения тиреоцитов, что проявлялось образованием вакуолей и набуханием клеток. В ядрах также присутствовали дистрофические изменения в виде внутриядерной вакуолизации. Над эпителием также были хорошо видны крупные резорбционные вакуоли. Клетки фолликулярного эпителия в фолликулах приобретали уплощенную форму, высота фолликулярного эпителия по сравнению с интактными животными уменьшалась в 1,35 раза (p = 0,0000001), площадь цитоплазмы была меньше в 1,3 раза (p = 0,01), а площадь ядер снижалась в 1,4 раза (p = 0,00001) (таблица).
Среднее число стромальных ТК после проведения гипотермии возрастало в 1,6 раза (p = 0,03). ТК имели вытянутую форму, преимущественно небольшой размер и располагались вокруг резко расширенных капилляров. Число клеток с компактным расположением гранул уменьшилось в 1,6 раза (p = 0,00002), а количество ТК в состоянии дегрануляции возрастало в 1,6 раза (p = 0,00002) (рис. 2, б, таблица).
Результаты проведенного исследования показали, что однократная глубокая иммерсионная гипотермия оказывала влияние на ткань щитовидной железы экспериментальных животных. При этом на первый план выходили изменения, которые отражали угнетение функции железы. Морфометрические параметры фолликулов и фолликулярного эпителия значительно уменьшались: площадь фолликулов снижалась в 2,2 раза, а высота фолликулярного эпителия становилась меньше в 1,35 раза, что говорит о высокой степени функционального напряжения железы. Таким образом, морфометрия площади фолликулов и кариометрия фолликулярного эпителия является весьма точным методом оценки действия быстро развивающихся патологических эффектов, каким является гипотермия.
Анализ полученных результатов с привлечением данных литературы показывает, что полученные данные совпадают с результатами некоторых авторов [18] и в то же время не совпадают с данными других исследователей [19]. Так, сразу после воздействия гипотермии в данном исследовании не было обнаружено таких морфологических изменений, как увеличение высоты тироцитов, наличие фолликулярного эпителия с тенденцией к пролиферации и некоторых других, которые эти авторы определяют как адаптивные. На наш взгляд, это обусловлено тем, что указанные авторы изучали не экспериментальный материал, а судебный и не учитывали силу температурного воздействия. В то же время В.А. Осьминкин и соавт. (2015) указывают, что проявление адаптивных компенсаторно-приспособительных процессов в тканях органов напрямую зависит от скорости и условий охлаждения [20]. В нашем эксперименте охлаждение наступало максимально быстро и в жестких условиях (в воде при температуре -20° С в течение 1 ч), поэтому адаптивные изменения не успевали развиться.
Известно, что регулирование постоянства температуры организма и адаптация к холодовому фактору являются важнейшими функциями щитовидной железы. Исследование показало, что стромальные ТК участвовали в адаптивных реакциях, направленных на увеличение синтеза гормонов. В частности, это выражалось в увеличении числа ТК и возрастании количества клеток в состоянии дегрануляции. Как известно, ТК наряду с парафолликулярными клетками (С-клетками) регулируют работу щитовидной железы и являются источниками гистамина, серотонина, катехоламинов и других биогенных аминов. Эти вещества способны регулировать функциональное состояние микроциркуляторного русла щитовидной железы, а также стимулировать эндоцитоз коллоида фолликулярным эпителием и секрецию тиреоидных гормонов в кровь. Таким образом, можно говорить, что ТК важны для восстановления работы железы и нормализации синтеза гормонов после воздействия холодового стресса большой силы.
Заключение
Таким образом, патоморфологические изменения щитовидной железы при воздействии однократной глубокой иммерсионной гипотермии, с одной стороны, указывают на угнетение функций органа, а с другой стороны, в его тканях имеются признаки активации стромальных ТК (увеличение числа клеток и количества ТК в состоянии дегрануляции), направленные на адаптацию и восстановление тиреоидной активности.



