Введение
Сохраняется высокая актуальность исследований, посвященных закрытию обширных дефектов костей свода черепа, что объясняется ростом числа оперативных вмешательств по поводу черепно-мозговых травм и сосудистой патологии головного мозга. Костная ткань характеризуется способностью к регенерации и восстановлению своей нативной структуры, но при критических дефектах требуются костные имплантаты, обладающие способностью к остеокондукции, то есть поддерживающие прорастание костной ткани [1,2,3]. Отеокондуктивными свойствами обладают пористые имплантаты [3].
Биологически активные факторы, выделенные из тромбоцитов, способствуют росту, дифференцировке и делению клеток костной ткани [4,5].
Используя, животные модели, in vivo можно получить данные от совместного применения ОТП и пористых имплантатов [4]. Ряд авторов показали прирост BV/TV (объем костной ткани/общий объем ткани) к 4–8-й неделям после установки пористого имплантата с ОТП, однако временной интервал до 14 дня после имплантации остаётся практически «слепой зоной» [6,7]. Между тем, именно в эти сроки происходит пик высвобождения цитокинов из ОТП и переключение нейтрофильно-макрофагального ответа [7]. Поэтому в дизайн исследования включена плотная временная сетка (3, 7, 14, 24, 40 сутки), что позволило кинетически описать раннюю фазу регенерации костей свода черепа. Несмотря на анатомическую взаимосвязь, кости основания и свода черепа имеют разное эмбриональное происхождение и проходят разные стадии развития. Для костей свода черепа характерно эндесмальное окостенение, это влияет на особенности их регенерации [8]. Описание процессов регенерации при совместном использовании пористого имплантата из Ti-6Al-4V и обогащенной тромбоцитами плазмы в ранние сроки (до 14 дней) в литературе не встречается.
Цель исследования: исследовать особенности регенерации костей свода черепа при совместном применении пористых титановых имплантатов с обогащенной тромбоцитами плазмой.
Материалы и методы исследования
Тема исследования, цели, задачи, методы исследования одобрены на заседании биоэтической комиссии по работе с лабораторными животными (Выписка из протокола №3 от 05.11.2019 года) и утверждена комитетом по этике ФГБОУ ВО «Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого» Минздрава России (Выписка из протокола от 26.04.2021 № 106/2021; председатель д.м.н., профессор И.В. Демко).
При выборе биологической модели учтен опыт предыдущих авторов [4]. Эксперимент проведен на 30 кроликах-самцах (порода шиншилла), массой 2000-2500г.
Содержание, питание, уход за животными и выведение их из эксперимента осуществляли в строгом соответствии с положениями Директивы 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 года по охране животных, используемых в научных целях (Статья 27), а также требованиями и рекомендациями «Руководства по содержанию и использованию лабораторных животных», «Guide for the Care and Use of Laboratory Animals», National Academy Press, USA. 2011.
До начала эксперимента животных выдерживали в виварии в течение двух недель. Кроликов содержали по одному в клетке. Осмотр животных после операции проводился ежедневно, результаты осмотра фиксировались в протоколе эксперимента.
Анестезию у кроликов осуществляли однократным внутривенным введением раствора препарата Везотил. Комбинированный препарат в 1 мл раствора содержится 50 мг тилетамина и 50 мг золазепама из расчета 0,1 мл на 1 кг массы тела экспериментального животного. Внутривенное введение препарата кроликам осуществляли через периферический катетер 24G (для катетеризации использовали краевую вену уха или латеральную подкожную вену задней конечности). Шерсть со свода черепа сбривалась после введения в наркоз. Проводился забор 8 мл крови из катетера для получения ОТП в пробирку с гелем и антикоагулянтом [9]. Проводилось центрифугирование крови в течение 10 минут при 3200–3600 об/мин, на лабораторной центрифуге СМ-6М (ELMI, Латвия) [10]. Операционное поле обрабатывали трижды септоцидом. Использовался линейный разрез по средней линии свода черепа длиной 3 см. Кость скелетировалась распатором. С помощью алмазной фрезы выполнялась резекционная трепанация черепа диаметром 1 мм на малых оборотах при постоянном орошении краев костного дефекта 0,9% раствором натрия хлорида для снижения температурного воздействия. Стекловидная пластинка обязательно удалялась. После подготовки ложа проводили установку имплантата. В экспериментальной группе (группа №1 - 15 животных) проводилась имплантация пористой пластины из сплава титана (Ti-6Al-4V) и орошение ОТП. Имплантат изготавливали на 3D-принтере EOS M 290 производства компании EOS (Германия).3D-принтер для печати металлами по технологии прямого лазерного спекания металлических порошков (Direct Metal Laser Sintering - DMLS), позволяет печатать объекты сложной геометрии, размерами до 250*250*325 мм. Принтер оснащен высокоточным иттербиевым волоконным лазером мощностью 200 Вт. Имплантаты изготовлены из металлического порошка с диаметром гранул 25-45 мкм в виде диска диаметром 10 мм и толщиной 2 мм с открытыми порами диаметром от 200 до 500 мкм, пористость 50-60 %. Скорость лазерного спекания составила 7 м\с с длиной волны 1054 нм, непрерывная мощность лазера 200 Вт, размер пятна 0,1 мм. На финальном этапе проводилась механическая, ультразвуковая и химическая очистка. По данным S. Bose и соавторов, остеокондуктивностью обладают пористые материалы с размерами пор от 100 до 600 мкм [11,12]. За счет шероховатой пористой поверхности дополнительная фиксация имплантата не требовалась (рисунок 1). Мягкие ткани (апоневроз и кожные покровы) ушивали послойно, затем накладывали асептическую повязку. В контрольной группе (группа № 2 - 15 животных) орошение ОТП не проводилось.
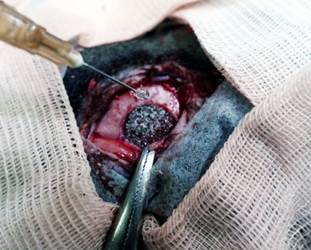
Рис. 1. Положение имплантата в трепанационном окне. Орошение имплантата ОТП
Примечание: фотография выполнена авторами в ходе эксперимента.
Дренажи не использовали. Длительность операций составляла 40-50 мин. Летальных исходов не было. Перевязку и осмотр проводили ежедневно.
В сроки на 3, 7, 14, 24, 40 сутки после операции животные выводились из эксперимента введением высоких доз препаратов для наркоза.
Иссеченный фрагмент крыши черепа с имплантатом помещали в 10% раствор забуференного формалина, затем помещали в декальцинирующий раствор «Трилон Б» на 5 суток. Далее отделяли костный фрагмент от имплантата. Максимально сохраняя контактную зону, проводилась нарезка декальцинированной кости через зону «имплантат-кость».
Декальцинированные фрагменты костей свода черепа обезвоживали изопропиловым спиртом возрастающей концентрации и заливали в воск-парафин. На микротоме MicroTec CUT 4050 делали серийные срезы толщиной 4-5 мкм. Срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону и Шморлю. Готовые препараты анализировали с помощью микроскопа Olympus BX45 с приставкой Olympus DP 25 для фото-видеодокументации и программным комплексом «Cell^D» при увеличении х100-х400. Гистоморфометрическую оценку проводили по цифровым микрофотографиям, полученным с помощью программ «Cell^D» и «NIS-Elements Document», а морфометрические измерения проводили в программе «JMicroVision 1.2.7». Проведены измерения толщины и площади костных трабекул, толщины коллагеновых волокон, подсчет клеток остеобластического ряда, остеокластов и клеток воспалительного инфильтрата.
Электронная микроскопия использована для изучения образцов «имплантат-кость», полученных от животных, выведенных из эксперимента на 14, 24, 40 сутки. Дегидратированные образцы «имплантат-кость»заливали эпоксидной смолой. Срезы образцов толщиной 5-10 мм изготавливали на станке для малодеформационной, образивной, мокрой резки металлов и керамик «Minitom» («StruersApS», Дания) отрезным алмазным диском (MOD13, диаметр 127 мм, толщина 0,4 мм) c усилием реза 0,2Н при скорости вращения 60 об./мин. Плоскость распила пересекала границу «имплантат-кость». В установке холодного магнетронного напыления «Q150T ES» (Quorum Technologies, Великобритания) наносили на поверхность препарата слой золота толщиной 10 нм, необходимый для проведения электронной микроскопии. Препараты закрепляли на предметных столиках с помощью электропроводящего углеродного скотча. Подготовленный препарат с имплантатом исследовали на растровом сканирующем электронном микроскопе «Carl ZeissEVO50» (Zeiss, Германия). Структурные исследования проводили при ускоряющем напряжении 10кВ в режиме регистрации обратно отраженных электронов (BSD режим).
Описание выборки производили спомощью подсчета медианы (Ме) и интерквартильного размаха в виде 1 и 3 квартилей [Q1–Q3]. Для определения характера распределения полученных данных использовали критерий Шапиро-Уилка. Достоверность различий между исследуемыми показателями оценивали по непараметрическому критерию Манна-Уитни. Статистический анализ осуществляли в пакете прикладных программ SPSS Statistics 22.0.Различия показателей считались статистически значимыми при значении p<0,05.
Результаты исследования и их обсуждение
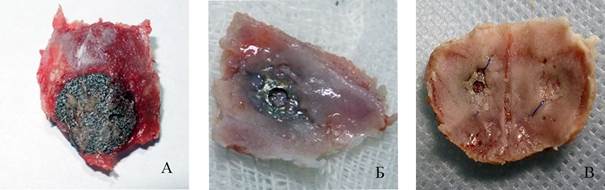
Первично проводилась визуальная оценка комплекса «имплантат-кость». Оценивалось состояние окружающих тканей, отечность, наличие экссудата. На 3 и 7 сутки имплантат, независимо от использования ОТП, легко отделялся от окружающих его тканей. Различий в течение послеоперационного периода в 1 и 2 группах не выявлено. На 3-и сутки вокруг комплекса «имплантат-кость» наблюдалась отечность окружающих тканей с небольшим количеством экссудата и свертками крови. К 7-м суткам эксперимента отек регрессировал. На этих сроках признаков биологической фиксации имплантата не выявлено, имплантат легко удалялся из трепанационного окна. На 14 сутки имплантат фиксирован в трепанационном окне окружающими тканями. На 24 сутки наблюдалось обрастание имплантата костной тканью со стороны твердой мозговой оболочки, в 1 группе слой костной ткани был большим по толщине. На 40-й день в 1 группе животных с использованием ОТП наблюдалось полное обрастание внутренней поверхности имплантата костной тканью (рисунок 2).
Рис 2. Имплантат в теменной кости (1 группа):
(А) 14-е сутки эксперимента – имплантат фиксирован формирующейся костной тканью; (Б) 24-е сутки - виден наплыв костной ткани на имплантат;
(В) 40-е сутки - практически полное обрастание имплантата костной тканью
Примечание: фотография выполнена авторами в ходе эксперимента.
На 40-е сутки макроскопически оценивали полноту обрастания имплантата костной тканью (таблица 1). В 1 группе полное обрастание имплантата со стороны внутренней кортикальной пластинки наблюдалось у 12 животных из 15. В 2 группе полное обрастание наблюдалось в 5 случаях из 15. Несмотря на дефект внутренней кортикальной пластинки, во всех случаях наблюдений имплантат был надежно фиксирован (рисунок 3, 4). На рисунке 3 показана полностью сформированная внутренняя кортикальная пластинка, на которой видны борозды от оболочечных артерий.
Таблица 1
Макроскопическая оценка закрытия дефекта на 40-е сутки эксперимента
|
Группа животных |
Послеоперационный дефект, размеры |
|||
|
Нет, полностью закрыт |
5-7 мм |
3-5 мм |
Менее 3 мм |
|
|
1 группа |
12 |
- |
1 |
2 |
|
2 группа |
5 |
1 |
3 |
6 |
Примечание: составлена авторами на основе полученных данных в ходе исследования.
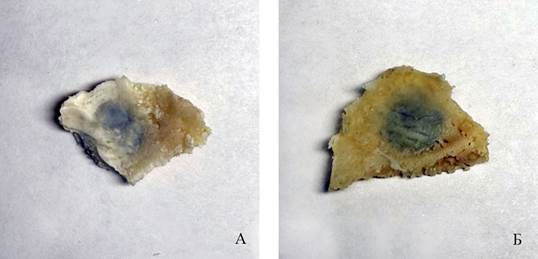
Рис.3. Фрагменты костей крыши черепа кроликов (А, Б) с имплантатами, полностью сформированная внутренняя кортикальная пластинка, на которой прослеживаются борозды от прилегающих оболочечных артерий. Группа животных №1, 40-е сутки эксперимента
Примечание: фотография выполнена авторами в ходе эксперимента.
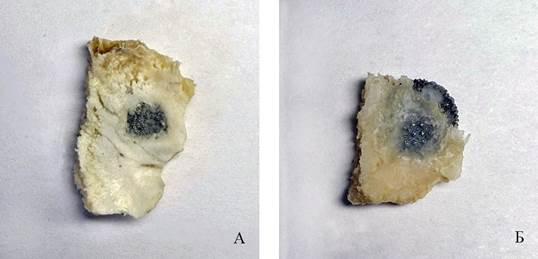
Рис. 4. Фрагменты костей крыши черепа кроликов (А, Б) с имплантатами, дефект черепа полностью не закрылся. Группа животных №2, 40-е сутки эксперимента
Примечание: фотография выполнена авторами в ходе эксперимента.
В двух группах при световой микроскопии на 3-и сутки эксперимента виден кровяной сгусток и визуализируются клетки воспалительного инфильтрата с преобладанием сегментоядерных лейкоцитов.
На 7-е сутки эксперимента микроскопическая картина схожая, с важной особенностью – выявлены эозинофильные островки формирующейся костной ткани (рисунок 5). Толщина трабекул и их площадь статистически значимо больше при использовании в группе №1 (p=0,026; p=0,02). Отмечено уменьшение клеток воспалительного инфильтрата и появление клеток остеобластов. При проведении световой микроскопии и морфометрии гистологических препаратов в зависимости от сроков наблюдения получены разные результаты.
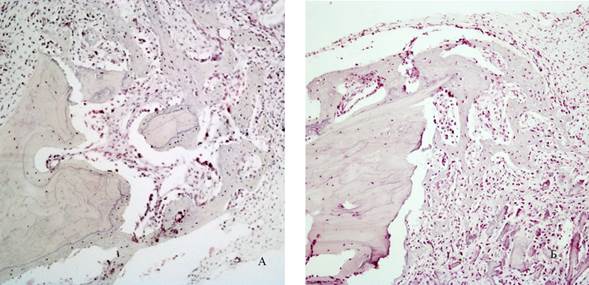
Рис 5. Гистологическая картина на 7 сутки эксперимента: появление эозинофильных островков формирующейся костной ткани (А – 1 группа, Б – 2 группа). Окраска гематоксилином и эозином. Увеличение *100
Примечание: фотография выполнена авторами в ходе эксперимента.
На 14-е сутки в области дефекта вокруг имплантата выявлены сформированные костные трабекулы, клетки остеобластического ряда и малочисленные остеокласты. В сравнении с предыдущим сроком наблюдения имеется тенденция к увеличению площади и толщины трабекул формирующейся костной ткани, возрастает численность упорядоченно расположенных коллагеновых волокон. При сравнении показателей, характеризующих процесс остеогенеза в 1 и 2 группах животных, отмечено статически значимое увеличение площади формирующейся костной ткани (р=0,04), толщины трабекул (p=0,007) и количества волокон в группе животных с использованием ОТП (таблица 2, 3, 4, рисунок 6).
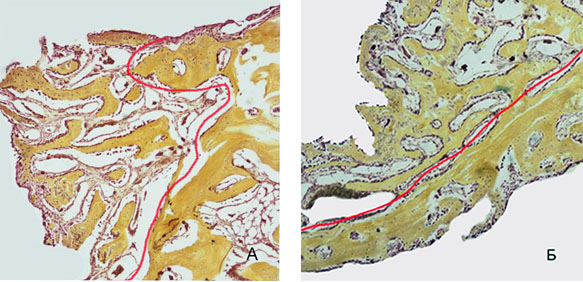
Рис. 6. Зона регенерации на 14 сутки эксперимента: выявлена большая толщина и площадь формирующихся костных трабекул при использовании ОТП. Красным маркером показана граница между формирующейся костной тканью и зрелой костью: А) 2 группа, Б) 1 группа. Окраска по Шморлю. Увеличение *40
Примечание: фотография выполнена авторами в ходе эксперимента.
На 24 сутки эксперимента наблюдается продолжение процесса остеогенеза, что проявляется увеличением площади формирующейся костной ткани вокруг имплантата, увеличением толщины трабекул и толщины коллагеновых волокон. Популяция (численность) клеток остеобластического ряда уменьшается, что свидетельствует о замедлении активности процессов регенерации. В лакунах выявляются остеоциты, а в межтрабекулярном пространстве единичные остеокласты. При сравнении активности процесса остеогенеза, исследуемые параметры четко демонстрируют большую активность остеогенеза в 1 группе: статистически значимо больше площадь и толщина костных трабекул (р=0,002, р=0,033) и возрастает численность упорядоченно расположенных волокнистых структур (рисунок 7, таблица 2, 3, 4).
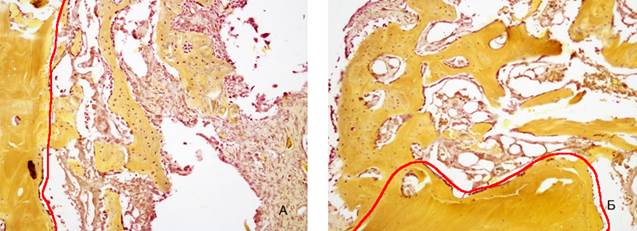
Рис. 7. 24 сутки эксперимента – площадь формирующейся костной ткани. Красным маркером показана граница между формирующейся костной тканью и зрелой костью: А – 2 группа, Б – 1 группа. Увеличение* 200. Окраска по Шморлю
Примечание: фотография выполнена авторами в ходе эксперимента.
На 40-сутки после оперативного вмешательства и установки имплантата в препаратах при микроскопии наблюдается сформированная губчатая кость с ориентированными костными трабекулами, ориентированные коллагеновые волокна, сформированные остеоны, меньшее число остеобластов и единичные остеокласты. При сравнении препаратов выявлено статистически значимое преобладание формирующейся костной ткани (p=0,004) при равной толщине трабекул (p=0,464) в 1 группе.
Таким образом, в 1 группе животных фаза активного статистически значимого увеличения толщины трабекул начинается с 14 суток и длится до конца эксперимента, во 2 группеактивное формирование трабекул наблюдается с 24 суток, а к 40 суткам толщина трабекул у животных 1 и 2 группы статистически не различается (таблица 2).
Таблица 2
Толщина трабекул формирующейся костной ткани в эксперименте
|
Группа животных |
Толщина трабекул по суткам эксперимента, мкм |
Критерий Манна-Уитни, p |
|||
|
7 |
14 |
24 |
40 |
||
|
1 группа |
54,27 [38,90; 65,54] |
54,86 [38,98; 75,03] |
66,22 [57,27; 107,92] |
100,68 [80,25; 120,98] |
p7-14=0,65 P14-24=0,004 P24-40=0,001 |
|
2 группа |
37,29 [25,46;58,46] |
40,02 [30,61;55,58] |
62,4200 [33,21;77,60] |
97,10 [70,93;119,16] |
P7-14=0,856 P14-24=0,17 P24-40=0,001 |
|
Критерий Манна-Уитни, р |
0,026 |
0,007 |
0,033 |
0,464 |
|
Примечание: составлена авторами на основе полученных данных в ходе исследования.
Параллельно с увеличением толщины трабекул выявлено статистически значимое увеличение площади трабекул и площади формирующейся костной ткани (таблица 3). При сравнении результатов выявлены достоверные различия на всех сроках эксперимента. На рисунке видно, что уже на 14 сутки более развитые трабекулы и в большем количестве выявляются в препаратах с ОТП (рисунок 6).
В зоне операции прослеживаются явления образования и дифференцировки тканевых структур, следствием которых является формирование остеоидной ткани в результате действия, прежде всего, клеток остеобластического дифферона. В лакунах трабекул видны остеоциты (рисунок 8).
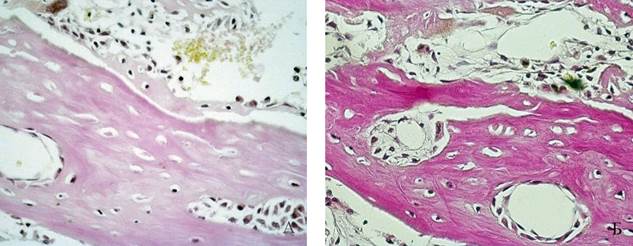
Рис. 8. 14 сутки эксперимента – в лакунах формирующейся костной ткани прослеживаются остеоциты (1 группа животных). Увеличение *400. Окраска: А – гематоксилином и эозином, Б - по Ван-Гизону
Примечание: фотография выполнена авторами в ходе эксперимента.
Таблица 3
Площадь трабекул в формирующейся костной ткани
|
Группа животных |
Площадь трабекул по суткам эксперимента в поле зрения, мкм2 |
Критерий Манна-Уитни, p |
|||
|
7 |
14 |
24 |
40 |
||
|
1 группа |
105390,49 [89095,92; 168706,16] |
122922,57 [109870,31; 133956,27] |
135629,81 [125119,23; 165424,2] |
160466,19 [128455,19;176203,95] |
p7-14=0,546 P14-24=0,116 P24-40=0,116 |
|
2 группа |
74285,00 [37755,72;86576] |
79541,57 [59001,85; 89501,89] |
80975,01 [52142,99; 110942,22] |
91939,98 [78289,31; 113065,74 |
P7-14=0,556 P14-24=0,873 P24-40=0,031 |
|
Критерий Манна-Уитни, р |
0,002 |
0,004 |
0,002 |
0,004 |
|
Примечание: составлена авторами на основе полученных данных в ходе исследования.
Сравнивая толщину коллагеновых волокон в формирующейся костной ткани в экспериментальной и контрольной группах животных, статистически значимых различий не выявлено. Однако большая толщина волокон выявлена в 1 группе животных на ранних стадиях эксперимента. К 40 суткам толщина волокон в обоих группах животных уравниваются (таблица 4).
Таблица 4
Толщина коллагеновых волокон в формирующейся костной ткани
|
Группа животных |
Толщина коллагеновых волокон по суткам эксперимента, мкм |
Критерий Манна-Уитни, p |
|||
|
7 |
14 |
24 |
40 |
||
|
1 группа |
1,3 [,86;1,94] |
1,97 [1,34;2,36] |
2,9 [2,34;3,77] |
3,06 [2,77;3,47] |
p7-14=0,71 P14-24=0,13 P24-40=0,916 |
|
2 группа |
1,01 [0,75;1,47] |
1,75 [1,33;1,90] |
2,36 [1,99;3,62] |
3,14 [2,94;3,63] |
P7-14=0,055 P14-24=0,12 P24-40=0,327 |
|
Критерий Манна-Уитни, р |
0,267 |
0,284 |
0,421 |
0,328 |
|
Примечание: составлена авторами на основе полученных данных в ходе исследования.
Световая микроскопия не позволяет исследовать препараты, в которых наряду с формирующейся костной тканью, имеется металлический имплантат. При удалении имплантата в процессе изготовления гистологических препаратов частично разрушается формирующаяся костная ткань, и микроскопическая картина не дает полного представления об изучаемой области «имплантат-кость». На микрофотографии на 40 сутки эксперимента при использовании сканирующего электронного микроскопа виден пористый имплантат и формирующаяся костная ткань, прорастающая в поры имплантата (рисунок 9А). Такое прорастание обеспечивает пожизненную стабильность имплантата. Во 2 группе прорастание в пористую структуру не выражено, хотя формирование костной мозоли в виде наплыва на имплантат прослеживается (рисунок 9Б).
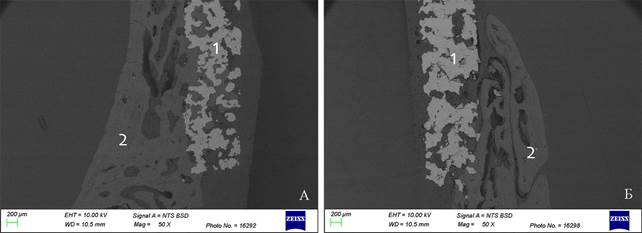
Рис. 9. Спил образцов костей крыши черепа кролика с имплантатом: А- 1 группа, Б- 2 группа. 40-е сутки эксперимента: 1 -имплантат, 2 - кость. Сканирующая электронная микроскопия, BSD режим, ускоряющее напряжение 10 кВ. Увеличение *50
Примечание: фотография выполнена авторами в ходе эксперимента.
На большем увеличении при электронной микроскопии можно рассмотреть волокна, плотно контактирующие с имплантатом и прорастающие в поры имплантата (рисунок 10), что свидетельствует о формировании костной ткани и фиксации имплантата.

Рис. 10. Спил образца костей крыши черепа кролика с имплантатом. 1 группа, 40-е сутки эксперимента. Сканирующая электронная микроскопия, BSD режим, ускоряющее напряжение 10 кВ. Увеличение *1000-(А), *2500-(Б)
Примечание: фотография выполнена авторами в ходе эксперимента.
В настоящее время сформировалось отдельное научное направление - инженерия костной ткани. Единого мнения по поводу размера пор имплантата нет. D. Zhao и соавторы установили, что полилактидные скаффолды с крупными размерами пор (2 мм) показали лучший результат регенерации костной ткани. Кроме того, было установлено, что васкуляризация новой кости улучшалась с увеличением размера пор, но механические свойства имплантатов при этом снижались [13]. При использовании металлических имплантатов такой проблемы не возникает. В настоящем исследовании (по рекомендациям авторов) использовались имплантаты с размерами пор от 200 до 500 мкм. По данным последних исследований рекомендуемая пористость 70%, рекомендуемый размер пор от 300 до 450 мкм [14, 15]. S. Yang c соавторами в 2023 году провели метаанализ 40 исследований и выяснили, что чаще рекомендуют размер пор от 300 до 600 мкм, при этом поры менее 200 мкм ухудшают васкуляризацию, более 800 мкм - снижают площадь контакта кость-имплантат [16]. Часть исследователей считают, что только модификация поверхности имплантата может усилить дифференцировку остеобластов на его поверхности и остеокондуктивность [17,18,19].
ОТП самый доступный вариант для улучшения остеоинтеграциии и может применяться в любом многопрофильном стационаре. В α-гранулах тромбоцитов содержатся факторы роста: PDGF – тромбоцитарный фактор роста, VEGF – фактор роста эндотелия сосудов, TGF– трансформирующий фактор роста, IGF-I, IGF-II, FGF, ECGF и др. [1,5]. По мнению авторов, применение ОТП позволяет получить естественную концентрацию аутологичных факторов роста, поэтому в настоящее время исследуется влияние ОТП на регенерацию тканей с низким потенциалом восстановления [1,18].
E.S. Do Lago с соавторами в эксперименте на костях свода черепа крыс показали, что лучшая регенерация через 4 и 8 недель наблюдалась в группе с применением депроитенезированной кости в сочетании с ОТП. Статистическое сходство наблюдалось между группами с аутокостью и депроитенезированной костью с ОТП. Таким образом, комбинация остеокондуктора (депроитенизированной кости) и ОТП улучшило восстановление костей свода черепа крыс [6].
В большинстве исследований изучение процесса остеогенеза проводится на 4–8 неделях, однако временной интервал от 3 до 24 суток оставался неизученным. По результатам настоящего эксперимента с 7-х суток в 1 группе животных выявлено увеличение площади и толщины формирующихся костных трабекул. Впервые были получены данные на 7, 14, 24, 40 сутки, в большинстве существующих работ первая точка контроля 4 неделя [12, 13]. Авторы провели морфометрический мониторинг остеогенеза на 7, 14, 24, 40 сутки после установки имплантата. На 24-е сутки эксперимента наблюдалась надежная фиксация трансплантата в костной ткани реципиента.
Выводы
1. Формирование костной ткани при краниопластике костей крыши черепа животных в эксперименте происходит через мембранозную и костную стадии.
2. Образование костной ткани вокруг пористого имплантата при использовании обогащенной тромбоцитами плазмы происходит в более ранние сроки, об этом свидетельствуют: раннее появление островков образующейся костной ткани, большая толщина и площадь костных трабекул (р <0,05), большая толщина коллагеновых волокон, раннее и полное закрытие дефекта кости.
3. Впервые проведен морфометрический мониторинг остеогенеза в первые 40 суток после установки имплантата. На 24-е сутки эксперимента при использовании обогащенной тромбоцитами плазмы наблюдается надежная фиксация имплантата за счет прорастания костной ткани в его пористую структуру.
4. Совместное применение ОТП и пористых имплантатов взаимно усиливает эффект формирования костной ткани.



