Введение
В слюне, как и в крови, содержатся гуморальные иммунные факторы, в частности иммуноглобулины (Ig) [1]. Общепризнано, что основное значение в мукозальном иммунитете имеет секреторный иммуноглобулин A (sIgA) [2; 3]. Известно, что sIgA образуется при соединении мономеров IgA, синтезированных плазматическими клетками, и секреторного компонента, продуцируемого эпителиальными клетками слизистой оболочки [4]. Количество саливарного IgA находится под циркадианным контролем: достигает пика утром и постепенно снижается в течение дня, что потенциально синхронизирует с уровнем кортизола [5]. Содержание sIgA в слюне подвержено возрастным изменениям: минимально у младенцев, постепенно нарастает в детском и подростковом возрасте, достигая уровня взрослого человека примерно к 20 годам, значимо снижается у пожилых, что способствует дисбиозу и формированию патомикробиоценоза полости рта, респираторного и пищеварительного трактов, повышению риска инфекций [5; 6]. По-видимому, уровень sIgA отражает степень иммунологической зрелости лимфоидной ткани, ассоциированной со слизистыми оболочками [7]. Предположение, что кишечный микробиом играет значимую роль в формировании мукозального иммунитета в младенчестве, подтверждается ассоциацией более высокого содержания IgA в слюне и ранней колонизации кишечника бифидобактериями [5].
sIgA обладает выраженной антиадгезивной активностью и препятствует прикреплению бактерий, вирусов, грибов, микробных токсинов к эпителиоцитам, абсорбции ксенобиотиков [8; 9]. К потенциальным функциям антител класса IgA в контексте гомеостатических взаимодействий с комменсальной микробиотой относят иммунное исключение, нейтрализацию токсинов, изменение подвижности (иммобилизацию) бактерий, модуляцию экспрессии генов эпитопов антигенов, кислородных радикалов и опсонизацию фагоцитов [10]. Реализации протективных свойств sIgA может способствовать его взаимодействие с лизоцимом и лактоферрином [8].
Имеются данные, что в слюне содержание sIgA значимо превалирует над количеством других иммуноглобулинов [3]. Несекреторные IgA и IgG поступают в ротовую жидкость из системного кровотока в результате транссудации через воспаленную/поврежденную слизистую оболочку, при этом соотношение IgA/IgG в слюне в 400 раз превышает таковое в сыворотке крови. Из-за высокой молекулярной массы проникновение в слюну сывороточных пентамеров IgM сильно затруднено. Увеличение поступления сывороточных антител в очаг воспаления является адаптивным механизмом усиления мукозального иммунитета. Значительно реже Ig могут синтезироваться непосредственно в слизистой оболочке плазмоцитами после антигенспецифической стимуляции [4]. Помимо интеграции с IgA при реализации защитных функций IgM, IgG и IgD могут усиливать взаимодействие между мукозальным и системным иммунными компартментами [11].
Имеющиеся фундаментальные знания о мукозальном иммунитете представляют научно-практический интерес в патогенетическом обосновании мультимодального подхода к диагностике, терапии и профилактике заболеваний полости рта.
Целью литературного обзора стали анализ и обобщение научных данных о патогенетических изменениях саливарных иммуноглобулинов при заболеваниях полости рта с акцентом на диагностическую ценность исследования антител.
Материал и методы исследования. Тематический поиск научных работ осуществляли в когорте полнотекстовых обзорных и оригинальных статей рецензируемых научных журналов, монографий, размещенных в научных электронных библиотеках eLibrary, PubMed в открытом доступе, по ключевым словам. Поисковые запросы включали литературные источники 2015–2025 гг. Качество публикаций оценивали по степени сопряженности с тематикой данного обзора, наглядности иллюстративного материала, количеству цитирований. Критериями исключения явились размещение в открытом доступе только аннотации статьи, ретрагирование публикации. Суммарно из 6363 источников в основу обзора легли данные 34 публикаций.
Результаты исследования и их обсуждение
Считается, что воспалительный процесс в тканях полости рта ассоциирован в большей степени со снижением саливарного sIgA. В свою очередь, дефицит sIgA обусловливает склонность к рецидивам воспалительного процесса [4]. С другой стороны, увеличение количества sIgA отмечается при формировании патомикробиоценоза и при остром инфекционном процессе, что является компенсаторной транзиторной реакцией [8]. Показано, что у пациентов с обострением хронического рецидивирующего герпетического стоматита дисбаланс саливарных иммуноглобулинов имел возрастные особенности [12].
В ряде исследований установлена обратная взаимосвязь содержания sIgA в ротовой жидкости спортсменов и силы физической нагрузки: высокоинтенсивные упражнения и силовые тренировки сопровождаются снижением количества саливарного IgA, что ассоциируется с повышением восприимчивости к инфицированию верхних дыхательных путей и желудочно-кишечного тракта [5; 13; 14]. Следовательно, детекция до- и постнагрузочного уровней sIgA в слюне обладает диагностической ценностью, позволяя установить выраженность дефицита иммуноглобулина в условиях активизации белкового катаболизма и ингибирующего действия кортизола. Проведение грамотной своевременной коррекции диеты и профилактической иммуномодуляции будет способствовать нормализации иммунной реактивности, эубиозу и восстановлению «барьерной» целостности слизистых оболочек. Апробация новых и уже известных методик «управления» стрессом имеет потенциальную возможность нивелировать иммуносупрессивное действие кортизола и интерлейкина (IL)-10 на мукозальный иммунитет полости рта, респираторного и гастроинтестинального трактов [5].
Изменения антителопродукции при заболеваниях полости рта
Напряженность мукозального гуморального иммунитета может варьировать в зависимости от возрастного периода, гигиенического состояния полости рта, изменений микробиоценоза, нозологической формы и тяжести заболевания полости рта [15].
Так, у детей 1-5 лет с кариесом зубов различной степени интенсивности была выявлена отрицательная корреляционная связь между количеством sIgA в ротовой жидкости и интенсивностью кариеса: уровень саливарного sIgA снижался при нарастании кариозного процесса [16].
В работе А.И. Булгаковой и соавт. (2018) у взрослых пациентов с хроническим катаральным гингивитом отмечена тенденция к снижению содержания sIgA в ротовой жидкости на фоне десквамации эпителия десны [17].
При обследовании 10-17-летних подростков с рецидивирующим герпетическим стоматитом наблюдалось снижение количества sIgA в слюне (0,38–0,51 г/л против 0,75 г/л у здоровых лиц) [18].
Ранее при исследовании лиц пожилого возраста с заболеваниями слюнных желез (сиаладениты, сиалозы, доброкачественные/злокачественные опухоли) было установлено достоверное снижение уровня sIgA в слюне по сравнению с нормативом (0,75–1,1 г/л) во всех группах пациентов с наибольшим дефицитом при сиаладените (в 2 раза) и злокачественных опухолях (в 3 раза). Двукратное увеличение саливарного IgG у больных с доброкачественными опухолями слюнных желез могло быть обусловлено гиперплазией клеток, в том числе антителопродуцентов. Накопление IgМ в слюне пациентов со злокачественными новообразованиями слюнных желез авторами объяснялось изъязвлением слизистой оболочки полости рта и транссудацией пентамеров из крови [4].
Имеются данные о вдвое меньшей концентрации саливарного sIgA у больных с периимплантитом (0,52 г/л) в сравнении со здоровыми лицами (1,1 г/л) [2].
При красном плоском лишае полости рта наблюдались более высокие уровни sIgA в слюне, что могло быть обусловлено уменьшением саливации, а не увеличением антителопродукции [19; 20].
Таким образом, изменения количества sIgA в слюне могут быть обусловлены не только иммунным ответом на патогены, импланты, повреждения слизистой, но и изменениями слюноотделения. При этом однократно определенное значение секреторного полимера Ig не в полной мере отражает иммуно-микробиологическую сопряженность, а увеличение/снижение параметра может являться транзиторной реакцией.
Изменения иммуноглобулинов полости рта при коморбидной патологии
Установлено, что компоненты ротовой жидкости являются чувствительными индикаторами коморбидных заболеваний [21].
Заболевания слюнных желез ассоциированы с рядом сопутствующих заболеваний организма: вегетативно-сосудистой дистонией, кистозными поражениями внутренних органов, хроническим простатитом, сахарным диабетом, болезнями опорно-двигательного аппарата, органов респираторного тракта [4]. Соответственно, при коморбидных состояниях изменяется и напряженность иммунитета. Так, в исследовании Д.А. Доменюка и соавторов у детей была установлена сопряженность количественных изменений иммуноглобулинов в плазме крови и ротовой жидкости с уровнем компенсации сахарного диабета 1-го типа: уменьшение степени компенсации заболевания сопровождалось угнетением активности IgA, sIgA при нарастании уровней IgM, IgG [22].
Напротив, у пациентов с неконтролируемым диабетом 2-го типа с оральным эритематозным кандидозом, абсцессами или ксеростомией, по сравнению с обследованными с контролируемым течением диабета, определялись более высокие уровни sIgA, значимые положительные корреляции между sIgA и индексом интенсивности кариеса, индексом пародонтальных заболеваний [23]. Обнаруженные изменения, вероятно, являются компенсаторной транзиторной реакцией на избыточную антигенную нагрузку и свидетельствуют об адекватной иммунной реактивности пациентов.
Имеются сведения о снижении концентрации sIgA в ротовой жидкости женщин 25–35-летнего возраста, больных хроническим рецидивирующим афтозным стоматитом на фоне урогенитальной инфекции [24].
Показано, что у пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ), в слюне содержится более низкая концентрация IgA (в среднем 81,61 мг/дл против 145,57 мг/дл у здоровых лиц), видимо, по причине CD4+-Т-лимфоцитопении и угнетения специфической активации Т-хелперами В2-лимфоцитов, что сопровождалось повышением распространенности кариеса зубов (индекс интенсивности кариеса составил в среднем 3,86 против 2,54 у здоровых лиц). Считается, что sIgA препятствует избыточной колонизации слизистой полости рта, как прямо, предотвращая адгезию кариесогенных бактерий к эмали зубов, вирусов и грибов, так и опосредованно, ингибируя активность глюкозилтрансфераз и синтез внеклеточных глюканов, тем самым коагрегацию микроорганизмов и профилактируя развитие кариеса и гнойно-воспалительных заболеваний [25]. Следовательно, дефицит sIgA в слюне у ВИЧ-инфицированных лиц является важным патогенетическим звеном развития локальных и системных оппортунистических микст-инфекций, предрака и рака [5]. Одним из последствий снижения Ig может быть контаминация полости рта Staphylococcus aureus и Candida аlbicans, синергические взаимодействия которых способствуют образованию биопленок, увеличению активности ферментов агрессии (фосфолипазы, протеазы, L-лактатдегидрогеназы) условно-патобионтов, супрессии фагоцитарной активности нейтрофилов и иммунной реактивности в целом [26; 27].
Причинно-следственные связи дефицита sIgA в слюне с развитием патомикробиоценоза у ВИЧ-инфицированных лиц схематично показано на рисунке. Формирование подобных «порочных кругов» представляется потенциально возможным и в других случаях тотальной иммуносупрессии.
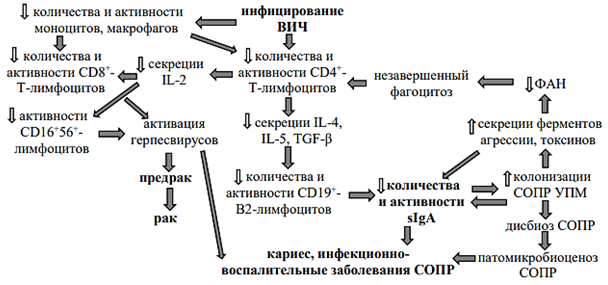
Патогенетические звенья дисрегуляции мукозального иммунного ответа у ВИЧ-инфицированных лиц
Примечания: СОПР – слизистая оболочка полости рта, УПМ – условно-патогенный микроорганизм, ФАН – фагоцитарная активность нейтрофилов, CD – кластер дифференцировки, IL – интерлейкин, TGF-β – трансформирующий фактор роста-β.
Источник: составлено авторами на основе [5; 26; 27].
Изменения специфических антител при заболеваниях полости рта
Перед анализом качественных и количественных изменений специфических иммуноглобулинов целесообразно привести данные по структуре микробиоценоза полости рта в норме и при патологии. В данном аспекте интересным представляется исследование Бурлаковой Л.А. и соавт. по сравнению многообразия бактериальной популяции у здоровых людей и у пациентов с периимплантитом. Авторами установлено у здоровых лиц превалирование бактерий родов Streptococcus и Haemophilus (18,8% и 15,2% соответственно среди идентифицированных при секвенировании 16S РНК), Prevotella melaninogenica (12,2%), Veillonella dispar (11,2%). При периимплантите в полости рта доминировали бактерии родов Prevotella (19,2%), Streptococcus (14,5%), Haemophilus (10,1%) при значимом представительстве родов Veillonella (7,9%), Fusobacterium (7,7%), Porphyromonas (4,3%) [2]. Обнаружение порфиромонад является фактором риска утяжеления патологического процесса из-за ассоциации Porphyromonas (Р.) gingivalis с развитием пародонтита и других воспалительных заболеваний полости рта [28]. Считается, что слюна служит питательной средой для P. gingivalis, P. intermedia, Treponema (T.) denticola. При супрессии мукозального иммунитета избыточный рост данных пародонтопатогенных бактерий может способствовать развитию воспаления в пародонте, прогрессированию патологического процесса, системным осложнениям [29].
Сопоставление численности родов у здоровых и больных периимплантитом с концентрацией sIgA в слюне позволило установить высоко значимую положительную корреляционную связь, свидетельствующую об увеличении количества sIgA при росте бактериальной контаминации слизистой оболочки полости рта [2].
В ротовой жидкости обнаруживаются секреторные антитела к Streptococcus mutans, способствующие защите от кариеса зубов [30]. Интересно, что авидность IgA слюны к антигенам стрептококков полости рта возрастает с первых 3 месяцев жизни, у доношенных детей больше, чем у недоношенных [7]. С учетом ранее доказанной значимой кариесогенной роли указанной бактерии логичным следствием дефицита синтеза Ig будет являться повышенная заболеваемость кариесом зубов, что и демонстрирует ряд исследований. Напротив, стимуляция антителопродукции может угнетать контаминацию патобионтами слизистой оболочки полости рта, приводить к эубиозу, способствуя профилактике кариеса зубов [25; 30].
Имеются данные о позитивной корреляционной связи тяжести воспаления пародонта и количества саливарного IgA, превалировании содержания в слюне специфических IgA и IgG к антигенам P. gingivalis и T. denticola у больных пародонтитом относительно здоровых [31].
При сравнительном исследовании лиц с преддиабетом и с нормогликемией в первой когорте видовой состав бактерий был обеднен, отмечался повышенный уровень IgA в слюне против Haemophilus species (spp.) [32].
Изменения антителопродукции в полости рта на фоне терапии иммуномодуляторами
Имеются результаты лечения женщин, больных хроническим рецидивирующим афтозным стоматитом на фоне урогенитальной инфекции, сублингвальными таблетками «Галавит» в комплексе с препаратами «Атаракс» и «Эплан». Отмечено увеличение сниженного до терапии содержания sIgA с сохранением стабильно нормального уровня в течение года, что сопровождалось улучшением клинического состояния и длительным (12 месяцев) безрецидивным периодом [24].
10-дневное сублингвальное применение препарата «Ликопид»® по 1 мг у пациентов 19-22-летнего возраста с кариесом окклюзионных и контактных поверхностей боковых зубов приводило к снижению изначально увеличенного уровня sIgA и частоты встречаемости P. gingivalis, Clostridium spp., повышению колонизации слизистой оболочки полости рта Lactobacterium spp. [8].
В когорте пожилых обследуемых, принимавших пробиотик на основе Bacillus subtilis 4 периодических курса по 10 дней с 18-дневными перерывами, количество саливарного sIgA значимо увеличивалось [33]. В итоге прием пробиотиков может быть рекомендован пожилым лицам как мера усиления мукозального иммунитета и неспецифической профилактики инфекционно-воспалительных заболеваний полости рта, респираторного и гастроинтестинального трактов.
Курсовое применение пробиотического комплекса «Асепта» (Lactobacillus plantarum CECT 7481 и Lactobacillus brevis CECT 7480) по 1 таблетке в день в течение 30 суток 35-59-летними женщинами, страдающими сахарным диабетом 2-го типа и хроническим генерализованным пародонтитом средней тяжести, способствовало увеличению уровня sIgA в слюне с 0,57 до 0,95 г/л, что превысило данные пациентов, не применяющих пробиотик (0,69 г/л) [34].
Заключение. Имеющиеся научные данные об изменениях саливарных иммуноглобулинов в подавляющем большинстве содержат информацию о sIgA, что отражает его значимость в мукозальном иммунитете. Количество и функциональная активность sIgA зависят от многих факторов: состояния иммунной системы, наследственности, возраста, циркадианных ритмов, физической и психологической нагрузки, морфофункционального и гигиенического состояния слизистых оболочек, микробиома организма, наличия и тяжести соматических заболеваний, пищевого рациона, химических аддикций.
Считается, что дефицит sIgA обусловливает развитие и хронизацию воспалительного процесса. При этом формирование патомикробиоценоза и острая фаза инфекционного процесса, как правило, сопровождаются увеличением количества sIgA, что является компенсаторной транзиторной реакцией на антигенную нагрузку.
Высокоинтенсивная физическая нагрузка, особенно в условиях стресса, сопровождается снижением количества саливарного IgA, что ассоциируется с повышением восприимчивости к инфицированию верхних дыхательных путей и желудочно-кишечного тракта. Поэтому определение до- и постнагрузочного уровней sIgA в слюне обладает диагностической ценностью. Уменьшение количества саливарного sIgA отмечается при нарастании кариозного процесса, при стоматите, гингивите, сиаладените, периимплантите и злокачественных опухолях слюнных желез. Увеличение в слюне содержания IgG имело место у больных с доброкачественными опухолями слюнных желез, IgМ – у пациентов со злокачественными новообразованиями слюнных желез, sIgA – при красном плоском лишае полости рта.
Уровень саливарного sIgA является чувствительным индикатором коморбидных заболеваний, исследование его содержания в слюне активно используют у больных сахарным диабетом, при сочетанных инфекциях полости рта и внутренних органов.
Количество sIgA в слюне изменяется при росте контаминации слизистой оболочки полости рта микроорганизмами. Показано, что специфические антитела могут способствовать уменьшению распространенности кариеса зубов, тяжести пародонтита. В ряде исследований терапия иммуномодуляторами и пробиотиками приводила к позитивным изменениям антителопродукции в полости рта, нормализации микробиома, улучшению клинического состояния.
Таким образом, вариации содержания иммуноглобулинов в слюне отражают состояние мукозального иммунитета, наличие и выраженность патологического процесса. Исследование уровней саливарных иммуноглобулинов, прежде всего sIgA, может повысить специфичность комплекса маркеров при дифференциации воспалительных, предопухолевых и опухолевых заболеваний полости рта. Изменение параметра можно успешно применять в качестве индикатора эффективности терапевтической и профилактической иммуномодуляции.



