Введение
Почечная дисфункция считается «тихим убийцей», поскольку с трудом диагностируется на ранней стадии и может привести к развитию терминальной почечной недостаточности [1]. Еще в XX в. обнаружили, что феномен гиперфильтрации непосредственно связан с развитием микроальбуминурии [2]. Некоторые авторы называют гиперфильтрацию в своих трудах «тихой эпидемией» и подчеркивают важность ее ранней диагностики. Согласно теории интактного нефрона, функционирующие нефроны берут на себя работу погибших. Для этого они увеличиваются в размерах и повышают скорость клубочковой фильтрации (СКФ), однако в таких условиях развиваются дезадаптация и последующая гибель гипертрофированных нефронов. Это приводит, соответственно, к снижению числа функционирующих структурных единиц почек [3].
В связи с тем, что дебют клинической симптоматики наблюдается только на более поздних стадиях повреждения почек, целесообразно исследовать биомаркеры, позволяющие выявить раннюю почечную дисфункцию [4]. К таким эндогенным маркерам относят мочевину, креатинин, цистатин С, β2-микроглобулин и другие ограниченно используемые в практической медицине [5].
В настоящее время широко применяется определение креатинина сыворотки крови. Его уровень относительно стабилен, но необходимо также учитывать некоторые факторы: пол, возраст, выраженность мышечной ткани. Данный маркер широко используется для расчета СКФ, но в то же время имеется ряд ограничений его эффективности в диагностике ранней почечной дисфункции [5, 6].
И цистатин С, и креатинин, в сыворотке отражают гломерулярную функцию и характеризуют ее динамику на всем диапазоне скорости клубочковой фильтрации от гиперфильтрации до ранних стадий гипофильтрации. Однако, в отличие от креатинина, повышение цистатина С свидетельствует о преклиническом заболевании почек [7], связанном с высоким риском его прогрессирования в клиническую стадию [8]. Возраст, пол и выраженность мышечной ткани не оказывают влияния на концентрацию цистатина С в сыворотке крови, что отличает его от креатинина [5]. По данным исследований взаимосвязи уровня цистатина С сыворотки крови и ожирения [9], экспрессия гена цистатина С в 2–3 раза выше в жировой ткани, что объясняет более высокие значения цистатина С у больных, страдающих ожирением. Но в то же время существуют сведения об отражении реальной функции почек по уровню цистатина С вне зависимости от степени ожирения [9].
В соответствии с результатами исследования А.П. Реброва, в которое были включены 94 пациента в возрасте 30–65 лет, установили взаимосвязь между уровнем цистатина С сыворотки крови, стадией и риском АГ, стадией и функциональным классом хронической сердечной недостаточности, а также многими эхокардиографическими показателями, указывающими на ремоделирование миокарда [10].
Рекомендации по предпочтению расчетных формул для определения скорости клубочковой фильтрации по уровню сывороточного цистатина С приведены в последних гайдлайнах KDIGO от 2024 г. (Kidney Disease: Improving Global Outcomes) [11]. Обоснование использования цистатина С в сравнении с креатинином сыворотки крови или их комбинации в уравнениях расчетной СКФ заключается в том, что уровень креатинина, который напрямую связан с мышечной массой, может вводить в заблуждение при определенных состояниях (травмах спинного мозга и саркопении), а также в том, что на уровень цистатина С влияют различные переменные (употребление стероидов, заболевания щитовидной железы и рак). При сравнении оценок СКФ с использованием этих двух методов фильтрации, градиенты риска для большинства исходов при СКФ по цистатину С стабильно выше по сравнению с СКФ по креатинину. Таким образом, для оценки связи расчетной СКФ с исходами (то есть для прогнозирования состояния пациентов с ХБП) более точным можно считать СКФ по цистатину С или СКФ по цистатину С и креатинину. Стоит также отметить, что затраты на использование цистатина С для диагностики ранней почечной дисфункции в настоящее время выше, чем при применении креатинина, однако необходимость в точном измерении может компенсировать эти затраты, привести к снижению использования ресурсов и расходов на здравоохранение по сравнению с диагностикой на более поздних стадиях ХБП [11].
Из представленной информации об основных маркерах почечной дисфункции логично следует, что основные формулы для расчета СКФ включают в себя такие показатели, как креатинин или цистатин С [5]. С учетом вышеперечисленных преимуществ цистатина С перед креатинином является целесообразным использование калькуляторов, включающих данный показатель в расчетные формулы оценки СКФ [10, 11]. Однако данных об эффективности этих калькуляторов на ранних стадиях кардиоренометаболических нарушений в молодом возрасте недостаточно, что и определило направление данного исследования.
Цель исследования – сравнить эффективность калькуляторов CKD-EPIcyst 2012 и CKD-EPIcre 2021 в диагностике ранней почечной дисфункции и сопоставить изменения факторов кардиометаболического риска с СКФ по CKD-EPIcyst 2012 в молодом возрасте.
Материал и методы исследования
На базе Консультативно-диагностического центра Авиастроительного района г. Казани было проведено обсервационное одномоментное исследование по типу «случай-контроль». Пациенты набраны в соответствии с критериями невключения: верифицированные кардиометаболические заболевания (сахарный диабет, ишемическая болезнь сердца, хроническая сердечная недостаточность, фибрилляция предсердий), установленные заболевания почек, сопутствующие заболевания или состояния в стадии декомпенсации функции органов и/или систем (почек, печени, сердечно-сосудистой и дыхательной систем); заболевания эндокринной системы с нарушениями функции гипофиза, надпочечников, щитовидной железы и другие заболевания и состояния, являющиеся вторичной причиной ожирения; антифосфолипидный синдром и аутоиммунные воспалительные заболевания; верифицированная онкологическая патология на момент обследования; острые инфекционные заболевания; психические заболевания, затрудняющие контакт; отказ от участия в исследовании; наличие имплантированных медицинских устройств, включая электрокардиостимулятор, силиконовых имплантатов, металлических протезов и конструкций; беременность и лактация.
Исследование одобрено Локальным этическим комитетом ФГБОУ ВО «Казанский государственный медицинский университет» (протокол № 6 от 22 июня 2021 г.). Все обследованные подписали информированное добровольное согласие.
Включено 94 пациента (М/Ж = 52,1 %/47,9 %), медиана (Ме) возраста составила – 36,0 [32,8–39,0] лет. Проведен объективный осмотр с анализом жалоб, анамнеза, медицинской документации, проведением антропометрии. У всех участников исследования измерялось АД на аппарате Omron M2 Basic (производитель OMRON Healthcare Co. Ltd., Китай/Япония) с соблюдением условий и техники в соответствии с клиническими рекомендациями [12]. Лабораторно-инструментальное обследование включало: исследование показателей углеводного обмена (глюкоза плазмы натощак, гликированный гемоглобин); липидограмму (общий холестерин (ОХЛ), триглицериды (ТГ), холестерин липопротеинов высокой плотности (ХС-ЛВП), холестерин липопротеинов низкой плотности (ХС-ЛПНП), холестерин липопротеинов невысокой плотности (ХС-неЛВП), мочевую кислоту, электролиты (калий, натрий, хлор), инсулин, цистатин С, креатинин, общий анализ мочи с анализом микроальбуминурии. Исследован композиционный состав тела методом биоимпедансометрии на аппарате TANITA BC-601.
Уровень глюкозы крови натощак определяли ферментативным гексокиназным методом (тест-комплект компании Beckman Coulter, Ирландия), гликированного гемоглобина (HbA1c) – методом турбидиметрического иммуноингибирования (тест-комплект компании Randox, Великобритания) на автоматическом биохимическом анализаторе AU480 (фирма «Beckman Coulter», США). Исследование липидограммы проводили на автоматическом биохимическом анализаторе AU480 (фирма «Beckman Coulter», США). ОХЛ определяли ферментативным колориметрическим методом (тест-комплект компании Beckmann Coulter, Ирландия). ХС-ЛПВП исследован гомогенным энзиматическим колориметрическим методом (тест-комплект компании Beckmann Coulter, Япония). Определение уровня ХС-ЛПНП – с помощью прямого энзиматического метода (тест-комплект компании Beckmann Coulter, Япония). ТГ исследованы энзиматическим колориметрическим методом (GPO/PAP) с глицерол-фосфат-оксидазой и 4-аминофеназоном (тест-комплект компании Beckmann Coulter, Ирландия). Уровень холестерина липопротеинов невысокой плотности (ХС-неЛВП) рассчитывали по формуле (ХС-неЛВП (ммоль/л) = ОХС – ХС-ЛПВП) [13]. Определение инсулина сыворотки крови проводилось методом иммуноферментного анализа на анализаторе Immulite 1000 (фирма «Siemens», Германия) с помощью тест-комплекта (компания Siemens Healthcare Diagnostics Products Ltd, Великобритания). Также был рассчитан индекс инсулинорезистентности (HOMA-IR) по формуле. (HOMA-IR = (инсулин натощак (мкЕд/мл)×глюкоза натощак (ммоль/л))/22,5) [13]. Оценку функции почек проводили посредством измерения уровня креатинина кинетическим колориметрическим методом (тест-комплект компании Beckman Coulter, Ирландия) на автоматическом биохимическом анализаторе AU480 (фирма «Beckman Coulter», США), цистатина С – методом иммуноферментного анализа на анализаторе аппарата «Алисей» (Россия) с использованием тест-системыАЛКОР-БИО. Изучен уровень мочевой кислоты (МК). Общий анализ мочи изучен на автоматическом анализаторе CLINITEK Status ® (фирма Siemens Healthcare Diagnostics Inc., США) при помощи тест-полосок «Clinitek Microalbumin 9» (производитель Siemens Healthcare Diagnostics, США) c определением относительной плотности и остатков мочи, наличия альбумина в моче и с автоматическим расчетом результатов отношения альбумина к креатинину (А:С).
Анализировалось наличие кардиометаболических факторов риска (КМФР) [14]: избыточной массы тела (ИзМТ) ≥ 25,0 кг/м2, ожирения ≥ 30,0 кг/м2 (в соответствии с классификацией Всемирной организации здравоохранения), абдоминального ожирения (АО) по окружности талии (ОТ) ≥ 94 см у мужчин и ≥ 80 см у женщин и/или соотношению ОТ к окружности бедра (ОБ) > 0,9 (муж.) и > 0,85 (жен) [15]. Уровень висцерального жира (УВЖ) определяли по данным биоимпедансометрии (1–12 нормальное содержание; 13–59 повышенное содержание). Учитывалась артериальная гипертония (АГ) и повышенное артериальное давление (АД) ≥ 130/85 мм рт. ст. или прием гипотензивных препаратов; гиперхолестеринемия (ГХЛ) ≥ 5 ммоль/л; повышение липопротеинов низкой плотности (ХС-ЛПНП) – в соответствии с индивидуальным сердечно-сосудистым риском; снижение липопротеинов высокой плотности (ХС-ЛПВП) < 1,0 (муж.) и < 1,2 (жен) ммоль/л, повышение липопротеинов невысокой плотности (ХС-неЛВП) > 3,4 ммоль/л, гипертриглицеридемия (ГТГ) ≥ 1,7 ммоль/л, преддиабет; инсулинорезистентность (ИР) (повышение индекса HOMA-IR более 2,52). За микроальбуминурию принималось соотношение альбумина к креатинину (А:С) = 30–300 мг/г.
Функцию почек оценивали по скорости клубочковой фильтрации (СКФ) по калькуляторам:
CKD-EPIcre 2021 (Chronic Kidney Disease Epidemiology Collaboration по креатинину) = 141×min (Scr/0,9), 1)-0,411 × max (Scr**/0,9), 1)-1,209 × 0,993Возраст(для мужчин) или = 144×min (Scr**/0,7), 1)-0,329 × max (Scr**/0,7), 1)-1,209 × 0,993Возраст (для женщин) [16];
CKD-EPIcyst 2012 (Chronic Kidney Disease Epidemiology Collaboration по цистатину С) = 133×min (Цистатин С в сыворотке крови/0.8, 1)-0.499×max (Цистатин С в сыворотке крови/0.8, 1)-1.328×0,996 Возраст×Пол, для женщин: пол = 0,932 [17].
Статистический анализ проводился с использованием IBM SPSS® Statistics версии 26 (IBM Corp., Armonk, NY, США). Количественные показатели представлены в виде медианы и интерквартильного размаха – Ме [25 %; 75 %]. Качественные показатели описаны в виде абсолютных чисел (n) и процентов (%). Для анализа в двух несвязанных выборках применялись U-критерий Манна – Уитни, критерии χ2 Пирсона и Фишера. Статистическая значимость общего направления сдвига качественной переменной оценивалась по критерию χ2 Пирсона, количественной переменной – по критерию Краскела – Уоллиса. Различия между группами считались статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
Средний уровень цистатина С в общей когорте составил 0,78 [0,67–0,87] мг/л. Пациенты были поделены на три группы в зависимости от СКФ по калькулятору CKD-EPIcyst 2012: группа 1 – СКФ 119–90 мл/мин/1,73 м2 (n = 41), группа 2 – СКФ ≥ 120 мл/мин/1,73 м2 (n = 28) и группа 3 – СКФ 89–60 мл/мин/1,73 м2 (n = 25). Уровень цистатина С и СКФ по калькулятору CKD-EPIcyst 2012 составили соответственно: в группе 1– Ме 0,78 [0,74–0,85] мг/л и Ме 104,8 [97,9–114,4], в группе 2 – Ме 0,65 [0,61–0,67] мг/л и Ме 124,1 [131,1–144,3], в группе 3 – Ме 0,9 [0,88–0,95] и Ме 85,2 [81,9–87,7]. Все группы были сопоставимы между собой по полу (р > 0,05). Получены достоверные различия в возрасте среди пациентов групп 1 и 3 (Ме 35,0 [31,5–38,5] лет и 38,0 [35,5–43,0] соответственно, р = 0,020).
При сопоставлении данных по калькуляторам CKD-EPIcre 2021 и CKD-EPIcyst 2012, выявили, что в общей выборке СКФ 119–90 мл/мин/1,73 м2 по калькулятору CKD-EPIcre 2021 была выявлена в 80,9 %, в то время как по CKD-EPIcyst 2012 только в 43,6 % (табл. 1). При этом более половины пациентов, у которых отмечалась нормальная СКФ по калькулятору CKD-EPIcre 2021, имели значения СКФ, соответствующие гиперфильтрации или сниженной СКФ. СКФ ≥ 120 мл/мин/1,73 м2 по CKD-EPIcre 2021 выявили лишь в 3,1 %, тогда как по CKD-EPIcys 2012 в 10 раз чаще. СКФ = 89–60 мл/мин/1,73 м2 установлена в 16 % по CKD-EPIcre 2021, в то время как по CKD-EPIcyst 2012 она регистрировалась более чем в 1,5 раза чаще.
Таблица 1
Сопоставление СКФ по CKD-EPIcre 2021 и СКФ по CKD-EPIcyst 2012, n (%)
|
Общая выборка |
СКФ 119–90 мл/мин/1,73 м2 по CKD EPIcyst 2012 (n = 41) |
СКФ ³ 120 мл/мин/1,73 м2 по CKD EPIcyst 2012 (n = 28) |
СКФ 89–60 мл/мин/1,73 м2 по CKD EPIcyst 2012 (n = 25) |
|
|
1 |
2 |
3 |
||
|
СКФ по CKD-EPIcre 2021 ≥ 120 мл/мин/1,73 м2 |
3 (100 %) |
1 (33,3 %) |
2 (66,7 %) |
0 (0,0 %) |
|
СКФ по CKD-EPIcre 2021 = 119–90 мл/мин/1,73 м2 |
76 (100 %) |
33 (43,4 %) |
22 (29,0 %) |
21 (27,6 %) |
|
СКФ по CKD-EPIcre 2021 = 89–60 мл/мин/1,73 м2 |
15 (100 %) |
7 (46,6 %) |
4 (26,7 %) |
4 (26,7 %) |
Примечание: составлена авторами на основе полученных данных в ходе исследования; n – количество лиц, у которых выявлен признак; % – доля лиц, у которых выявлен признак
При анализе частоты КМФР выявили, что в общей когорте пациентов более чем в половине случаев встречались ИМТ ≥ 25 кг/м2, повышенный уровень ХС-ЛПНП, ХС-неЛВП, АО (рисунок).
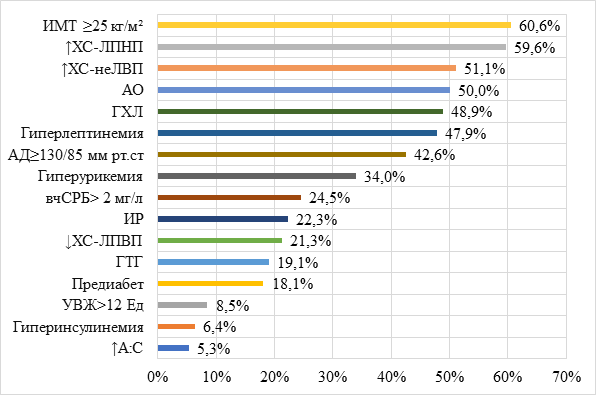
Частота КМФР в общей когорте
На основании результатов, полученных по калькулятору CKD-EPIcyst 2012, далее проанализирована разница в профиле факторов кардиометаболического риска в группах с различным уровнем СКФ. Установлено, что АО наблюдалось достоверно чаще в группе пациентов с СКФ = 60–89 мл/мин/1,73 м2, чем у пациентов с нормальной СКФ (табл. 2).
Таблица 2
Частота КМФР в группах с различной СКФ по CKD EPIcyst 2012, n (%)
|
Факторы |
Группа 1 СКФ 119–90 по CKD EPIcyst 2012 (n = 41) |
Группа 2 СКФ ³ 120 по CKD EPIcyst 2012 (n = 28) |
Группа 3 СКФ 89–60 по CKD EPIcyst 2012 (n = 25) |
р
|
рG |
|
ИМТ = 25–29,9, кг/м2 |
10 (24,4 %) |
9 (32,1 %) |
10 (40,0 %) |
1–2 = 0,585; 1–3 = 0,181; 2–3 = 0,580 |
0,416 |
|
ИМТ ≥ 25, кг/м2 |
22 (53,7 %) |
16 (57,1 %) |
19 (76,0 %) |
1–2 = 0,775; 1–3 = 0,116; 2–3 = 0,245 |
0,191 |
|
ИМТ ³ 30, кг/м2 |
12 (29,3 %) |
6 (21,4 %) |
9 (36,0 %) |
1–2 = 0,581; 1–3 = 0,596; 2–3 = 0,360 |
0,498 |
|
АО |
17 (41,5 %) |
13 (46,4 %) |
17 (68,0 %) |
1–2 = 0,683; 1–3 =0,045; 2–3 = 0,166 |
0,106 |
|
УВЖ >12 Ед |
3 (7,3 %) |
2 (7,1 %) |
3 (12,0 %) |
1–2 = 1,0; 1–3 = 0,666; 2–3 = 0,658 |
0,803 |
|
АД ³ 130/85, мм рт. ст. |
18 (43,9 %) |
10 (35,7 %) |
12 (48,0 %) |
1–2 = 0,619; 1–3 = 0,746; 2–3 = 0,365 |
0,669 |
|
САД ³ 130, мм рт. ст. |
15 (36,6 %) |
8 (28,6 %) |
8 (32,0 %) |
1–2 = 0,605; 1–3 = 0,795; 2–3 = 1,0 |
0,787 |
|
ДАД ³ 85, мм рт. ст. |
12 (29,3 %) |
8 (28,6 %) |
8 (32,0 %) |
1–2 = 1,0; 1–3 = 1,0; 2–3 = 1,0 |
1,0 |
|
ГХЛ |
22 (53,7 %) |
14 (50,0 %) |
10 (40,0 %) |
1–2 = 0,765; 1–3 = 0,281; 2–3 = 0,465 |
0,564 |
|
↑ХС-ЛПНП |
26 (63,4 %) |
16 (57,1 %) |
14 (56,0 %) |
1–2 = 0,6; 1–3 = 0,550; 2–3 = 0,933 |
0,802 |
|
¯ХС-ЛПВП |
10 (24,4 %) |
5 (17,9 %) |
5 (20,0 %) |
1–2 = 0,568; 1–3 = 0,769; 2–3 = 1,0 |
0,811 |
|
ХС-неЛВП > 3,4, ммоль/л |
19 (46,3 %) |
11 (39,3 %) |
18 (72,0 %) |
1–2 = 0,562; 1–3 = 0,073; 2–3 = 0,027 |
0,044 |
|
ГТГ |
10 (24,4 %) |
4 (14,3 %) |
4 (16,0 %) |
1–2 = 0,372; 1–3 = 0,541; 2–3 = 1,0 |
0,567 |
|
Гиперлептинемия |
21 (51,2 %) |
12 (42,9 %) |
12 (48,0 %) |
1–2 = 0,725; 1–3 = 0,964; 2–3 = 0,855 |
0,957 |
|
ИР |
9 (42,9 %) |
5 (17,9 %) |
7 (28,0 %) |
1–2 = 0,767; 1–3 = 0,768; 2–3 = 0,514 |
0,738 |
|
Гиперинсулинемия |
2 (22,0 %) |
3 (10,7 %) |
1 (4,0 %) |
1–2 = 0,548; 1–3 = 0,847; 2–3 = 0,652 |
0,825 |
|
Преддиабет |
4 (9,8 %) |
7 (25,0 %) |
6 (24,0 %) |
1–2 = 0,106; 1–3 = 0,161; 2–3 = 1,0 |
0,172 |
|
Впервые выявленный СД2 |
4 (9,8 %) |
1 (3,6 %) |
0 (0,0 %) |
1–2 = 0,641; 1–3 = 0,289; 2–3 = 1,0 |
0,320 |
|
Гиперурикемия |
14 (34,2 %) |
8 (28,6 %) |
10 (40,0 %) |
1–2 = 0,793; 1–3 = 0,632; 2–3 = 0,402 |
0,702 |
|
↑А:С |
2 (4,9 %) |
1 (3,6 %) |
2 (8,0 %) |
1–2 = 1,0; 1–3 = 0,630; 2–3 = 0,597 |
0,723 |
|
СРБ > 3 мг/л |
10 (24,4 %) |
6 (21,4 %) |
7 (28,0 %) |
1–2 = 1,0; 1–3 = 0,778; 2–3 = 0,751 |
0,910 |
Примечание: составлена авторами на основе полученных данных в ходе исследования; n – количество лиц, у которых выявлен признак; % – доля лиц, у которых выявлен признак, p1–2 – уровень достоверности между лицами из групп 1 и 2; р2–3 – уровень достоверности между лицами групп 2 и 3, р1–3 – уровень достоверности между лицами групп 1 и 3; pG– статистическая значимость общего направления сдвига измеряемой переменной по критерию χ2 Пирсона
Повышенный уровень ХС-неЛВП регистрировался практически в 2 раза чаще у лиц с СКФ = 60–89 мл/мин/1,73 м2, по сравнению с пациентами групп 1 и 2 (табл. 2). Также были получены статистически значимые различия уровня ХС-неЛВП между группами пациентов с нормальной СКФ и СКФ = 60–89 мл/мин/1,73 м2, а также пациентов с СКФ ≥ 120 мл/мин/1,73 м2 и СКФ = 60–89 мл/мин/1,73 м2 (табл. 3). При этом стоит обратить внимание на то, что статистически незначимая тенденция к увеличению частоты встречаемости наблюдалась у таких КМФР, как АО, ХС-неЛВП > 3,4 ммоль/л среди пациентов группы 3, по сравнению с группой 1 (p > 0,05).
Также была выявлена статистически незначимая тенденция к более высоким значениям УВЖ среди пациентов со сниженной СКФ по сравнению с пациентами из групп 1 и 2, а также увеличению уровня мочевой кислоты у пациентов со сниженной СКФ относительно группы пациентов с гиперфильтрацией. Средние значения HbA1c, А:С в группе пациентов с СКФ = 89–60 по CKD EPIcyst 2012 имели тенденцию к повышению в сравнении с группой 1 (табл. 3).
Таблица 3
Средние значения КМФР в группах с различной СКФ по CKD EPIcyst 2012, Ме[25–75 %]
|
Факторы |
Общая выборка |
Группа 1 СКФ 119–90 по CKD EPIcyst 2012 (n = 41) |
Группа 2 СКФ ³ 120 по CKD EPIcyst 2012 (n = 28) |
Группа 3 СКФ 89–60 по CKD EPIcyst 2012 (n = 25) |
р 1–2 1–3 2–3 |
pK-W |
|
Возраст, лет |
36,0 [32,75–39,0] |
35,0 [31,5–38,5] |
37 [30,5–39,75] |
38,0 [35,5–43,0] |
0,553 0,020 0,171 |
0,077 |
|
ИМТ |
26,05 [23,58–30,33] |
25,7 [23,7–31,0] |
25,75 [22,63–29,35] |
27,6 [24,7–33,7] |
0,595 0,202 0,134 |
0,269 |
|
ИМТ ≥ 25 кг/м2 |
29,4 [26,85–34,6] |
30,3 [27,58–34,55] |
28,85 [26,83–31,43] |
29, 4 [25,8–37,5] |
0,329 0,834 0,608 |
0,663 |
|
ИМТ = 25–29,9, кг/м2 |
27,05 [25,68–28,35] |
27,45 [26,08–28,45] |
27,25 [25,83–28,68] |
26,25 [25,48–28,28] |
0,880 0,496 0,325 |
0,613 |
|
ИМТ ³ 30, кг/м2 |
34,8 [31,8–37,9] |
34,2 [31,83–37,13] |
33,3 [30,23–37,53] |
37,5 [32,15–43,0] |
0,640 0,256 0,111 |
0,272 |
|
УВЖ |
6,0 [4,0–9,0] |
6,0 [4,0–8,0] |
7,0 [4,0–8,0] |
8,0 [5,0–11,0] |
0,930 0,079 0,090 |
0,149 |
|
САД, мм рт. ст. |
121,5 [110,0–133,25] |
123,0 [111,5–135,5] |
120,0 [110,5–132,25] |
118 [109–132] |
0,448 0,368 0,789 |
0,597 |
|
ДАД, мм рт. ст. |
77,0 [68,0–86,25] |
75,0 [68,5–87,0] |
78,5 [68,0–86,75] |
79 [67–85] |
0,718 0,781 0,979 |
0,928 |
|
ОХЛ, ммоль/л |
4,82 [4,14–5,59] |
4,98 [4,05–5,86] |
4,86 [4,06–5,66] |
4,51 [4,17–5,49] |
0,971 0,639 0,593 |
0,853 |
|
ХС-ЛПНП, ммоль/л |
3,18 [2,6–3,7] |
3,3 [2,57–3,7] |
3,28 [2,69–3,75] |
3,08 [2,58–3,54] |
0,835 0,543 0,504 |
0,761 |
|
ХС-ЛПВП, ммоль/л |
1,34 [1,16–1,51] |
1,33 [1,15–1,52] |
1,36 [1,12–1,51] |
1,36 [1,14–1,54] |
0,669 0,653 1,0 |
0,871 |
|
ХС-неЛВП, ммоль/л |
3,45 [2,61–4,09] |
3,24 [2,44–4,0] |
3,12 [2,64–3,88] |
3,87 [3,26–4,66] |
0,705 0,006 0,017 |
0,013 |
|
ТГ, ммоль/л |
0,91 [0,60–1,45] |
0,82 [0,58–1,67] |
0,97 [0,74–1,31] |
0,99 [0,55–1,43] |
0,438 0,963 0,656 |
0,764 |
|
HbA1с, % |
5,4 [5,08–6,0] |
5,1 [4,9–5,9] |
5,5 [5,1–6,0] |
5,5 [5,15–6,0] |
0,141 0,092 0,971 |
0,167 |
|
Глюкоза, ммоль/л |
4,3 [3,9–4,6] |
4,3 [3,99–4,75] |
4,25 [3,9–4,48] |
4,2 [3,98–4,5] |
0,398 0,199 0,879 |
0,431 |
|
Инсулин |
7,67 [4,92–12,68] |
7,09 [4,04–12,2] |
7,78 [5,44–11,3] |
10,5 [5,47–16,3] |
0,566 0,275 0,493 |
0,512 |
|
НOMA-IR |
1,47 [0,89–2,44] |
1,28 [0,76–2,45] |
1,57 [0,93–2,4] |
1,84 [0,96–3,15] |
0,682 0,509 0,656 |
0,766 |
|
А:С, мг/г |
10,0 [5,0–15,0] |
10,0 [10,0–17,5] |
10,0 [5,0–15,0] |
5,0 [5,0–15,0] |
0,157 0,067 0,584 |
0,135 |
|
ККФ, мл/мин/ 1.73 м2 (2021) |
101,49 [71,0–124,0] |
102,0 [96,0–111,0] |
103,5 [96,0–112,5] |
102,0 [91,0–107,0] |
0,471 0,534 0,222 |
0,471 |
|
Креатинин, мкмоль/л |
78,16 [68,77–87,45] |
81,52 [68,69–89,87] |
76,79 [66,12–83,82] |
75,48 [69,2–87,97] |
0,081 0,663 0,412 |
0,254 |
|
Цистатин С, мг/л |
0,78 [0,67–0,87] |
0,78 [0,74–0.85] |
0,65 [0,61–0,67] |
0,9 [0,88–0,95] |
0,000 0,000 0,000 |
0,000 |
|
Мочевая кислота, мкмоль/л |
330,23 [259,28–384,68] |
330,5 [270,31–381, 34] |
306,05 [227,7–374,85] |
339,06 [273,09–395,62] |
0,246 0,583 0,091 |
0,243 |
|
Лептин, нг/мл |
10,55 [4,74–27,42] |
11,82 [4,15–22,56] |
10,55 [5,0–26,87] |
9,14 [5,83–39,68] |
0,944 0,459 0,516 |
0,728 |
|
75,35 [50,38–115,25] |
65,1 [48,25–123,0] |
71,65 [51,93–121,0] |
78,0 [53,55–104,0] |
0,625 0,771 0,910 |
0,886 |
|
|
СРБ, мг/л |
1,33 [0,69–2,96] |
1,65 [0,5–3,02] |
1,14 [0,71–1,76] |
1,56 [0,75–3,97] |
0,638 0,517 0,363 |
0,630 |
Примечание: составлена авторами на основе полученных данных в ходе исследования; n – количество лиц, у которых выявлен признак; p1–2 – уровень достоверности между лицами из групп 1 и 2; р2–3 – уровень достоверности между лицами групп 2 и 3, р1–3 – уровень достоверности между лицами групп 1 и 3; pK-W–достоверность между тремя сравниваемыми группами по Краскелу – Уоллису
Заключение
Полученные результаты позволяют говорить о возможности более раннего выявления почечной дисфункции у лиц молодого возраста с кардиометаболическими факторами риска при использовании для расчета скорости клубочковой фильтрации калькулятора CKD-EPIcyst 2012 по сравнению со стандартным калькулятором CKD-EPIcre 2021. Гиперфильтрация на сегодняшний день считается показателем преклинического поражения почек, тем не менее по мере снижения СКФ в обследованной когорте наблюдалось нарастание частоты абдоминального ожирения, повышенного уровня и медианы ХС-неЛВП (являющегося интегральным показателем атерогенности липидного профиля), у пациентов с СКФ 60–89 в сравнении с лицами с СКФ ≥ 120 мл/мин/1,73 м2, рассчитанной по калькулятору CKD-EPIcyst 2012.



