Введение. Рак тела матки (РТМ) занимает лидирующие позиции в структуре онкогинекологической заболеваемости [1]. Одним из значимых коморбидных состояний при РТМ является сахарный диабет 2 типа (СД2), который выявляется у 15-30% пациенток [2]. Митохондриальная дисфункция играет ключевую роль в патогенезе как онкологических заболеваний, так и СД2 [3; 4]. Копийность генов (copy number variation, CNV), представляющая вариацию количества копий определенных генов в геноме, является важным молекулярным механизмом, влияющим на функционирование митохондрий. CNV возникают в результате делеций, дупликаций, инверсий и других структурных перестроек ДНК и могут иметь значительные функциональные последствия, включая изменения уровня экспрессии генов, нарушения в работе белков и развитие заболеваний [5].
Исследования показывают, что CNV широко распространены в геноме человека и ассоциированы с различными заболеваниями, включая нейродегенеративные, метаболические и онкологические патологии, в том числе рак эндометрия [6; 7].
Изменения копийности генов, регулирующих функционирование митохондрий, могут иметь важное значение в молекулярных механизмах развития и прогрессирования РТМ [8], влияя на апоптоз, энергетический метаболизм и устойчивость к терапии [9]. При этом наличие СД2 может усугублять эти нарушения, способствуя прогрессированию опухоли и снижению эффективности лечения [10; 11].
Целью данного исследования явился анализ относительной копийности генов, регулирующих функционирование митохондрий, у больных РТМ с СД2 и без него.
Материалы и методы исследования
На биоинформационном этапе исследования был выполнен анализ открытой базы данных TCGA (The Cancer Genome Atlas, https://www.cancer.gov/ccg/research/genome-sequencing/tcga) для выявления при раке тела матки аномальной копийности генов, ассоциированных с митохондриальной дисфункцией и сахарным диабетом 2 типа. Данные о числе копий генов были получены из Genomic Data Commons Data Portal (https://portal.gdc.cancer.gov/) с помощью TCGABiolinks (R v.4.0.0, Rstudio). Алгоритм GISTIC был использован для обнаружения областей генома, размер которых значимо изменялся в ряде опухолевых образцов [12].
В исследование была включена 71 пациентка с морфологически верифицированным диагнозом «аденокарцинома тела матки». Больные получали лечение (хирургическое, а также адъювантная терапия: лучевая или комбинации химио- и лучевой терапии) в период с 2023 по 2025 год. Средний возраст пациенток составил 58,3±8,7 года. В зависимости от степени дифференцировки пациентки были разделены на три группы: G1 (n=20), G2 (n=35) и G3 (n=16) [13]. В каждой группе выделяли подгруппы с сопутствующим СД2 и без него. Диагноз СД2 устанавливался на основании критериев ВОЗ (2019). В группе G1 было 6 пациенток с СД2 и 14 без СД2), в группе G2 - 14 пациенток с СД2 и 21 без СД2, в группе G3 - 6 пациенток с СД2 и 10 без СД2.
Относительная копийность генов определялась методом количественной полимеразной цепной реакции (qPCR) в реальном времени в образцах ДНК (выделяли методом фенол-хлороформной экстракции) опухолевой и условно нормальной ткани, полученных при биопсии или во время операции. Анализировались гены, ассоциированные с митохондриальной функцией: MT-CO1, mtTFB, mtSSB, ATAD3, TFAM, POLG, POLRMT, TOP1MT, MGME1, TEFM, MT-RNR2, GCAT и NRF1. В качестве референсных использовались гены домашнего хозяйства (GAPDH, ACTB). Реакцию амплификации проводили на термоциклере CFX96 (Bio-Rad, США) в 20 мкл ПЦР-смеси (ДНК (не менее 1 нг), 0,2 мМ dNTP, 0,4 мкМ праймеры, 2,5 мМ MgCl2, 1X ПЦР-буфер с интеркалирующим красителем EvaGreen и 0,1 е.а./мкл SynTaq ДНК-полимеразы), по следующей программе: 95 °C 4 минуты, 40 циклов: 95 °C 10 секунд, 58 °C 30 секунд (чтение оптического сигнала по каналу FAM) и 72 °C 15 секунд. Относительную копийность (rC) рассчитывали по формуле: rC = E-ΔΔCt [14].
Статистическая обработка данных проводилась с использованием программы R v.4.3.1. Нормальность распределения показателей оценивали с помощью критерия Колмогорова - Смирнова. Для сравнения количественных показателей между группами применяли критерий Манна - Уитни c поправкой Бонферрони на множественное сравнение [14]. Различия считались статистически значимыми при p <0,05. Для описания изменения копийности генов в зависимости от наличия СД2 строились линейные регрессионные модели вида Y=β0+β1⋅X, где Y - относительная копийность гена, X - бинарный показатель наличия СД2 (0 - отсутствие, 1 - наличие), β0 - медиана копийности в группе без СД2, β1 - медиана копийности при наличии СД2.
Результаты исследования и их обсуждение
Проведенный биоинформационный анализ открытых баз данных позволил выявить ряд генетических локусов, изменение копийности которых ассоциировано с митохондриальной дисфункцией и сахарным диабетом 2 типа при раке тела матки - MT-CO1, mtTFB, mtSSB, ATAD3, TFAM, POLG, POLRMT, TOP1MT, MGME1, TEFM, MT-RNR2, GCAT, NRF1. Информация о функциях некоторых локусов представлена в таблице 1.
Таблица 1
Функции генов и клиническая значимость при патологиях матки
|
Ген |
Локализация |
Основная функция |
Роль в онкогенезе РТМ |
|
MT-CO1 |
Митохондрии |
Кодирует субъединицу цитохром-c-оксидазы (каталитическая субъединица комплекса IV дыхательной цепи) |
Снижение → нарушение OXPHOS → активация HIF-1α |
|
mtSSB |
Митохондрии |
Связывание одноцепочечной мтДНК. Стабилизирует одноцепочечную мтДНК при репликации |
Снижение → дестабилизация мтДНК |
|
MT-RNR2 |
Митохондрии |
Кодирует 16S рРНК |
Снижение → подавление синтеза митохондриальных белков |
|
MGME1 |
Ядро/ митохондрии |
Эндонуклеаза репарации мтДНК, разрешает структуры flap мтДНК при репарации |
Противоречивая: гиперэкспрессия в G1/G2 → компенсация повреждений; гипоэкспрессия в G3 → коллапс мтДНК |
|
ATAD3 |
Ядро |
Регуляция стабильности мтДНК, ядерно-митохондриальный «якорь» для транспорта холестерина |
Поддержание базовых функций митохондрий |
|
TFAM |
Ядро |
Фактор транскрипции мтДНК |
Сохранение биогенеза мтДНК |
|
POLG |
Ядро |
ДНК-полимераза γ |
Репликация мтДНК |
Примечание: составлено авторами на основе источников [3; 4; 9], а также результатов биоинформационного анализа.
Показатель копийности данных генетических локусов был валидирован методом ПЦР-РВ на образцах ДНК из тканей 71 пациентки с аденокарциномой тела матки.
У пациенток с аденокарциномой G1 без СД2 наблюдалось статистически значимое (p<0.005) снижение копийности мтДНК-связанных генов (MT-CO1=0.6, mtTFB=0.5, mtSSB=0.6, MT-RNR2=0.5), снижение NRF1(0.5) и повышение MGME1 (2.5) относительно условно-нормальной ткани. У пациенток с аденокарциномой G1 и СД2 наблюдалось статистически значимое (p<0.05) более выраженное снижение копийности мтДНК-связанных генов (MT-CO1=0.5, mtTFB=0.5, mtSSB=0.4, MT-RNR2=0.3) и ядерных генов NRF1(0.5) и TFAM (1.6) относительно условно-нормальной ткани (рис. 1). При этом следует отметить, что в группах пациенток с сахарным диабетом и без статистически значимо (p<0.05) отличалась копийность 2 генов: копийность TFAM и NRF1 была в 2,5 раза меньше у пациенток с сахарным диабетом (рис. 1).
У пациенток с аденокарциномой G2 без СД2 наблюдалась схожая картина с G1: статистически значимое (p<0.005) снижение копийности мтДНК-генов (MT-CO1=0.7, mtTFB=0.7, MT-RNR2=0.6), кроме mtSSB (1.4 - ближе к норме) и NRF1(0.5). Кроме этого, наблюдалось статистически значимое (p<0.005) повышение копийности MGME1 (2.9). У пациенток с аденокарциномой G2 и СД2 наблюдалось статистически значимое (p<0.005) более выраженное снижение копийности мтДНК-генов (MT-CO1=0.4, mtTFB=0.3, mtSSB = 0,6, MT-RNR2=0.3). Также наблюдалось статистически значимое (p<0.005) снижение копийности ядерных генов - TFAM и TOP1MT в 2 раза и NRF1 в 5 раз относительно условно-нормальной ткани (рис. 2).
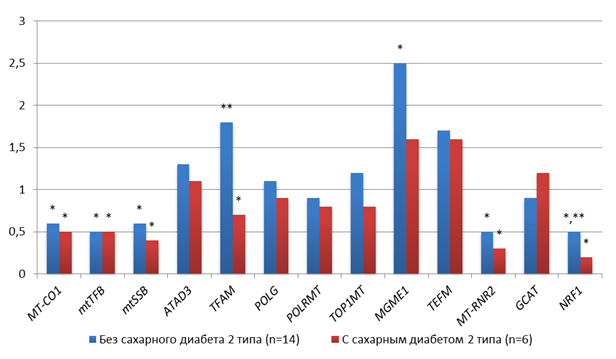
Рис. 1. Особенности копийности генов в тканях пациенток с аденокарциномой G1 с СД2 и без; * - статистически значимое отличие от условно-здоровой ткани, ** - статистически значимое отличие от пациентов с сахарным диабетом
Источник: составлено авторами по результатам данного исследования.
При этом следует отметить, что в группах пациенток с сахарным диабетом и без статистически значимо (p<0.05) отличалась копийность 7 генов: у пациенток с сахарным диабетом копийность TFAM была в 3,2 раза меньше, MT-CO1 в 1,8 раза меньше, mtTFB в 2,3 раза меньше, mtSSB в 2,3 раза меньше, TOP1MT в 1,8 раза меньше, MT-RNR2 в 2 раза меньше и NRF1 в 2,5 раза меньше, чем у пациенток без сахарного диабета (рис. 2).
У пациенток с аденокарциномой G3 без СД2 наблюдалось снижение копийности mtSSB и MT-RNR2 в 5 и 2.5 раза соответственно относительно условно-нормальной ткани (p<0.005), а также снижение копийности MGME1 в 1.4 раза (p<0.005), что противоположно результатам при G1/G2. У пациенток с аденокарциномой G3 и СД2 наблюдалось снижение копийности MT-CO1, mtTFB, mtSSB, MT-RNR2, NRF1, TFAM, TOP1MT и MGME1 в 2.5 раза, 3.3 раза, 5.0 раз, 3.3 раза, 1.7 раза, 1.7 раза и 5.0 раз соответственно относительно условно-нормальной ткани (p<0.005) (рис. 3). При этом следует отметить, что в группах пациенток с сахарным диабетом и без статистически значимо (p<0.05) также отличалась копийность 7 генов: у пациенток с сахарным диабетом копийность TFAM была в 2,5 раза меньше, MT-CO1 в 2,3 раза меньше, mtTFB в 4,0 раза меньше, TOP1MT в 2,2 раза меньше, MT-RNR2 в 2 раза меньше, NRF1 в 2,7 раза меньше и MGME1 в 3,5 раза меньше, чем у пациенток без сахарного диабета (рис. 3).
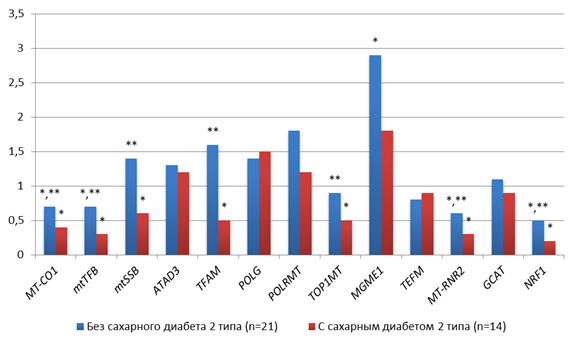
Рис. 2. Особенности копийности генов в тканях пациенток с аденокарциномой G2 с СД2 и без; * - статистически значимое отличие от условно-здоровой ткани, ** - статистически значимое отличие от пациентов с сахарным диабетом
Источник: составлено авторами по результатам данного исследования.
При всех трех степенях дифференцировки РТМ наблюдалось статистически значимое снижение копийности ряда митохондриальных и ядерных (ассоциированных с регуляцией митохондрий) генов (табл. 2). Следует отметить, что увеличение числа негативных аномалий копийности генов у пациенток с РТМ было выражено значительно сильнее при наличии СД2 типа и снижении степени дифференцировки клеток. Наиболее выраженные изменения отмечались для генов: MT-CO1: снижение на 16,7-55,6%, TFAM: снижение на 60,0-68,8%, NRF1: снижение на 60,0-62,5%.
На основе регрессионного анализа были построены уравнения, описывающие влияние СД2 на копийность генов, например: для гена TFAM в группе G1: Y = 1,8 - 1,1·X; для гена MT-CO1 в группе G2: Y = 0,7 - 0,3·X; для гена NRF1 в группе G3: Y = 0,8 - 0,5·X. Эти уравнения показывают, что наличие СД2 ассоциировано со снижением копийности данных генов на 0,3-1,1 условной единицы. Полученные результаты демонстрируют значительное влияние СД2 на копийность генов, отвечающих за функционирование митохондрий у пациенток с РТМ. Это согласуется с известными данными о том, что CNV могут влиять на экспрессию генов и способствовать развитию заболеваний [5]. Наиболее выраженные изменения выявлены при G2 и G3, что может указывать на Grade-специфичное влияние СД2 на митохондриальную дисфункцию при онкологических заболеваниях и может свидетельствовать о различной чувствительности пациентов к метаболическим нарушениям, ассоциированным с СД2 [15; 16].
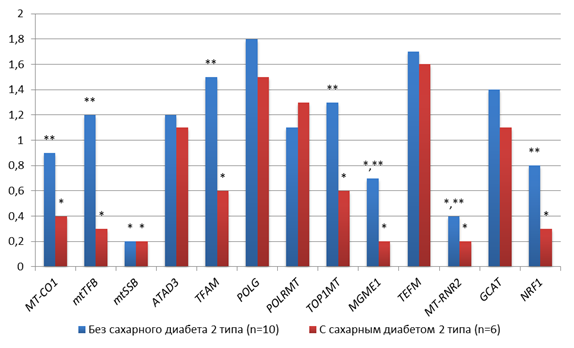
Рис. 3. Особенности копийности генов в тканях пациенток с аденокарциномой G3 с СД2 и без; * - статистически значимое отличие от условно-здоровой ткани, ** - статистически значимое отличие от пациентов с сахарным диабетом
Источник: составлено авторами по результатам данного исследования.
Таблица 2
Изменение копийности генов у пациенток с РТМ в зависимости от наличия СД2
|
Ген |
Группа |
Без СД2 |
С СД2 |
Изменение (%) |
p-value |
|
MT-CO1 |
G1 |
0,6* |
0,5* |
-16,7 |
0,045 |
|
MT-CO1 |
G2 |
0,7* |
0,4* |
-42,9 |
0,003 |
|
MT-CO1 |
G3 |
0,9* |
0,4* |
-55,6 |
0,001 |
|
TFAM |
G1 |
1,8* |
0,7* |
-61,1 |
0,002 |
|
TFAM |
G2 |
1,6* |
0,5* |
-68,8 |
0,001 |
|
TFAM |
G3 |
1,5* |
0,6* |
-60,0 |
0,004 |
|
NRF1 |
G1 |
0,5*,** |
0,2* |
-60,0 |
0,002 |
|
NRF1 |
G2 |
0,5*,** |
0,2* |
-60,0 |
0,001 |
|
NRF1 |
G3 |
0,8** |
0,3* |
-62,5 |
0,002 |
Источник: составлено авторами на основе полученных данных в ходе исследования.
Снижение копийности гена TFAM, играющего ключевую роль в репликации и транскрипции митохондриальной ДНК, может объяснять нарушение энергетического метаболизма в опухолевых клетках при сопутствующем СД2 [4; 9]. Аналогичные изменения копийности MT-CO1, кодирующего ключевой фермент дыхательной цепи, могут приводить к нарушению окислительного фосфорилирования и усилению гликолиза (эффект Варбурга) [3; 17]. Особого внимания заслуживает снижение копийности гена NRF1, который регулирует экспрессию ядерных генов, кодирующих митохондриальные белки. Это может приводить к дисбалансу в синтезе субъединиц электронтранспортной цепи и дальнейшему ухудшению функции митохондрий [9]. Метод qPCR, использованный в исследовании, является надежным инструментом для определения относительной копийности генов, однако он имеет ограничения, связанные с возможностью изучать небольшое количество локусов одновременно. В дальнейшем для более масштабного анализа CNV могут быть применены методы высокопроизводительного секвенирования [18].
Выявленные закономерности согласуются с данными литературы о том, что СД2 ассоциирован с более агрессивным течением РТМ и худшим ответом на терапию [11; 19]. Полученные данные подчеркивают важность учета коморбидного фона при выборе тактики лечения пациенток с РТМ [1].
Заключение
Наличие СД2 у пациенток с РТМ ассоциировано со статистически значимым снижением копийности генов, регулирующих функционирование митохондрий (MT-CO1, TFAM, NRF1). Наиболее выраженные изменения наблюдаются при степени дифференцировки опухолевых клеток G2 и G3. Построенные регрессионные модели количественно описывают ассоциацию СД2 с аномальной копийностью ядерных и митохондриальных генов и могут быть использованы для прогнозирования молекулярных последствий коморбидной патологии. Полученные данные обосновывают необходимость разработки персонализированных подходов к терапии РТМ с учетом метаболического статуса пациенток.
Перспективным направлением дальнейших исследований является изучение влияния выявленных изменений копийности генов на эффективность различных вариантов терапии РТМ, а также оценка возможности коррекции митохондриальной дисфункции как потенциального терапевтического подхода. Кроме того, перспективным является анализ CNV в циркулирующей ДНК плазмы крови как малоинвазивного биомаркера.



