Введение
Острая декомпенсация хронической сердечной недостаточности (ОДСН) представляет собой значимую медицинскую проблему, обусловленную высокой частотой госпитализаций и неблагоприятным прогнозом [1–3]. Внутрибольничная летальность при ОДСН составляет 5 %, но в течение первого года после выписки она превышает 30 % [1]. Повторные госпитализации у данной категории пациентов встречаются почти в 70 % случаев в первый год после выписки [1], достигая 80 % в течение двух лет [4]. Помимо высокой степени летальности и повторных госпитализаций эпизоды ОДСН также снижают качество жизни пациентов [5, 6].
Одним из важных факторов, влияющих на прогноз при ОДСН, выступают инфекционные осложнения, которые существенно увеличивают риск неблагоприятных исходов [7, 8]. Так, респираторные инфекции зачастую являются триггерами острой декомпенсации, определяя до 15 % госпитализаций по поводу ОДСН, приводят к усилению воспалительного ответа, дестабилизации гемодинамики, развитию полиорганной недостаточности и увеличению летальности [8–10].
По данным литературы, инфекционные осложнения дополнительно возникают у 9 % пациентов с ОДСН [11]. В половине новых случаев в качестве осложнения выступают респираторные инфекции, в 30 % – мочевыводящих путей, на долю остальных же локализаций суммарно приходится около 15 % [11]. Тем не менее, несмотря на распространенность данного осложнения и сложность лечения данной когорты пациентов [11], в настоящее время не существует критериев, позволяющих прогнозировать развитие инфекционных осложнений у больных с ОДСН.
Таким образом,целью настоящего исследованияявилось выявление независимых предикторов и разработка прогностической модели оценки риска развития инфекционных осложнений у пациентов, госпитализированных по поводу острой декомпенсации сердечной недостаточности.
Материалы и методы исследования
Дизайн исследования и популяция
Было проведено пилотноепроспективное одноцентровое когортное исследование факторов риска развития инфекционных осложнений у пациентов, госпитализированных в ОРИТ с острой декомпенсацией сердечной недостаточности.
Работа выполнена на базе отделения реанимации и интенсивной терапии для кардиологических больных ГБУЗ «ГКБ им. В.В. Виноградова ДЗМ» (выписка заседания локального этического комитета № 4/1 от 17.06.2021). Набор пациентов осуществлялся в период с2021 по 2023 г.
В исследование включались пациенты старше 18 лет, госпитализированные в ОРИТ с диагнозом ОДСН и подписавшие добровольное информированное согласие. Пациенты с наличием инфекции в качестве ведущего триггера ОДСН исключались из анализа.
В ходе исследования проводился сбор данных, охватывающих клинико-демографические, лабораторные и инструментальные данные, а также результаты физикального осмотра на момент поступления. Также был проведен анализ исходов госпитализации пациентов с развившимися инфекционными осложнениями и без них.
Статистический анализ
Количественные данные представлены медианой и интерквартильным интервалом (Me [Q1; Q3]), качественные – абсолютными и относительными частотами. Категориальные переменные представлены в виде абсолютных чисел и процентов (n; %). Сравнение групп по непрерывным признакам проводилось с использованием U-критерия Манна – Уитни, а для категориальных данных применялся точный критерий Фишера.
Параметры, статистически значимо различавшиеся между группами, были включены в многофакторный логистический регрессионный анализ обратным методом Вальда для выявления независимых предикторов развития инфекционных осложнений. Результаты регрессии представлены как отношения шансов (ОШ) с 95 % доверительным интервалом (ДИ); на основе модели построена номограмма для индивидуальной оценки риска.
Для определения пороговых значений количественных параметров и оценки дискриминативной способности модели использовался ROC-анализ; оптимальные точки отсечения определялись по индексу Юдена (максимизация суммы чувствительности и специфичности).
Статистическая значимость устанавливалась при двустороннем уровне p < 0,05.
Анализ был выполнен в IBM SPSS Statistics v.27.0 и Stata v.18.0.
Результаты исследования и их обсуждение
Проведен скрининг 140 пациентов, из которых для 15 инфекция выступала в качестве триггера ОДСН. В анализ включено 125 больных (рис. 1).
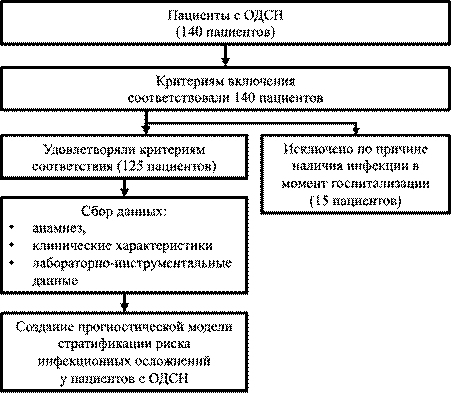
Рис. 1. Блок-схема исследования.
Источник: составлено авторами
У 56 пациентов (44,8 %) в течение госпитализации были диагностированы инфекционные осложнения (основная группа), 69 (55,2 %) перенесли период декомпенсации без инфекционных осложнений (группа сравнения). Пациенты основной группы были моложе (р = 0,039), чаще имели в структуре сопутствующих заболеваний хроническую обструктивную болезнь легких (ХОБЛ) и/или бронхиальную астму (БА) (р = 0,004), характеризовались более тяжелой сердечной недостаточностью (р = 0,027) (табл. 1).
Таблица 1
Клинико-демографическая характеристика и данные анамнеза пациентов с ОДСН
|
Инфекционные осложнения за период госпитализации |
р-значение |
||
|
Нет N = 69 |
Да N = 56 |
||
|
Клинико-демографическая характеристика |
|||
|
Пол, муж |
33 (47,8 %) |
30 (53,6 %) |
0,591 |
|
Возраст, лет |
76 [71; 84] |
70 [61; 83] |
0,039 |
|
ИМТ |
30,9 [26,3; 35,4] |
30,8 [25,8; 38,2] |
0,772 |
|
ИБС |
41 (59,4 %) |
30 (54,5 %) |
0,715 |
|
ПИКС |
35 (50,7 %) |
22 (40,0 %) |
0,278 |
|
Сопутствующие заболевания |
|||
|
Гипертоническая болезнь |
69 (100,0 %) |
56 (100,0 %) |
>0,9 |
|
Сахарный диабет |
33 (47,8 %) |
25 (44,6 %) |
0,266 |
|
ХБП |
22 (31,9 %) |
23 (41,1 %) |
0,350 |
|
ХОБЛ/БА |
8 (11,6 %) |
19 (33,9 %) |
0,004 |
|
ОНМК в анамнезе |
12 (17,4 %) |
11 (19,6 %) |
0,818 |
|
Онкология |
20 (17,5 %) |
4 (16,0 %) |
>0,9 |
|
Этиология ХСН |
|||
|
АГ |
30 (43,5 %) |
23 (41,1 %) |
>0,9 |
|
ИБС |
28 (40,6 %) |
23 (41,1 %) |
0,854 |
|
Кардиомиопатия |
7 (10,1 %) |
5 (8,9 %) |
>0,9 |
|
Клапанные пороки сердца |
2 (2,9 %) |
2 (3,6 %) |
>0,9 |
|
Аритмия |
1 (1,5 %) |
0 (0,0 %) |
>0,9 |
|
Функциональный класс ХСН (NYHA) |
|||
|
II |
9 (13,0 %) |
4 (7,1 %) |
0,383 |
|
III |
27 (39,1 %) |
13 (23,2 %) |
0,082 |
|
IV |
32 (46,4 %) |
37 (66,1 %) |
0,027 |
|
Ведущий триггер ОДСН |
|||
|
Артериальная гипертензия |
45 (65,2 %) |
35 (62,5 %) |
0,852 |
|
Аритмия |
10 (14,5 %) |
5 (8,9 %) |
0,414 |
|
Низкая приверженность к терапии |
8 (11,6 %) |
5 (8,9 %) |
0,771 |
|
Прогрессирование сопутствующего заболевания |
6 (8,7 %) |
9 (16,1 %) |
0,778 |
|
Нарушение диеты |
0 (0,0 %) |
2 (3,6 %) |
0,199 |
Примечание. Количественные данные представлены в виде Me [IQR], где Me – медиана, IQR – интерквартильный интервал. Качественные данные представлены в виде абсолютных и относительных частот.
АГ – артериальная гипертензия; ИМТ – индекс массы тела; ОДСН – острая декомпенсация сердечной недостаточности; NYHA – классификация выраженности хронической сердечной недостаточности Нью-Йоркской кардиологической ассоциации (New York Heart Association); АГ – артериальная гипертензия; ИБС – ишемическая болезнь сердца; ОНМК – острое нарушение мозгового кровообращения; ПИКС – постинфарктный кардиосклероз; ХБП – хроническая болезнь почек; ХОБЛ/БА – хроническая обструктивная болезнь легких / бронхиальная астма; ХСН – хроническая сердечная недостаточность.
Источник: составлено авторами на основе полученных данных в ходе исследования.
Другие клинико-демографические и анамнестические данные, структура триггеров ОДСН, а также результаты инструментальных исследований были сопоставимы между группами (табл. 1, 2).
Таблица 2
Результаты физикального осмотра и инструментальных исследований при поступлении пациентов с ОДСН
|
Параметр |
Инфекционные осложнения за период госпитализации |
р-значение |
||
|
Нет N = 69 |
Да N = 56 |
|||
|
Физикальный осмотр |
||||
|
САД, мм рт. ст. |
131 [106; 156] |
138 [120; 157] |
0,476 |
|
|
ЧСС, уд/мин |
90 [74; 110] |
94 [82; 117] |
0,127 |
|
|
Одышка |
При нагрузке |
25 (36,8 %) |
12 (22,6 %) |
0,114 |
|
В покое |
37 (54,4 %) |
41 (77,4 %) |
0,013 |
|
|
Хрипы в легких |
Нижние отделы |
47 (68,1 %) |
43 (76,8 %) |
0,321 |
|
До уровня лопаток |
4 (5,8 %) |
1 (1,8 %) |
0,379 |
|
|
Над всей поверхностью легких |
7 (10,1 %) |
8 (14,3 %) |
0,583 |
|
|
Акроцианоз |
17 (24,6 %) |
25 (44,6 %) |
0,023 |
|
|
Асцит |
11 (15,9 %) |
10 (17,9 %) |
0,813 |
|
|
Отечность |
Пастозность |
10 (14,5 %) |
5 (8,9 %) |
0,414 |
|
Отеки |
37 (53,6 %) |
32 (57,1 %) |
0,721 |
|
|
Анасарка |
12 (17,4 %) |
13 (23,2 %) |
0,502 |
|
|
Положение в постели |
Горизонтальное |
3 (4,3 %) |
1 (1,8 %) |
0,627 |
|
Низкое положение Фаулера |
30 (43,5 %) |
17 (30,4 %) |
0,143 |
|
|
Сидячее |
21 (30,4 %) |
33 (58,9 %) |
0,002 |
|
|
Инструментальные исследования |
||||
|
SpO2, % |
95 [91; 97] |
94 [90; 96] |
0,423 |
|
|
ФВ ЛЖ, % |
47 [30; 55] |
45 [28; 55] |
0,702 |
|
|
ФП/ТП |
30 (44,1 %) |
30 (53,6 %) |
0,367 |
|
|
Стеноз АК |
8 (14,8 %) |
7 (17,5 %) |
0,780 |
|
|
СДЛА, мм рт. ст |
53 [35; 63] |
55 [40; 64] |
0,581 |
|
|
Диаметр НПВ, см |
2,4 [2,1; 2,7] |
2,5 [2,3; 2,6] |
0,548 |
|
|
РГ ОГК: застой |
59 (86,8 %) |
53 (94,6 %) |
0,222 |
|
|
РГ ОГК: гидроторакс |
Односторонний |
17 (25,0 %) |
10 (17,9 %) |
0,387 |
|
Двусторонний |
22 (32,4 %) |
23 (41,1 %) |
0,352 |
|
|
УЗИ легких, В-линии |
18 [15; 20] |
32 [24; 33] |
0,065 |
|
Примечание. Количественные данные представлены в виде Me [IQR], где Me – медиана, IQR – интерквартильный интервал. Качественные данные представлены в виде абсолютных и относительных частот.
САД – систолическое артериальное давление; ЧСС – частота сердечных сокращений; SpO2 – насыщение кислородом крови (сатурация (пульсоксиметр)); АК – аортальный клапан; РГ ОГК – рентгенография органов грудной клетки; СДЛА – среднее давление в легочной артерии; УЗИ – ультразвуковое исследование; ФВ ЛЖ – фракция выброса левого желудочка; ФП/ТП – фибрилляция предсердий / трепетание предсердий.
Источник: составлено авторами на основе полученных данных в ходе исследования.
Пациенты, у которых в процессе госпитализации развились инфекционные осложнения, при поступлении имели более высокий уровень С-реактивного белка (СРБ) (медиана 34,7 мг/л против 11,28 мг/л, p < 0,001) и лейкоцитов (медиана 10,05×10^9/л против 8,28×10^9/л, p = 0,002). Дополнительно у обсуждаемой группы больных были выше значения АЛТ (р = 0,010) и ЛДГ (р = 0,002), а также более низкий уровень железа (р = 0,006) (табл. 3).
Таблица 3
Лабораторные показатели пациентов с ОДСН
|
Параметр |
Инфекционные осложнения за период госпитализации |
р-значение |
|
|
Нет N = 69 |
Да N = 56 |
||
|
Эритроциты, 10^12/л |
4,23 [3,80; 4,63] |
4,41 [3,82; 5,00] |
0,264 |
|
Гемоглобин, г/л |
121 [107; 137] |
120 [101; 140] |
0,855 |
|
Гематокрит, % |
36,6 [32,8; 40,9] |
36,0 [30,3; 41,8] |
0,962 |
|
Лейкоциты, 10^12/л |
8,28 [6,22; 10,57] |
10,05 [7,62; 15,30] |
0,002 |
|
Креатинин, мкмоль/л |
113,2 [88,9; 139,8] |
122,2 [98,2; 162,4] |
0,146 |
|
Мочевина, ммоль/л |
9,9 [7,0; 12,7] |
11,6 [8,0; 16,0] |
0,063 |
|
СКФ, мл/мин/1,73м2 |
44,62 [35,74; 61,86] |
43,05 [28,50; 61,91] |
0,599 |
|
Калий, ммоль/л |
4,25 [3,88; 4,66] |
4,41 [3,92; 4,80] |
0,382 |
|
Натрий, ммоль/л |
141,00 [136,95; 143,56] |
141,00 [135,64; 144,54] |
0,973 |
|
Общий билирубин, мкмоль/л |
17,20 [9,28; 30,51] |
17,59 [8,73; 27,50] |
0,498 |
|
Прямой билирубин, мкмоль/л |
4,37 [2,44; 8,68] |
3,88 [2,23; 10,17] |
0,853 |
|
АЛТ, Е/л |
17,3 [12,4; 32,2] |
28,6 [16,0; 54,1] |
0,010 |
|
АСТ, Е/л |
23,4 [19,9; 42,5] |
31,3 [21,9; 62,5] |
0,079 |
|
ЛДГ, Е/л |
249,5 [212,5; 325,5] |
321,0 [246,0; 467,0] |
0,002 |
|
Щелочная фосфатаза, Е/л |
94,0 [75,5; 129,8] |
92,2 [80,9; 125,0] |
0,584 |
|
СРБ, мг/л |
11,28 [6,51; 25,45] |
34,70 [14,70; 88,12] |
<0,001 |
|
Общий белок, г/л |
67,69 [61,90; 69,30] |
66,77 [60,51; 71,95] |
0,673 |
|
Альбумин, г/л |
33,51 [29,67; 38,06] |
31,49 [28,40; 34,80] |
0,138 |
|
Глюкоза, ммоль/л, |
6,36 [5,23; 8,59] |
7,11 [5,74; 10,38] |
0,127 |
|
Холестерин, ммоль/л |
3,41 [2,87; 4,56] |
3,59 [2,85; 4,60] |
0,869 |
|
Железо, мкмоль/л |
5,4 [3,9; 9,4] |
4,1 [2,5; 6,7] |
0,006 |
|
Тропонин I, нг/мл |
0,039 [0,017; 0,115] |
0,047 [0,031; 0,111] |
0,390 |
|
NT-proBNP, пг/мл |
841,7 [188,7; 1728,9] |
1162,4 [261,2; 1887,0] |
0,578 |
|
Д-димер, нг/мл |
477 [255; 1074] |
754 [339; 1759] |
0,106 |
|
МНО, МЕ/мл |
1,38 [1,21; 1,65] |
1,38 [1,22; 1,73] |
0,954 |
Примечание. Количественные данные представлены в виде Me [IQR], где Me – медиана, IQR – интерквартильный интервал.
NT-proBNP – натрийуретический пептид (N-terminal pro-B-type natriuretic peptide); АЛТ – аланинаминотрансфераза; АСТ – аспартатаминотрансфераза; ДИ – доверительный интервал; ЛДГ – лактатдегидрогеназа; МНО – международное нормализованное отношение; СКФ – скорость клубочковой фильтрации; СРБ – С-реактивный белок.
Источник: составлено авторами на основе полученных данных в ходе исследования.
Летальность среди пациентов с инфекционными осложнениями составила 23,2 % против 7,2 % в группе без инфекций (р = 0,019). Длительность пребывания в ОРИТ (р = 0,019) и стационаре (р = 0,004), а также частота использования НИВЛ (р = 0,005) и ИВЛ (р = 0,022) были также выше в группе больных с инфекцией (табл. 4).
Таблица 4
Особенности течения периода госпитализации пациентов с ОДСН
|
Параметр |
Инфекционные осложнения за период госпитализации |
р-значение |
|
|
Нет N = 69 |
Да N = 56 |
||
|
Длительность пребывания в ОРИТ, дни |
3 [2; 3] |
3 [2; 6] |
0,019 |
|
Длительность госпитализации в стационаре, дни |
8 [6; 10] |
10 [8; 14] |
0,004 |
|
ОПП |
4 (5,9%) |
6 (11,3%) |
0,331 |
|
Гемодинамическая поддержка |
9 (13,0%) |
12 (21,4%) |
0,237 |
|
Смерть от любых причин |
5 (7,2%) |
13 (23,2%) |
0,019 |
|
Респираторная поддержка |
|||
|
НПО |
59 (85,5%) |
50 (89,3%) |
0,599 |
|
ВПО |
4 (5,8%) |
9 (16,1%) |
0,079 |
|
НИВЛ |
3 (4,3%) |
12 (21,4%) |
0,005 |
|
ИВЛ |
1 (1,4%) |
7 (12,5%) |
0,022 |
Примечание. Количественные данные представлены в виде Me [IQR], где Me – медиана, IQR – интерквартильный интервал.
ВПО – высокопоточная оксигенотерапия; ДИ – доверительный интервал; ИВЛ – искусственная вентиляция легких; НИВЛ – неинвазивная вентиляция легких; НПО – низкопоточная оксигенотерапия; ОПП – острое повреждение почек; ОРИТ – отделение реанимации и интенсивной терапии.
Источник: составлено авторами на основе полученных данных в ходе исследования.
Независимыми факторами риска развития инфекционных осложнений у пациентов с ОДСН являлись: возраст ≥ 71 года (ОШ = 5,28, 95 % ДИ 1,68–16,64; p = 0,004), наличие ХОБЛ/БА в анамнезе (ОШ = 7,21, 95 % ДИ 1,59–32,74; p = 0,010), уровень СРБ > 11,62 мг/л (ОШ = 7,59, 95 % ДИ 2,27–25,32; p = 0,001) и лейкоцитов > 9,49 ×10⁹/л (ОШ = 3,30, 95 % ДИ 1,12–9,71; p = 0,030) при поступлении. Наличие акроцианоза при поступлении (ОШ = 2,94, 95 % ДИ 0,98–8,82; p = 0,054) не достигло статистической значимости, но учитывается моделью при стратификации риска (рис. 2).
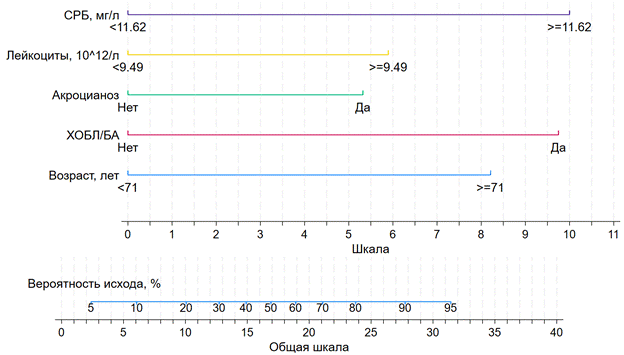
Рис. 2. Номограмма прогнозирования возникновения инфекции. СРБ – С-реактивный белок; ХОБЛ/БА – хроническая обструктивная болезнь легких / бронхиальная астма.
Источник: составлено авторами по результатам данного исследования
Показатель AUROC номограммы составил 0,87 (0,80; 0,94), чувствительность – 77 % (62; 88), специфичность – 86 % (73; 94), точность – 81 % (72; 89). Точка отсечения составила 17 баллов с ОР 4,11 (2,39; 7,08) (рис. 3).
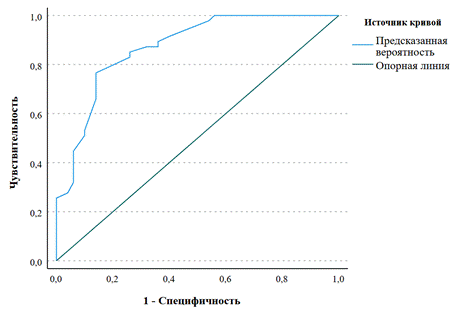
Рис. 3. ROC-кривая для модели прогнозирования инфекции.
Источник: составлено авторами по результатам данного исследования
Проведено одноцентровое проспективное когортное исследование предикторов инфекционных осложнений с участием 125 пациентов, госпитализированных в ОРИТ с ОДСН, среди которых данный исход возник в 44,8 % случаев. Частота потребности в проведении инвазивной ИВЛ в данной группе пациентов составила 12,5 % при летальности 23,2 % с медианной длительностью пребывания в ОРИТ равной трем суткам.
Основные результаты
По результатам проведенного исследования выявлены следующие независимые факторы риска развития инфекционных осложнений у пациентов с ОДСН: возраст ≥ 71 года (p = 0,004), наличие ХОБЛ/БА в анамнезе (p = 0,010), уровень СРБ > 11,62 мг/л (p = 0,001) и лейкоцитов > 9,49 ×10⁹/л (p = 0,030) при поступлении. На основании представленных предикторов разработана модель стратификации риска развития инфекционных осложнений, дополнительно включающая оценку наличия/отсутствия акроцианоза. Показатель прогностической ценности номограммы AUROC составил 0,87, что позволяет классифицировать модель как отличную [12]. Точка отсечения составила 17 баллов, чувствительность – 77 %, специфичность – 86 % и точность – 81 %. В случае превышения пациентом указанного порогового значения риск развития инфекционных осложнений возрастает более чем в 4 раза.
Связь с предыдущими исследованиями
Результаты проведенного исследования согласуются с данными мировой литературы относительно ухудшения краткосрочных исходов госпитализации пациентов с ОДСН при развитии инфекционных осложнений [13].
Так, в работе M. Polovina et al. (2023) было показано двукратное увеличение летальности и потребности в проведении ИВЛ у пациентов с ОСН при развития нозокомиальной пневмонии [14]. Дополнительно было отмечено увеличение длительности госпитализации данной группы больных. Представленные данные соответствуют полученным в авторском исследовании, что частично подтверждает внутреннюю валидность проведенного исследования и воспроизводимость результата. Тем не менее структура независимых факторов риска представляется отличной от выявленной в авторской работе. Вероятной причиной значительных несоответствий спектра предикторов является высокая гетерогенность изучаемой популяции в работе M. Polovina et al. (2023) вследствие отсутствия учета фенотипов ОСН. Напротив, разработанная авторами модель характеризуется фенотип-специфичностью, сформирована с использованием данных когорты пациентов с ОДСН, что и обосновывает ее высокую прогностическую ценность.
Исследование A. Jobs et al. (2018), направленное на изучение предикторов развития нозокомиальной пневмонии у пациентов с ОДСН, также согласуется с полученными в данном исследовании результатами [15]. В частности, авторы продемонстрировали смещение медианы длительности госпитализации с 8 до 10 дней при развитии инфекционного осложнения, а также определили ХОБЛ в качестве независимого фактора риска. Более того, в указанной группе больных отмечается двукратный рост частоты летального исхода, что дополнительно подтверждает достоверность представленных в данной работе результатов. Стоит отметить, что в рамках обсуждаемой работы только 19 % пациентов потребовалась госпитализация в ОРИТ, что отличает выполненное авторами исследование и обосновывает различия в выявленных независимых предикторах развития инфекционных осложнений.
Результаты данного исследования особенно хорошо согласуются с работой A. Tada et al. (2020), в рамках которой старший возраст, более высокие значения лейкоцитов и СРБ являются независимыми факторами риска развития нозокомиальной пневмонии у пациентов с ОСН [16]. Увеличение летальности и длительности госпитализации в когорте пациентов из Японии также согласуется с представленными в статье результатами.
Таким образом, результаты исследования характеризуются высокой воспроизводимостью и сопоставимостью данных, что подтверждает их достоверность.
Значимость результатов исследования
Разработанная номограмма представляет собой фенотип-ориентированный подход для стратификации риска у когорты пациентов с острой декомпенсацией сердечной недостаточности. Инструмент основан на оценке доступных клинико-лабораторных параметров, что позволяет количественно оценить индивидуальную вероятность развития инфекционных осложнений. Его применение при поступлении способствует идентификации пациентов высокого риска, требующих расширения и интенсификации мониторинга, а также превентивных вмешательств, включая раннее начало эмпирической антибактериальной терапии и активную коррекцию гемодинамики. Более того, внедрение номограммы в клиническую практику может способствовать оптимизации маршрутизации, своевременной интенсификации терапии и улучшению прогноза за счет снижения частоты инфекционных осложнений и сокращения длительности госпитализации.
Сильные стороны и ограничения исследования
Ключевыми преимуществами настоящего исследования являются его проспективный дизайн, стандартизированный сбор данных и применение комплексного многофакторного анализа, что позволило минимизировать влияние вмешивающихся факторов. Внутренняя валидность работы обеспечена включением гомогенной когорты пациентов с единым фенотипом ОДСН, а также интеграцией данных клинического обследования, повысившей точность идентификации независимых предикторов. Вместе с тем исследование имеет ограничения, связанные с умеренным объемом выборки и отсутствием внешней валидации разработанной модели.
Дальнейшее направление исследований
Полученные результаты определяют ряд перспективных направлений для дальнейших исследований. Во-первых, необходимо проведение валидации разработанной модели прогнозирования риска развития инфекционных осложнений у пациентов с ОДСН на независимых когортах [17]. Во-вторых, с учетом полученных ранее данных о наличии различий в структуре независимых предикторов летального исхода между фенотипами острой сердечной недостаточности представляется обоснованной разработка и валидация специализированных прогностических моделей для других фенотипов ОСН, что позволит повысить точность стратификации риска в отдельных субпопуляциях пациентов. В-третьих, требуется дальнейшая оценка эффективности использования разработанной номограммы в рамках рандомизированных контролируемых исследований с целью определения влияния учета прогноза развития инфекционных осложнений в структуре системы принятия клинических решений на исходы лечения пациентов с ОДСН.
Вывод
Разработана номограмма отличного качества, позволяющая проводить стратификацию риска развития инфекционных осложнений у пациентов с ОДСН. Превышение порогового значения в 17 баллов соответствует четырехкратному увеличению вероятности развития инфекционных осложнений в данной группе пациентов.



