Введение
Бронхиальная астма (БА) – это мультифакториальное заболевание, для которого характерно длительное воспаление дыхательных путей, приводящее к нарушению функции внешнего дыхания на фоне изменения структуры тканей бронхов [1, 2]. В основе хронического воспаления при БА лежит взаимодействие не только клеточных элементов, но и регуляторных молекул и медиаторов, что определяет перестройку тканевого состава стенки бронхов, то есть «ремоделирование». Ключевые звенья патогенеза данного заболевания являются предметом интенсивного изучения в течение многих лет, однако остаются до конца не установленными по настоящее время. На сегодняшний день разработаны и используются различные экспериментальные модели БА, позволяющие сформировать хроническое воспаление стенки бронхов, одного из ключевых звеньев патогенеза заболевания [3–5].
Модели БА на животных ценны для детального изучения механизмов заболевания на разных стадиях, что может быть затруднительно при исследовании на людях.
В начале 1990-х гг. были созданы мышиные модели, позволяющие воспроизвести основные механизмы аллергического ответа при БА, такие как повышение уровня IgE, ремоделирование тканей дыхательных путей, гиперреактивность бронхов, эозинофилию [6]. При формировании модели БА мышам проводили сенсибилизацию одним из способов: внутрибрюшинно, подкожно, ингаляционно, интраназально. Вторичное попадание аллергена происходило аэрозольным, интраназальным или эндотрахеальным путем введения. Чаще всего использовались такие аллергены, как овальбумин и клещи домашней пыли, каждый из них приводил к интенсивному развитию воспаления [7–9]. Одним из наиболее часто повторяющихся протоколов была сенсибилизация животных с помощью двух (1 инъекция в день) интраперитонеальных инъекций подкожным введением 10 мкг овальбумина, разведенного в 0,5 мл раствора, содержащего 100 мг Al (OH3) интервалом 7–14 дней, а контрольное заражение аллергеном-виновником проводилось ингаляционно через 21 день, с использованием овальбумина 0,03 % в концентрации 0,8–1 мл / мин до появления симптомов бронхообструкции [10].
Для успешного формирования и поддержания хронического воспаления в тканях стенки бронхов в последние годы часто используются комбинированные модели формирования БА, что позволяет исследовать взаимодействие различных факторов, участвующих в ремоделировании дыхательных путей. Так, в работе J.Wang et al. показана успешная модель формирования БА у мышей, при которой на 1, 7 и 14-й дни мышей сенсибилизировали путем внутрибрюшинной инъекции 100 мкг овальбумина и 2,25 мг гидроксида алюминия (200 мкл на мышь), затем проводили ингаляционные введения овальбумина (100 мкг в 50 мкл на мышь) [11].
Интерес представляет работаOu G. et al., в которой показана модель мышиной астмы, вызванной овальбумином. На 1, 7 и 14-й дни всем мышам, кроме контрольной группы, внутрибрюшинно вводили по 0,2мл смеси, состоящей из 20мкг овальбумина и 0,2 мл изотонического раствора хлорида натрия. С 21-го по 28-й день этим мышам овальбумин вводили ингаляционно [12].
Таким образом, на сегодняшний день используются более эффективные комбинированные методики моделирования БА, при которых не требуется анестезия, но в то же время у животного формируется воспаление, близкое по признакам к воспалению в организме человека при бронхиальной астме [13, 14].
Также установлен ряд преимуществ использования для формирования БА не мышиной, а крысиной модели. Размер крысы позволяет получить достаточное количество материала для исследований, а ответные реакции иммунной системы у крыс при моделировании бронхиальной астмы более сходны с таковыми у человека, чем у мышей [15].
Принимая во внимание наличие разнообразия подходов и методов формирования сенсибилизации у экспериментальных животных, была поставлена цель определения наиболее эффективного и достоверного метода формирования модели БА у крыс.
Цель исследования – разработать методику формирования овальбумин-индуцированной бронхиальной астмы на крысах.
Материалы и методы исследования
Создание модели БА у крыс проводилось в течение 43 дней. Эксперимент выполнен на белых нелинейных крысах обоего пола (n = 30) со средней массой тела 220–250г, в половозрелом возрасте 3–4 месяца. Лабораторные животные росли и содержались в одинаковых условиях: в клетках по 5 особей в каждой, находились на стандартном рационе с использованием полноценных кормов для грызунов при свободном доступе к воде. Температура окружающего воздуха поддерживалась на уровне 20–25 °С при относительной влажности 60–65 %. В качестве подстила использовались древесные опилки, прошедшие предварительную УФ-стерилизацию.
Все исследования выполнялись в соответствии с международными и российскими требованиями проведения научных исследований на лабораторных животных [16], а также одобрены локальным этическим комитетом ФГБОУ ВО «Ростовский государственный медицинский университет».
Животные были разделены на две группы:
контрольная группа (n = 15), в нее включили интактных животных, без формирования БА;
основная группа – модель БА (n = 15), для сенсибилизации животным этой группы на 1-й и 7-й день эксперимента внутрибрюшинно вводился раствор овальбумина (в дозе 1,7 мг/крыса) и гидроокиси алюминия в соотношении 1:100 (рис. 1).
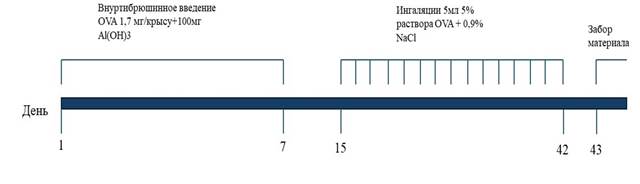
Рис. 1. Схема экспериментального протокола моделирования бронхиальной астмы у крыс. Источник: составлено авторами по результатам данного исследования
Начиная с 15-го дня исследования животным проводили ингаляцию 5 % раствором овальбумина в течение 28 дней. Овальбумин доставлялся в верхние дыхательные пути в форме аэрозоля с помощью компрессорного небулайзера (Omron CompAir NE-C28-E). Продолжительность ингаляционного введения препарата составляла от 5 до 10 мин (рис. 2).

Рис. 2. Ингаляционное введение овальбумина экспериментальным животным основной группы. Источник: фото представлено авторами по результатам данного исследования
У всех животных основной группы, начиная с 15-го дня исследования, отмечались такие клинические проявления, как увеличение частоты дыхания, хрипы в легких, чихание.
Выведение всех включенных в эксперимент животных проводилось на 43-и сутки эксперимента, с последующим получением биологического материала (ткани бронхов) крыс.
Для изучения изменений в дыхательных путях, в соответствии со всеми протоколами, собирали образцы патологического материала – фрагменты ткани из средней трети бронхов правого легкого каждого животного размером 2–3 мм², толщиной 5–7 мм. После фиксации в формалине легкие подвергали дегидратации путем обработки спиртами, далее образцы заливали в парафин.
Из парафиновых блоков изготавливали срезы легких толщиной 4–6 мкм. Полученные микропрепараты окрашивали гематоксилином и эозином, с последующим исследованием методом световой микроскопии.
Статистическую обработку проводили с помощью пакетов прикладных программ Microsoft Office Excel 2019 (Microsoft, США) и Statistica 12.0 (StatSoft Inc., США). Для характеристики индивидуальной вариабельности клеточного состава проведены расчеты количественного содержания клеток в сегментарных бронхах при изучении микропрепаратов под увеличением х400 на площади 1 см2. При описании результаты приведены как M±m, где М – среднее арифметическое, m – стандартная ошибка среднего. Нормальность распределения проверялась с использованием критериев Колмогорова – Смирнова и Шапиро – Уилка. В случаях, когда распределение признаков соответствовало нормальному, для анализа применялся параметрический метод – t-критерий Стьюдента, при отличном от нормального распределении – критерий Манна – Уитни. Статистически значимыми считались различия при уровне p < 0,05.
Результаты исследования и их обсуждение
При визуальном анализе полученных макропрепаратов отмечалось увеличение размера легких за счет вздутия на фоне выраженного эмфизематозного изменения тканей. Легкие имели неоднородную (мягкую и пушистую) консистенцию, после вскрытия не спадались за счет нарушения эластических структур. Цвет легочной ткани имел серый оттенок, края полупрозрачны, не имели четкой границы. На разрезе отмечалось утолщение стенки бронхов, в просвете которых выявлено скопление вязкой слизи. Таким образом, при оценке макропрепаратов животных основной группы были установлены явные признаки изменения структуры тканей, характерные для БА (рис. 3), которые отсутствовали у крыс контрольной группы (рис. 4).
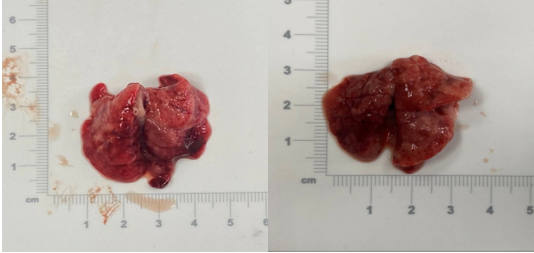
Рис. 3. Макропрепарат легких крыс основной группы.
Источник: фото представлено авторами по результатам данного исследования
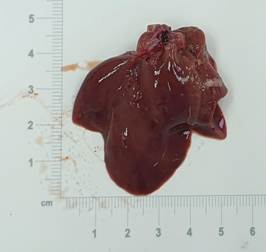
Рис. 4. Макропрепарат легких крыс контрольной группы.
Источник: фото представлено авторами по результатам данного исследования
Гистологический срез биоптатов тканей бронхолегочной системы животных из контрольной группы показал отсутствие изменений в тканях стенки дыхательных путей. Не было выявлено гиперплазии эпителия, воспалительной инфильтрации в подслизистом слое, а также выраженного эмфизематозного расширения альвеол и фиброзных изменений в тканях (рис. 5).
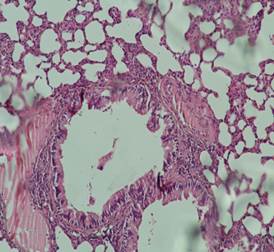
Рис. 5. Гистологическое исследование образца ткани легкого животного контрольной группы (окраска гематоксилином и эозином; х100).
Источник: составлено авторами по результатам данного исследования
Изучение гистопатологических изменений в тканях бронхов при воздействии аллергена у животных основной группы показало наличие выраженных изменений.
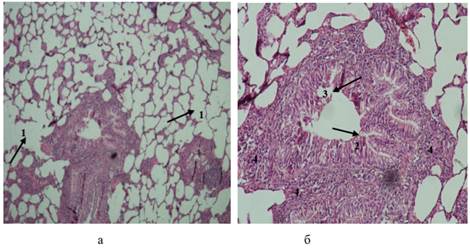
Рис. 6. Гистологическое исследование образца ткани легкого животного основной группы (окраска гематоксилином и эозином; х100). а: 1 – эмфизематозные изменения ткани легкого с резким истончением межальвелярных перегородок; б: 2 – выраженный бронхоспазм с гофрированной структурой слизистой оболочки бронхов мелкого калибра, 3 – нарушение целостности эпителия, 4 – умеренно выраженная лимфоцитарная инфильтрация.
Источник: составлено авторами по результатам данного исследования

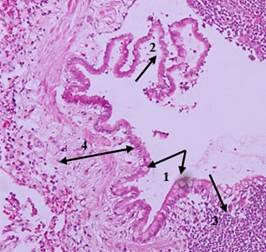
Рис. 7. Гистологическое исследование образца ткани легкого животного основной группы (окраска гематоксилином и эозином; х100). 1 – гиперплазия бокаловидных клеток, 2 – очаговая атрофия эпителия, 3 – выраженная лейкоцитарная инфильтрация, 4 – утолщение стенки бронхиолы за счет увеличения количества коллагеновых волокон.
Источник: составлено авторами по результатам данного исследования
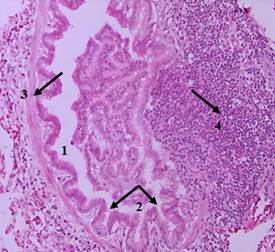
Рис. 8. Гистологическое исследование образца ткани легкого животного основной группы (окраска гематоксилином и эозином; х200). 1 – сужение просвета бронхиолы, 2 – гофрированная слизистая оболочка на фоне бронхиолоспазма, 3 – гипертрофия гладких миоцитов, 4 – выраженная лейкоцитарная инфильтрация.
Источник: составлено авторами по результатам данного исследования
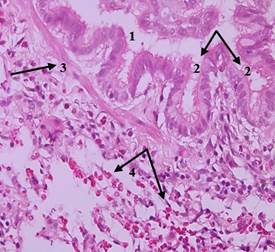
Рис. 9. Гистологическое исследование образца ткани легкого животного основной группы (окраска гематоксилином и эозином; х400): 1 – сужение просвета бронхиолы, 2 – гофрированная слизистая оболочка на фоне бронхиолоспазма, 3 – гипертрофия гладких миоцитов, 4 – выраженная лейкоцитарная инфильтрация с преобладанием эозинофилов. Источник: составлено авторами по результатам данного исследования
Для оценки суждения морфологических изменений в легких при БА, проведено сравнительное гистологическое изучение легких, в том числе бронхов различного калибра. При проведении световой микроскопии имелись признаки эмфиземы, расширение межальвеолярных пространств. Просветы бронхов и бронхиол сужены на фоне выраженного бронхоспазма, стенка бронхиолы утолщена за счет увеличения количества коллагеновых волокон, что свидетельствует о формировании фиброзных изменений. Эпителиальная пластинка слизистой оболочки имела признаки атрофии и нарушение целостности, наблюдалась гиперплазия бокаловидных клеток. Гладкие миоциты, входящие в состав стенки бронхов, гипертрофированы. Легочная ткань обильно инфильтрирована лейкоцитами с преобладанием эозинофилов. Данные изменения зарегистрированы у всех животных основной группы (рис. 6–9). При этом отмечалось количественное изменение клеточного состава полученных биоптатов. Множественные измерения показали, что доля бокаловидных клеток у животных экспериментальной группы в 4,6 раз больше (9,7±2,3), чем у контроля (2,1±0,4) (p < 0,001). Также были посчитаны клетки лейкоцитарного ряда в подслизистом слое: количество эозинофилов у крыс с моделью БА составило 58,9±9,8, что достоверно превышает значения, полученные у интактных животных 4,9±2,4 (p < 0,001). Полученные результаты оценки количества клеток в биоптатах бронхов еще раз доказывают высокую информативность полученной модели.
Результаты исследования и их обсуждение
Аналогичные исследования были проведены нашими коллегами P.Y.Li с соавт. [17] и R.Wang с соавт. [18]. Показано, что длительное воздействие аллергена приводит к значимым морфологическим изменениям в структуре тканей бронхов. Кроме того, в работе I.A.Savin с соавт. описываются изменения стенки крупных и мелких бронхов, характеризующиеся клеточными и внеклеточными изменениями. Эти изменения включают снижение целостности эпителиального барьера, гиперплазию бокаловидных клеток и гиперсекрецию слизи, гипертрофию гладкомышечных клеток, повышение активности фибробластов/миофибробластов с отложением компонентов внеклеточного матрикса в легочной ткани, что приводит к субэпителиальному фиброзу [19]. Результатом хронического воспаления является перестройка клеточно-тканевого состава тканей, входящих в стенку бронхов, то есть «ремоделирование бронхов». Ремоделирование дыхательных путей при астме характеризуется неполным обратимым сужением дыхательных путей, гиперреактивностью бронхов, спазмом гладких мышц, отеком дыхательных путей и гиперсекрецией слизи. Именно эти изменения наблюдаются в полученных биоптатах животных основной группы.
Заключение
Таким образом отработана методика формирования OVA-индуцированной БА на крысах и доказана ее эффективность. Понимание механизмов ремоделирования дыхательных путей на фоне длительного воздействия аллергена имеет решающее значение для разработки новых методов лечения и диагностики бронхиальной астмы, а применение эффективных моделей позволит в дальнейшем изучить различные стороны патогенеза данного заболевания.



