Введение
В хирургии поджелудочной железы (ПЖ) панкреатическая фистула (или панкреатический свищ) относится к наиболее часто встречающимся осложнением течения раннего послеоперационного периода. Помимо этого, она служит фоном для развития таких нежелательных событий, как несостоятельность анастомозов, сформированных в рамках ранее проведенной операции, формирование абсцессов и развитие аррозивного кровотечения вследствие ферментативного перитонита. Частота развития панкреатической фистулы (ПФ) варьируется от 2 до 30% в зависимости от вида опухоли, состояния пациента и техники выполнения операции [1]. В связи с этим в современной панкреатологии не перестает быть актуальным вопрос профилактики развития таких состояний.
Предикторами развития послеоперационной панкреатической фистулы (ПОПФ) принято считать диаметр главного панкреатического протока (ГПП) менее 3 мм и мягкую консистенцию поджелудочной железы [2; 3]. Yang F. и соавторы утверждают, что наличие у пациента высокого индекса массы тела (ИМТ) также относится к неблагоприятным факторам развития ПОПФ [4]. Большое распространение в рутинной практике среди хирургов-онкологов, специализирующихся на заболеваниях панкреатобилиарной локализации, получила разработанная в 2013 году M. Callery и соавторами шкала риска развития ПОПФ (Fistula Risk Score, FRS) [5]. В нее входят морфологические характеристики (протоковая аденокарцинома/хронический панкреатит – 1 балл, другие морфологические изменения – 0 баллов), диаметр ГПП (от 0 до 4 баллов, 0 баллов – вирсунгэктазия 5 мм и более, 1 балл – 4 мм, 2 балла – 3 мм, 3 балла – 2 мм, 4 балла – диаметр протока 1 мм и менее), интраоперационная кровопотеря (менее 400 мл – 0 баллов, более 1000 мл – 3 балла) и текстура поджелудочной железы (0 баллов – плотная, 1 балл - мягкая). Последняя характеристика определяется интраоперационно пальпаторным методом. Определение данного параметра хоть и носит субъективный характер, но является одним из ключевых факторов прогноза.
Текстура поджелудочной железы, характеризуемая как «мягкая» или «твердая», чаще всего определяется «на ощупь», что является субъективным методом оценки плотности ткани. Известно, что в ткани поджелудочной железы, прилежащей к опухоли (так называемой паратуморальной зоне), нередко выявляются признаки фиброза и атрофии. В ряде случаев такие изменения интерпретируются как проявления так называемого перитуморального панкреатита [6], относимого к хроническим панкреатитам (ХП). Основными признаками панкреатита, согласно рекомендациям рабочей группы Международной ассоциации по изучению ХП в составе Esposito I. и соавторов, являются пери- и внутридольковый фиброз, атрофия ацинусов и изменения протоков железы (деформация и расширение) (табл. 1) [7]. Также существует система оценки фиброза, предложенная Klöppel G. и соавторами [8], чье использование было отмечено в исследовании Ammann R.W. и соавторов [9]. Однако не существует гистопатологических особенностей, которые различали бы большинство ХП различных этиологий. В настоящее время общепринятой системы гистологической классификации оценки тяжести ХП нет. Междольковый фиброз - наличие соединительной ткани в междольковых пространствах, внутридольковый фиброз – разрастание соединительной ткани в дольках железы, замещающей ацинарные структуры. В свою очередь степень фиброза по площади поражения делится на: легкую - 10-40%, умеренную - 40-80%, тяжелую - 80-100% [7].
Таблица 1
Балльная система оценки степени фиброза при хроническом панкреатите
|
Характер фиброза |
Степень фиброза |
||
|
Слабый |
Умеренный |
Тяжелый |
|
|
Междольковый фиброз |
|
||
|
Очаговый |
1 |
2 |
3 |
|
Диффузный |
4 |
5 |
6 |
|
Внутридольковый фиброз |
|
||
|
Очаговый |
1 |
2 |
3 |
|
Диффузный |
4 |
5 |
6 |
Источник: составлено Esposito I. и соавторами [7].
В ряде работ определено, что высокая плотность ацинарных клеток в краю резекции поджелудочной железы напрямую коррелировала с послеоперационным панкреатитом и риском развития панкреатического свища [10; 11], поскольку именно сохранившиеся ацинарные клетки наиболее ферментативно активны [12].
Для объективизации оценки в настоящее время выделено такое понятие, как «ацинарная плотность» (АП) края резекции поджелудочной железы – это отношение площади ацинарных структур ко всей площади поперечного среза ПЖ. На АП влияют такие факторы, как степень фиброза в ткани ПЖ, очаги липоматоза. АП обратно пропорциональна степени атрофии ацинарных структур и прямо пропорциональна другим гистоморфологическим характеристикам изменений ткани ПЖ.
С позиций онкологической хирургии также актуален вопрос, каким образом эти показатели изменяются у пациентов, которым на первом этапе лечения злокачественных новообразований (ЗНО) поджелудочной железы была проведена неоадъювантная химиотерапия, и как это влияет на частоту встречаемости панкреатических фистул.
Целью исследования являлось определение роли ацинарной плотности и степени фиброза ткани поджелудочной железы в формировании послеоперационных панкреатических фистул у пациентов, перенесших панкреатодуоденальную резекцию (ПДР) up-front, и у прооперированных пациентов после неоадъювантной полихимиотерапии (НАПХТ).
Материалы и методы исследования
Был проведен анализ 63 клинических случаев пациентов, перенесших ПДР по поводу злокачественных новообразований головки поджелудочной железы, большого дуоденального сосочка (БДС), двенадцатиперстной кишки (ДПК), в период с января 2022 г. по январь 2024 г. Из них 13 пациентам проведена НАПХТ. Возраст пациентов обеих групп варьировался от 36,7 до 77,7 года, из них 33 мужчины и 30 женщин (табл. 2).
Таблица 2
Возраст и пол пациентов
|
Параметр |
Группа up-front |
Группа после НАПХТ |
|
Возраст, годы |
57,2 ⼠ 20,5 |
62,69 ⼠ 10,5 |
|
Мужчин, абс. (отн., %) |
24 (38,1) |
9 (14,29) |
|
Женщин, абс. (отн., %) |
26 (41,27) |
4 (6,35) |
Критерии включения – возраст от 18 до 75 лет, наличие резектабельного опухолевого процесса поджелудочной железы проксимальных локализаций, входившего в объем панкреатодуоденальной резекции. Критерии исключения – генерализованный характер опухолевого процесса (отдаленные метастазы в печень, легкие, другие органы, карциноматоз), отрицательная динамика на фоне проведенной неоадъювантной полихимиотерапии, наличие показаний к выполнению тотальной панкреатэктомии на основании предоперационного инструментального обследования либо по результатам интраоперационной ревизии.
Регистрация послеоперационной панкреатической фистулы (ПОПФ) проводилась в соответствии с критериями классификации ISGPS от 2016 г. [13]. Наличие ПОПФ класса B регистрировалось у пациентов в случае сохранения отделяемого по дренажу с высоким содержанием альфа-амилазы либо же в случае необходимости повторного дренирования брюшной полости, с выпиской из стационара с наличием дренажа, что формально позволяло предположить время стояние дренажа брюшной полости более 3 недель. ПОПФ класса С выставлялась всем пациентам с нежелательными событиями в раннем послеоперационном периоде, развитие которых связывалось с панкреатической фистулой, потребовавшими повторных хирургических вмешательств.
Таблица 3
Классификация панкреатического свища по ISGPS, 2016 г. [13]
|
Событие |
Клинически незначимая ПОПФ |
ПОПФ класса B |
ПОПФ класса C |
|
Более чем в 3 раза повышенная в сравнении с нормой амилазная активность в сыворотке крови |
Да |
Да |
Да |
|
Наличие дренажа более 3 недель |
Нет
|
Да |
Да |
|
Проведение специфической терапии лечения ПОПФ |
Нет |
Да |
Да |
|
Необходимость выполнения эндоскопических или транскутанных манипуляций |
Нет |
Да |
Да |
|
Выполнение ангиографии по поводу кровотечения, связанного с ПОПФ |
Нет
|
Да |
Да |
|
Повторные хирургические вмешательства |
Нет |
Нет |
Да |
|
Наличие клиники инфекционно-воспалительного процесса |
Нет
|
Да, без ПОН |
Да, с ПОН |
|
Полиорганная недостаточность |
Нет
|
Нет |
Да |
|
Летальный исход |
Нет |
Нет |
Да |
Пациенты были разделены на 2 группы: первая группа состояла из пациентов, которым на первом этапе лечения была выполнена операция в объеме панкреатодуоденальной резекции (группа up-front), вторая – из пациентов, прошедших на первом этапе лечения неоадъювантную полихимиотерапию (группа НАПХТ).
Был произведен анализ послеоперационного материала панкреатодуоденальных резекций от этих пациентов. Микроскопическое исследование операционного материала производилось на тканевых срезах, окрашенных гематоксилином и эозином. В срезах края резекции ПЖ оценивалась площадь среза, в нем площадь, занимаемая ацинарными структурами, с последующим определением АП как отношение площади, занимаемой ацинарными структурами, к площади среза, умноженное на 100 и 200 (рис. 1, 2). Также определялась степень междолькового и внутридолькового фиброза и липоматоза в соответствии с таблицей 1 [7; 14].
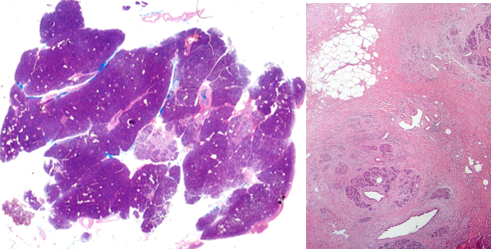
Рис. 1. Плановое патологоанатомическое исследование края резекции ПЖ гистопрепарата: а - ацинарная плотность 95%; б - ацинарная плотность 10% (а-б – окраска гематоксилином и эозином; а – х100, б – х200)
Источник: составлено авторами.
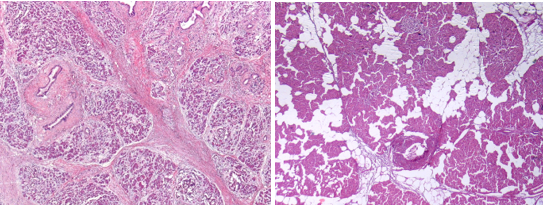
Рис. 2. Плановое патологоанатомическое исследование края резекции ПЖ гистопрепарата: а - междольковый и внутридольковый склероз; б - междольковый и внутридольковый липоматоз (а-б – окраска гематоксилином и эозином; х200)
Источник: составлено авторами.
По поводу протоковой аденокарциномы головки ПЖ прооперировано 20 пациентов, рака БДС - 24, рака ДПК - 3, нейроэндокринных опухолей (НЭО) - 6, прочие причины (вторичное поражение головки поджелудочной железы из других локализаций) - 10.
Таблица 4
Локализация опухоли и ее морфологический тип
|
Морфологическая структура |
Кол-во (%) |
|
Протоковая аденокарцинома |
20 (31,75) |
|
Рак БДС |
24 (38,1) |
|
Рак ДПК |
3 (4,76) |
|
НЭО |
6 (9,52) |
|
Прочие |
10 (15,87) |
В группе пациентов, которым была проведена предоперационная химиотерапия, пяти пациентам проведена НАПХТ по схеме FOLFIRINOX, пяти - по схеме mFOLFIRINOX, одному пациенту по схеме GemNab, одному пациенту по индивидуальному плану по поводу рака БДС и одному пациенту по поводу метастаза рака почки. Всем остальным пациентам из группы с НАПХТ лечение проводилось по поводу протоковой аденокарциномы поджелудочной железы.
Таблица 5
Схемы лекарственного лечения у пациентов, прооперированных после неоадъювантной системной терапии
|
Группа после НАПХТ |
|
|
Схема ХТ |
Кол-во (%) |
|
FOLFIRINOX |
5 (38,46) |
|
mFOLFIRINOX |
5 (38,46) |
|
GemNab |
1 (7,69) |
|
«Off-label»* |
1 (7,69) |
|
Сунитиниб** |
1 (7,69) |
* - вне клинических рекомендаций;
** - по поводу метастаза светлоклеточного почечноклеточного рака.
Статистическая обработка данных была произведена посредством обработки таблиц MS Exсel при помощи программы для комплексного анализа данных IBM SPSS Statistics v23. Для оценки достоверности различий между группами применен анализ U-критерия Манна–Уитни. Статистическая значимость присваивалась при p<0,05. Для оценки предсказательной способности предикторов развития панкреатической фистулы (бинарный классификатор, где 0 – отсутствие фистулы, 1 – наличие фистулы) был выполнен ROC-анализ, в рамках которого вычислена площадь под кривой (AUC), где значения AUC = 0,9–1,0 соответствуют отличной предсказательной способности, 0,8–0,9 – очень хорошей, 0,7–0,8 – хорошей, 0,6–0,7 – средней, 0,5–0,6 – удовлетворительной, 0,5 – неудовлетворительной.
Результаты исследования и их обсуждение
Из 63 прооперированных пациентов у 8 развилась ПОПФ класса B, у 9 - ПОПФ класса С. У 46 пациентов не было зарегистрировано клинически значимой ПОПФ, из них у 25 была «биохимическая утечка», у 21 не регистрировалось каких-либо лабораторных проявлений панкреатита.
Значения ацинарной плотности во всех группах варьировались от 0% до 95% (рис. 1). Среднее значение ацинарной плотности у пациентов группы up-front с BL/без ПОПФ составило 54,5% (n=33), с ПОПФ класса B - 68,1% (n=8), с ПОПФ класса С 84,4% (n=9). Ни у одного из пациентов группы после НАПХТ клинически значимая ПОПФ зарегистрирована не была, в этой группе среднее значение ацинарной плотности составило 43,8% (n=13).
При сравнении группы пациентов, которым хирургическое вмешательство было выполнено на первом этапе (группы up-front), с группой пациентов после НАПХТ и оценки влияния ацинарной плотности (параметр 1), перилобулярного фиброза (параметр 2) и интралобулярного фиброза (параметр 3) посредством ROC-анализа на вероятность развития панкреатической фистулы (параметр 4) был выявлен существенный прогностический вклад (AUC≥0,7) этих параметров по отдельности, попарно и в совокупности (рис. 3).
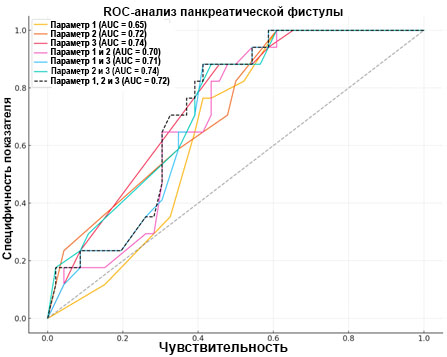
Рис. 3. ROC-анализ предикторов развития панкреатической фистулы.
Ось X – специфичность показателя; ось Y – чувствительность
Источник: составлено авторами.
На данной выборке пациентов ацинарная плотность имеет среднюю предсказательную способность в отношении вероятности развития панкреатической фистулы у пациентов после панкреатобилиарной резекции (ПДР) (AUC=0,65).
Анализ Манна-Уитни показывает статистически значимые различия между группами по всем проанализированным параметрам (p<0,05) (рис. 4-6). На этом основании можно предположить, что проведение НАПХТ вызывает более выраженные изменения в ткани поджелудочной железы, приводя к заместительному склерозу паренхимы, как перилобулярному, так и интралобулярному.
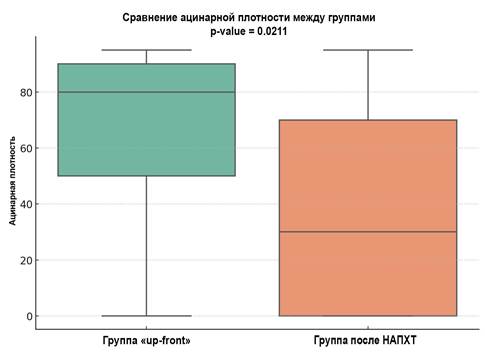
Рис. 4. Сравнение ацинарной плотности (p=0,02) между группами.
Метод визуализации - boxplot
Источник: составлено авторами.
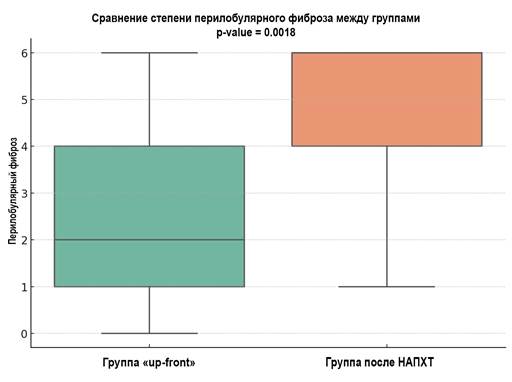
Рис. 5. Сравнение перилобулярного фиброза (p<0,005) между группами.
Метод визуализации - boxplot
Источник: составлено авторами.
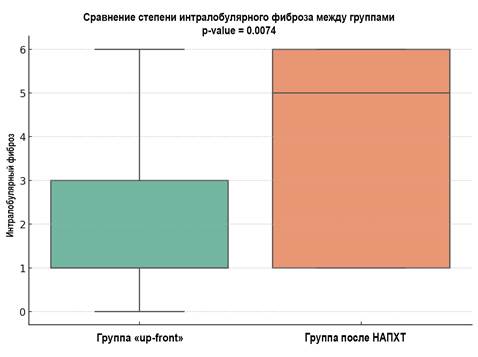
Рис. 6. Сравнение интралобулярного фиброза (p=0,007) между группами.
Метод визуализации - boxplot
Источник: составлено авторами.
В связи с тем, что вероятность формирования ПФ в постоперационном периоде у пациентов после ПДР и развития на этом фоне жизнеугрожающих состояний остается на высоком уровне, вопрос о поиске причин и возможностей ее профилактики не перестает быть актуальным. Значимость тех или иных морфологических характеристик паренхимы поджелудочной железы в развитии ПОПФ не остается без внимания мировым сообществом панкреатологов. По данным работы Umezaki N. и соавторов [10], было установлено, что количество ацинарных клеток поджелудочной железы является независимым предиктором развития ПОПФ. Подлужный Д.В. и соавторы [11] делают заключение, что рутинное использование в клинической практике интраоперационного подсчета ацинарных клеток и коллагена в крае резекции ПЖ позволит выделить группу высокого риска для принятия превентивных и лечебных мер. Таким образом, метод подсчета ацинарных клеток не уступает другим методикам оценки риска развития ПОПФ и, что очень важно, может быть использован в качестве рутинного метода прогнозирования.
Одной из конечных целей всех работ является разработка алгоритма принятия решения хирургом об избрании объема операции и послеоперационной тактики. Практика показывает, что подсчета FRS часто недостаточно для того, чтобы спрогнозировать высокую вероятность развития ПОПФ и последующего осложненного течения послеоперационного периода. Существует необходимость формулирования объективных показаний для выполнения тотальной панкреатэктомии, поскольку такой объем является инвалидизирующим.
Также остается открытым вопрос о влиянии неоадъювантного системного противоопухолевого лекарственного лечения на вероятность развития ПОПФ, т.к. ее применение приводит к развитию фиброза в ткани поджелудочной железы [15]. Полученные результаты говорят о том, что после НАПХТ снижается вероятность развития ПОПФ. Однако для окончательного суждения требуется проведение дальнейших исследований на большем количестве клинического материала.
Заключение
Высокие показатели плотности ацинарных структур поджелудочной железы увеличивают риск развития клинически значимых ПОПФ. Оценка ацинарной плотности в срезах края поджелудочной железы может быть дополнительным инструментом прогнозирования течения послеоперационного периода у пациентов с ПДР. Применение НАПХТ не увеличивает риск развития ПОПФ.



