Введение
В подавляющем большинстве случаев причиной трофических язв, являющихся признаком критической ишемии нижних конечностей, является облитерирующий атеросклероз [1-3]. Скорость их заживления напрямую зависит от степени реваскуляризации конечности в результате сосудистых или эндоваскулярных вмешательств. Однако при тяжелом атеросклеротическом поражении артерий нижних конечностей только 25% пациентов может быть выполнена первичная артериальная реконструкция, кроме того, в послеоперационном периоде имеется риск рестеноза [4; 5]. Так, после баллонной ангиопластики в подколенно-берцовом сегменте рестеноз артерий голени может наступать уже через 3-6 месяцев, приводя к образованию новых трофических язв [6; 7].
В настоящее время руководством к действию при определении хирургической тактики при многососудистом поражении артерий голени является ангиосомная теория. Согласно последней, восстанавливать кровоснабжение необходимо лишь в той артерии голени, которая питает ангиосом с трофическими дефектами. Полная реваскуляризация голени не требуется [8]. Однако выполнение требований данной стратегии зачастую невозможно. Техническая невыполнимость реваскуляризации ангиосомной артерии может быть связана с ее, как правило, наиболее тяжелым атеросклеротическим поражением либо атерокальцинозом [9]. В этой связи в заживлении трофики ключевую роль играет развитие коллатеральной артериальный сети на голени и стопе [10].
В связи с этим разработка местного лечения длительно не заживающих трофических язв при тяжелом облитерирующем атеросклерозе является актуальной задачей современной хирургии. Интересен опыт лечения различных долго не заживающих ран с использованием различных иммуномодулирующих мазей. К последним относятся препараты, содержащие рекомбинантный интерферон α2β, стимулирующий защитные функции организма, улучшающий регенерацию тканей и снижающий вирусную нагрузку на организм [11; 12]. В основном мазь с рекомбинантным интерфероном используется в профилактике вирусных респираторных инфекций, герпеса и папиллом [13].
Цель исследования - изучение эффективности применения мази с интерфероном α2β при лечении пациентов с критической ишемией нижних конечностей (КИНК) и длительно не заживающими трофическими язвами.
Материалы и методы исследования. В проспективном контролируемом нерандомизированном исследовании приняли участие 32 человека, страдающие КИНК и имеющие трофический дефект голени или стопы, оперированные в объеме дистальной гибридной артериальной реконструкции в отделении сосудистой хирургии ГБУЗ «Республиканская клиническая больница» Министерства здравоохранения Кабардино-Балкарской республики. Все пациенты были разделены на две группы. Первую группу (n=15) составили пациенты, которым в послеоперационном периоде ежедневно проводились перевязки с мазью, содержащей интерферон α2β, вторую группу (n=17) – пациенты, которым при перевязке применяли атравматические повязки (колитекс, брандолин), а также мазь с левомицетином.
По сопутствующей патологии пациенты были компенсированы и сопоставимы.
Критериями включения в группу исследования явились: 1. Площадь трофических дефектов не более 20 см2. 2. Отсутствие гнойной патологии, гангрены пальцев стопы или голени. 3. Отсутствие декомпенсированной сопутствующей патологии. 4. Тяжелый характер атеросклеротического поражения голени, технические сложности баллонной ангиопластики, высокий риск рестеноза артерий голени. 5. Схожий вариант развития коллатеральной сети кровоснабжения с заполнением одной из двух (плантарной или тыльной) артериальной дуг стопы.
Средний возраст пациентов составил 63,5±0,8 года; мужчин было 25, женщин – 7. Пациентам, участвовавшим в исследовании, измерялась площадь трофической язвы с использованием теста Л.Н. Поповой (1942) [14], который заключался в определении процента уменьшения площади ран в сутки, и вычислялся в период 1-5, 5-10, 10-15-е сутки раневого процесса по формуле:
А = (S – Sn) x 100 / S x t,
где А - искомый тест, S - начальная площадь, Sn - площадь в указанный момент времени, t - число дней, прошедших между измерениями площади. Площадь трофической язвы измерялась с помощью полиэтиленовой пленки, через которую обводился ее контур. Затем полученное изображение язвы накладывали на лист миллиметровой бумаги, после чего подсчитывали количество квадратных сантиметров и миллиметров, заключенных внутри границ контура. После выписки из стационара динамика заживления язв оценивалась амбулаторно с помощью компьютерной программы «АналиРан» [15]. Данная программа позволяет с использованием фотокамеры получать оперативные данные о площади язвы и ее структурных элементах: некроз, фибрин и грануляции.
Средняя площадь трофической язвы перед началом исследования в обеих группах была сопоставима и составляла 17,3±2,8 см2.
Продолжительность стационарного и амбулаторного этапа перевязок составила 30 дней. Антибактериальная терапия респондентам не проводилась, осуществлялось только местное лечение. В процессе исследования 1 раз в 3 дня оценивались скорость заживления трофической язвы, а также микробный пейзаж на ее поверхности на 5, 10, 15 и 21-е сутки. Первичной конечной точкой исследования являлось заживление трофической язвы, рестеноз зоны сосудистой реконструкции с необходимостью повторного вмешательства.
Для статистической обработки данных при сравнении групп исследования было использовано программное обеспечение SPSS Statistics 17.0. Результаты исследования были разнесены по шкале среднеарифметических значений (mean) ± стандартное отклонение (SD). Различия средних значений (p) в основных показателях послеоперационного периода оценивали с применением парного t-критерия Стьюдента, который считали достоверным при р < 0,05. Для оценки различий между двумя малыми независимыми выборками использовали U-критерий Манна–Уитни. Для определения корреляционной зависимости между показателями использовали определение коэффициента корреляции Спирмена. Статистическую гетерогенность групп оценивали с помощью χ2-теста. При р < 0,1 и I2 > 50% гетерогенность считали статистически значимой.
Результаты исследования и их обсуждение
При изучении процента заживления язвенно-трофических дефектов в группах исследования выяснено, что при равных условиях реваскуляризации конечности и степени развития коллатерального кровообращения в первой группе исследования заживление трофики к 30-му дню отмечалось в 22,5% случаев, в то время как во второй группе исследования – в 17,2% (p=0,024) (рис.).
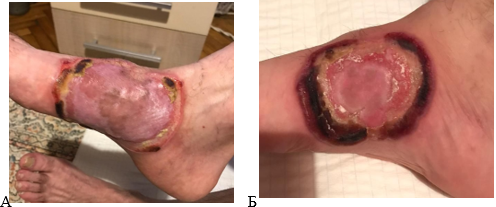
Динамика заживления трофических язв на фоне применения мазью, содержащей интерферон α2β: А – 3-и сутки от начала лечения, Б – 21-е сутки от начала лечения
Скорость заживления трофических язв в обеих группах в первые 9 суток исследования была сопоставима, однако затем отмечалось достоверное увеличение скорости заживления язв в опытной группе. Процесс регенерации в обеих группах исследования к 21-му дню наблюдения характеризовался уменьшением площади раны на 0,53±0,03 см2 в опытной группе и на 0,39±0,04 см2 - в контрольной (р < 0,05) (табл.).
Скорость заживления трофических язв у пациентов в группах исследования (1 – метод Л.Н. Поповой, 2 - метод «АналиРан»)
|
№
|
3-и сутки |
9-е сутки |
15-е сутки |
18-е сутки |
||||
|
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
|
|
1-я группа |
0,11±0,03 |
0,10±0,02 |
0,34±0,03 |
0,35±0,02 |
0,44±0,02* |
0,43±0,03* |
0,48±0,13* |
0,49±0,04* |
|
2-я группа |
0,13±0,03 |
0,12±0,02 |
0,34±0,05 |
0,32±0,05 |
0,34±0,05 |
0,32±0,03 |
0,36±0,03 |
0,34±0,02 |
Примечание: различия в группах статистически значимы, *- р < 0,05.
Качественные изменения на поверхности трофического дефекта оценены с применением компьютерной программы «АналиРан», которая позволяет оценить долю грануляционной ткани, некроза и фибринозных наложений на раневой поверхности. С 12-х суток исследования отмечается преобладание в опытной и контрольной группах суммарной площади грануляционной ткани над общей долей некротических и фибринозных наложений (опытная группа – грануляционная ткань 13,25±1,15 см2, некроз и фибрин – 5,33±1,15 см2, р=0,009; группа контроля – грануляционная ткань 9,25±1,02 см2; некроз и фибрин – 6,24±1,16 см2, р=0,043). В опытной группе площадь грануляционной ткани с 12-х суток становится выше, чем в группе контроля (p < 0,05).
При оценке биоценоза кожи на 5-е сутки после начала лечения необходимо отметить преобладание колониеобразующих форм стафилококка (Staphylococcus epidermidis и Staphylococcus aureus 103–104 KOE/тамп.) в сопоставимых количественных значениях в группах исследования. Кроме этого, отмечается наличие патогенной флоры Escherichia coli 104 КОЕ/тамп. и Proteus mirabilis 104/тамп. Встречаемость данных штаммов в таком количестве соответствует в первой группе 79,3%, во второй – 81,3% (р=0,122).
На 10-е сутки отмечается снижение патогенной флоры в опытной группе Escherichia coli 101 КОЕ/тамп. (у 80,4% респондентов) и Proteus mirabilis 101 КОЭ/тамп. (у 85,4% респондентов) (р=0,012). В группе контроля уровень и спектр обсемененности остался прежним, лишь у 11,4% исследуемых отмечено снижение микробных ассоциаций кишечной палочки до 102 КОЕ/тамп. Необходимо отметить, что данная тенденция сохранится в группах исследования вплоть до 21-х суток. По результатам последнего посева, в опытной группе сохранились лишь сапрофитные стафилококки в виде изолированных колоний, в то время как в группе контроля отмечался рост протея и кишечной палочки, хоть и в меньшем количестве.
Примененная авторами мазь, содержащая интерферон α2β, с целью лечения долго не заживающих трофических язв показала обнадеживающие результаты по сравнению с традиционными способами обработки раневой поверхности.
Данная мазь является рекомбинантным препаратом человеческого интерферона, механизм действия которого заключается в связывании со специфическими белками на поверхности клеточных мембран, что приводит к активизации антиоксидантных систем организма. Важным механизмом, поддерживающим хроническое воспаление в зоне трофической язвы, является повышенный уровень интерлейкинов. Эти вещества пролонгируют «респираторный взрыв» в нейтрофилах, сопровождающийся выходом большого количества активных форм кислорода, которые имеют высокую цитототоксичную активность как в отношении собственных разрушенных клеток, так и в отношении бактериальных агентов. Необходимо отметить, что свободные радикалы кислорода вызывают ускорение процессов перекисного окисления липидов, субстратом которого являются фосфолипиды клеток и бактерии.
Местное использование препаратов, содержащих интерферон, способствует гармонизации процессов оксидантного стресса. Кроме того, он активизирует активность макрофагов и Т-киллеров, что способствует очищению раневой поверхности и формированию грануляционной ткани. В данном исследовании продемонстрировано, что скорость регенерации труднозаживаемых трофических язв при местном применении препаратов, содержащих рекомбинантный интерферон, ускоряется по сравнению с группой, где применялось стандартное местное лечение.
Кроме того, необходимо отметить, что интерферон α2β активизирует процесс трехклеточной кооперации в рамках местного иммунного ответа, что, в совокупности с проводимой антибактериальной терапией, способствует эрадикации бактериального микроокружения. Это было доказано в проведенном авторами исследовании снижением степени обсемененности патогенной микрофлорой в опытной группе с 10-х суток исследования.
В третьей фазе воспаления, которая характеризуется образованием рубца и активной эпителизацией, интерфероны также играют довольно важное значение. Интерферон α2β вызывает усиление фибриллогенеза, сочетающееся с уменьшением количества тканевого отека. При этом сохраняется ритмичность процессов эпителизации и созревания соединительной ткани, которое сопровождается рассасыванием грануляции. Данные процессы наглядно продемонстрированы в проведенном исследовании с помощью программы «АналиРан», которая позволила оценить преобладание процессов формирования грануляционной ткани с 12-х суток исследования и их преобладание в группе, где в качестве местной терапии был применен человеческий интерферон.
Заключение
Таким образом, проведенное исследование показало эффективность использования местной терапии мазями, содержащими интерферон α2β, при лечении трофических язв после тяжелых артериальных реконструкций, выполненных по поводу критической ишемии нижних конечностей. Данное исследование является частным примером применения данного метода в узком диапазоне возможностей, в связи с этим необходимо дальнейшее изучение возможностей препаратов на основе интерферона при лечении хронических трофических язв.



