Введение. В настоящее время представлен один препарат, ингибирующий два молекулярных нарушения EGFR и MET, – амивантамаб, который успешно применяется в ряде клинических исследований для больных немелкоклеточным раком легкого (НМРЛ). Использование препаратов, обладающих биспецифическим механизмом действия, являются малоизученным вопросом в современной онкологии.
Цель исследования. Выявить и сравнить эффективность и безопасность амивантамаба как в монорежиме, так и в комбинации с таргетной терапией и химиотерапией (ХТ).
Материалы и методы исследования. В базе данных PupMed проанализирована зарубежная литература, приведено 4 клинических исследования (CHRYSALIS, PAPILLON, MARIPOSA, MARIPOSA–2), в которых показаны эффективность и безопасность амивантамаба и лазертиниба в монорежиме и в комбинированном лечении. Обзор литературы подготовлен на основании современных принципов подготовки современных обзоров в соответствии с протоколом Preferred Reportina Items for Systematic Reviewsand Meta-Analyses (PRISMA). https://www.prisma-statement.org/PRISMAStatement/Checklist.aspx
Результаты исследования и их обсуждение. Амивантамаб на сегодняшний день оценивается в клинических испытаниях фазы III для лечения первой линии НМРЛ с мутациями EGFR Exon20ins в сочетании с химиотерапией (PAPILLON), для первой линии терапии Ex19del и мутированных L858R НМРЛ в сочетании с лазертинибом (MARIPOSA) и в сочетании с ХТ, которые прогрессировали на осимертинибе (MARIPOSA–2). Амивантамаб одобрен FDA в 2021 году по результатам клинического исследования I фазы CHRYSALIS для лечения пациентов с локальным и метастатическим НМРЛ с мутациями EGFR Ex20Ins. В 2024 году FDA одобрило использование комбинации амивантамаба и платиносодержащей ХТ в лечении распространенного НМРЛ с мутацией в экзоне 20 гена EGFR. Лазертиниб получил одобрение FDA для использования в сочетании с амивантамабом – двойным моноклональным антителом, нацеленным на EGFR/MET. Активирующие мутации в гене EGFR являются основным онкогенным драйвером при НМРЛ, при этом 85% случаев возникают из-за делеции экзона 19 или миссенс-мутации в экзоне 21 – L858R. Третьими по распространенности мутациями в гене EGFR можно считать инсерции в экзоне 20, они встречаются менее чем в 12% случаев. Мутация в гене EGFR в экзонах 19 и 21 является одной из самых часто встречаемых и наиболее известных у пациентов с НМРЛ. ИТК, разработанные специально для лечения пациентов с мутаций в гене EGFR в экзоне 19 или 21, успешно применяются с 2000-х годов. Наименее изученными остаются изменения в экзоне 20 гена EGFR. Мутации EGFR в экзоне 20 часто сочетаются с другими генетическими изменениями. Наиболее распространенные мутации включают в себя сочетания с опухолевым белком p53 (TP53, который составляет 56%), циклинзависимые киназы 2A (CDKN2A – 22%) и циклинзависимые киназы 2B (CDKN2B – 16%). Мутации EGFR Ex20Ins демонстрируют уникальную структурную конфигурацию, которая отличает их от типичных мутаций EGFR. Эта особенность делает их относительно устойчивыми к ИТК EGFR – препаратам, обычно используемым для лечения НМРЛ. Мутации в экзоне 20 встречаются в 4–12% случаев всех EGFR-положительных НМРЛ. Пациенты с мутациями в экзоне 20 хуже отвечают на ХТ, таргетную терапию и иммунотерапию. Плохой ответ на ИТК обусловлен измененной конформацией активного центра рецептора, при этом таргетные препараты не способны блокировать сигнальный путь. Мутации в экзоне 20 чаще встречаются у некурящих женщин азиатской расы. Пациенты с мутациями в экзоне 20 имеют значительно более короткую медиану общей выживаемости (мОВ) – от 11,04 до 24,4 месяца, чем пациенты с классическими мутациями в гене EGFR – примерно 38,6 месяца [1, 2]. Амивантамаб – полностью человеческое моноклональное антитело с биспецифическим связыванием. Одна часть его антигенсвязывающего фрагмента распознает рецептор эпидермального фактора роста, в то время как другая нацелена на протоонкоген MET (рис.).
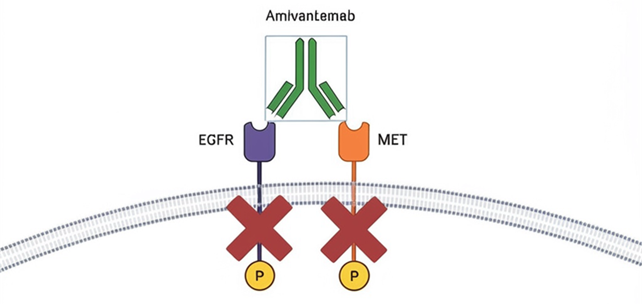
Биспецифическое связывание амивантамаба
Препарат связывается с внеклеточными доменами EGFR и MET, нарушая их сигнализацию, блокирует связывание лигандов и в итоге ингибирует фосфорилирование рецепторов, особенно в моделях с инсерцией в экзоне 20. Амивантамаб связывает внеклеточные домены EGFR и MET, ингибирует взаимодействие с соответствующими лигандами и предотвращает активацию обоих рецепторов, индуцирует антителозависимую цитотоксичность (ADCC) как in vitro, так и in vivo, тем самым повышая противоопухолевую эффективность препарата [3, 4]. Амивантамаб споосбен к трогоцитозу, который является важным механизмом, способствующим гибели клеток. Трогоцитоз – это механизм, при котором антитело, нацеленное на опухоль, опосредует перенос мембранных фрагментов и лигандов от опухолевых клеток к эффекторным клеткам. Известно, что амивантамаб вызывает деградацию рецепторов через трогоцитоз [5]. Препарат имеет большую молекулярную массу, это может препятствовать его проникновению через гематоэнцефалический барьер, что способно затруднить лечение пациентов с наличием метастатического поражения головного мозга. Амивантамаб одобрен FDA в 2021 году по результатам клинического исследования I фазы CHRYSALIS для лечения пациентов с локальным и метастатическим НМРЛ с мутациями EGFR Ex20Ins. Амивантамаб вводят внутривенно еженедельно в течение четырех недель, затем каждые две недели до прогрессирования заболевания или развития неприемлемой токсичности, цикл 28 дней. Дозировка препарата зависит от веса пациентов. Пациентам, имеющим вес меньше 80 кг, назначают 1050 мг внутривенно, при весе более 80 кг – 1400 мг. Дозировка амивантамаба после первого перерыва из-за наличия побочных реакций для пациентов с весом менее 80 кг составит 700 мг, для пациентов, которые весят более 80 кг, – 1050 мг. Дозировка амивантамаба после второго перерыва из-за развития нежелательных явлений (НЯ) для пациентов, вес которых менее 80 кг, оставит 350 мг, для пациентов с весом более 80 кг – 700 мг. Амивантамаб отменяют в связи с развитием третьего перерыва ввиду развития токсичности. Частота объективного ответа (ЧОО) составила 40%, средняя продолжительность ответа – 11,1 месяца. Полный ответ был достигнут у 4%, частичный ответ – у 36% пациентов. Самыми частыми НЯ являлись: сыпь – 86%, инфузионные реакции – 65% и паронихии – 42% [6, 7, 8]. CHRYSALIS – 2 – открытое исследование, которое включает в себя пациентов с мутацией в гене EGFR в экзоне 19 или L858R, с прогрессированием заболевания после ХТ на основе препаратов платины. Средний возраст пациентов, включенных в исследование, составил 63 года. Все пациенты получили внутривенно установленную рекомендуемую комбинированную дозу 1050 мг амивантамаба и перорально лазертиниб в дозе 240 мг. В клиническом исследовании III фазы PAPILLON показано преимущество амивантамаба при лечении пациентов с ранее не леченным, прогрессирующим или метастатическим НМРЛ с наличием мутации Exon20ins. Стандартом в лечении НМРЛ с инсерцией в экзоне 20 является ХТ на основе препаратов платины, самой распространенной комбинацией является карбоплатин AUC 5 и пеметрексед 500 мг/м2, вводимый каждые 21-й день. В исследовании PAPILLON проведена оценка возможности добавления амивантамаба к этой установленной терапии для улучшения результатов лечения пациентов. 308 пациентов рандомно разделены на группу ХТ, которая включала карбоплатин и пеметрексед (155 пациентов), и группу ХТ идентичными препаратами в комбинации с амивантамабом (153 пациента). Комбинированная терапия направлена на улучшение результатов лечения пациентов. Первое введение амивантамаба начинают с еженедельной дозы 1400 мг до начала второго цикла, далее дозировку увеличивают до 1750 мг, лечение продолжают каждые 3 недели. Выживаемость без прогрессирования (ВБП) в группе амивантамаба в комбинации с ХТ составила 11,4 месяца, а в группе, где применялась только одна ХТ препаратами платины, – 6,7 месяца (p<0,001). Через 18 месяцев полный или частичный ответ на терапию был у 73% и 47% больных соответственно (p<0,001). Обратимые гематологические НЯ были в группе комбинированного лечения. 7% пациентов прекратили прием амивантамаба из-за НЯ [9]. Лазертиниб – пероральный ИТК EGFR третьего поколения, проникающий через гематоэнцефалический барьер (ГЭБ); он селективен в отношении мутации T790M, мутаций EGFR Ex19и L8585R и не влияет на EGFR WT [10]. Недавно данный препарат получил одобрение FDA для использования в сочетании с амивантамабом – двойным моноклональным антителом, нацеленным на EGFR/MET [11]. Рекомендуемая доза препарата составляет 240 мг 1 раз в день без учета приема пищи. При необходимости редукции препарата дозировка может быть уменьшена до 160 мг 1 раз в сутки [12]. Самыми частыми НЯ для лазертиниба считаются сыпь, зуд, мышечные спазмы, головная боль, диарея и снижение аппетита. Механизм резистентности к лазертинибу аналогичен тем, которые встречались у пациентов, получавших другие ИТК EGFR третьего поколения. Наиболее распространенными механизмами резистентности к лазертинибу были потеря EGFR T790M и изменения PIK3CA. Многоцентровое рандомизированное клиническое исследование III фазы MARIPOSA направлено на сравнение противоопухолевой активности амивантамаба в комбинации с лазертинибом по сравнению с осимертинибом в монорежиме в качестве лечения первой линии для пациентов с НМРЛ c наличием мутаций EGFR в экзоне 19 и L858R. Основными критериями отбора являлись подтвержденный местнораспространенный и метастатический НМРЛ с наличием мутаций в гене EGFR с делецией в экзоне 19 или с замещением в экзоне 21, с бессимптомным метастатическим поражением головного мозга, со статусом ECOG 0 -1, а также с метастатическим поражением печени и наличием сопутствующей мутации TP53. В исследовании пациенты распределены на три группы. В первую группу были включены пациенты, в лечении которых использовался амивантамаб в комбинации с лазертинибом, во вторую – пациенты, принимающие осимертиниб в монорежиме, и в третью группу вошли пациенты, принимавшие только лазертиниб. В исследовании продемонстрировано преимущество в группе амивантамаба в комбинации с лазертинибом в подгруппах пациентов с метастазами в головной мозг, печень и мутациями TP53. Медиана выживаемости без прогрессирования (мВБП) в группе «амивантамаб + лазертиниб» была 23,7 месяца, в группе осимертиниба – 16,6 месяца. HR=0,70. мВБП в группе лазертиниба составила 18,5 месяца. Данные общей выживаемости (ОВ) еще не зрелые. Прекратили прием препаратов в данном исследовании ввиду развития НЯ, связанных с лечением, 10% пациентов при приеме амивантамаб + лазертиниб и 3% – при приеме озимертиниба [13]. MARIPOSA–2 – еще одно рандомизированное исследование III фазы, которое также показывает эффективность комбинированного лечения амивантамабом с ХТ и амивантамабом с лазертинибом вместе с ХТ в сравнении только с ХТ у пациентов, имеющих прогрессирование заболевания с наличием мутации EGFR при НМРЛ при применении осимертиниба в монорежиме. В исследование были допущены пациенты с метастатическим поражением головного мозга. мВБП в группе «амивантамаб + ХТ» составила 8,2 месяца, в группе «амивантамаб + лазертиниб + ХТ» – 8,3 месяца против 4,2 месяца для ХТ. HR=0,41. Преимущество в ВБП наблюдалось в группах с комбинированным лечением относительно групп, в которых была только ХТ, в том числе и у пациентов с наличием метастатического поражения головного мозга [14, 15]. Амивантамаб не единственный препарат для лечения НМРЛ c инсерциями в экзоне 20. Сунозертиниб, мобоцертиниб, люминеспиб также оказывают противоопухолевый эффект на ген EGFR с инсерцией в экзоне 20. Из всех препаратов, протестированных на пациентах с наличием мутации гена EGFR в экзоне 20, только амивантамаб и мобоцертиниб были одобрены FDA для лечения пациентов с платиносодержащей ХТ. Клиническое исследование III фазы EXCLAIM-2 оценивало мобоцертиниб в сравнении с ХТ в качестве терапии первой линии при локально прогрессирующем или метастатическом НМРЛ EGFR ex20ins. Неудовлетворительная оценка первичной конечной точки в клиническом исследовании III фазы EXCLAIM-2 привела к инициированию добровольного отказа от мобоцертиниба во всем мире [16]. Амивантамаб благодаря своему механизму действия и благоприятному профилю токсичности показал надежные результаты в лечении пациентов с мутацией в гене EGFR Exon20ins.
Выводы. Амивантамаб – первый препарат, обладающий бифункциональным антителом, эффективным для лечения НМРЛ. Он показал многообещающую активность в клинических исследованиях для пациентов с опухолями, в которых есть мутации EGFR Exon20ins. Амивантамаб хорошо проявил себя при лечении пациентов с метастатическим поражением головного мозга, а также с наличием мутаций в гене TP53, которые являются фактором негативного прогноза, при котором болезнь сложнее поддается лечению. Правильно подобранная дозировка препарата, которая отражена в клиническом исследовании CHRYSALIS (при весе меньше 80 кг – 1050 мг, при весе более 80 кг – 1400 мг), позволяет получить полные и частичные ответы на терапию. Ввиду большой молекулярной массы препарата возможны трудности с его проникновением через гематоэнцефалический барьер. Осимертиниб в повышенной дозировке может быть интересной альтернативой амивантамабу при лечении пациентов с метастатическим поражением головного мозга ввиду хорошего проникновения препарата в центральную нервную систему. Лазертиниб – препарат, оказывающий свое действие на мутации EGFR в экзоне 19, L858R и T790M гена EGFR. В комбинации с амивантамабом является многообещающей опцией лечения, которая уже демонстрирует преимущество в комбинированном лечении, что отражено в клинических исследованиях MARIPOSA и MARIPOSA-2. В исследовании MARIPOSA-2 к комбинации была добавлена системная ХТ. Новые опции лечения НМРЛ с ингибированием двух молекулярных мишеней позволяют контролировать прогрессирование заболевания, их применение дает большие надежды на увеличение общей выживаемости.



