Введение
Безопасность и комфортность состояния пациентов в периоперационном периоде прочно вошли в современную практическую медицину. Обусловлено это как морально-этическими, медико-экономическими аспектами, так и нормативно-правовыми. С целью контроля качества оказания медицинской помощи, объективного анализа ошибок, осложнений и нежелательных реакций при проведении анестезии и интенсивной терапии, необходима объективная информационная база по всем фактам. Однако нет пока единого подхода к терминологии, четкой классификации понятий и регламентирующих их правовых документов по респираторным реакциям, требующим различной степени срочности коррекции в отделениях анестезиологии-реанимации, в том числе связанных исключительно с нежелательными последствиями действия лекарственных препаратов [1]. Респираторные инциденты и осложнения (чаще всего под этим понимают десатурацию, последствия трудной интубации трахеи, асфиксию, апноэ послеоперационное) представляют серьезную проблему, которая может повлиять на исходы оперативных вмешательств и продолжительность госпитализации. Ингаляционные анестетики, такие как севофлуран и десфлюран, характеризуются быстрым началом и завершением анестезии, а также минимальной метаболической нагрузкой на организм. Они часто используются в комбинации с внутривенными гипнотиками для быстрой индукции и достижения оптимального уровня анестезии. Применение севофлурана и десфлурана значительно сокращает время до экстубации благодаря высокой управляемости, что позволяет этим ингаляционным анестетикам 3-го поколения прочно занять приоритетное место для базовой анестезии [2]. Актуальным является обеспечение пробуждения пациента на фоне стабильной гемодинамики, с быстрым восстановлением всех рефлексов (кашлевого, в том числе) и когнитивных функций, без ощущения дискомфорта и кашля. Однако у 62% пациентов возникает послеоперационная боль и дискомфорт в горле после общей анестезии [3]. Использование севофлурана или десфлурана для поддержания анестезии в различных комбинациях с гипнотиками для индукции (тиопентала натрия или пропофола) может влиять на чувство дискомфорта в ротоглотке и кашель в раннем послеоперационном периоде за счет усиления побочных эффектов на бронхолегочную систему. Частота возникновения этих ощущений достаточно высока, но вариабельна, в зависимости от комбинаций сочетания используемых лекарственных средств. Учитывая, что кашель и дискомфорт не относятся к угрожающим жизни осложнениям и инцидентам, в том числе по Кодировкам осложнений по МКБ-10, авторы в рамках данной статьи объединили их в понятие «нежелательные респираторные явления» (НРЯ). НРЯ можно считать побочным эффектом лекарственных препаратов (ЛП), который либо усиливается при взаимодействии, либо нивелируется [4, с. 683].
В современной анестезиологии сформулирована концепция призмы, сторонами которой являются базис любого анестезиологического пособия (гипнотический сон, аналгезия, релаксация), а основанием - их взаимодействия. Именно взаимодействие этих основных групп лежит в основе понятия «современная мультимодальная анестезия». При попадании какого-либо лекарственного вещества в организм происходит сложный процесс биохимической трансформации, с нейрогуморальной регуляцией по типу прямой и обратной связи с учетом внешних и внутренних факторов. Изучены взаимодействия практически между всеми группами препаратов для анестезии. Исследования направлены преимущественно на основные эффекты, однако изучению взаимодействий в плане развития побочных эффектов уделено значительно меньше внимания, хотя имеются данные, что 51% одобренных лекарств имеют серьезные побочные эффекты [4, с. 712].
Различные механизмы биотрансформации у разных препаратов и их взаимодействия объясняют вариации по продолжительности воздействия и, соответственно, влияют на качество состояния при пробуждении.
Цель исследования: оценить частоту развития НРЯ – кашля и дискомфорта со стороны дыхательной системы при пробуждении у пациенток гинекологического профиля, при различных комбинациях внутривенных гипнотиков и ингаляционных анестетиков (тиопентала натрия, пропофола, севофлурана, десфлурана).
Материал и методы исследования
На базе клиники в 2022-2023 гг. проведено проспективное сравнительное исследование при плановых гинекологических вмешательствах у 141 пациента женского пола, разделенных на 4 группы, в зависимости от применяемого в ходе анестезиологического пособия сочетания препаратов – внутривенного гипнотика для индукции и ингаляционного анестетика для поддержания анестезии.
Пациентам женского пола исследуемых групп выполнялись следующие виды операций: лапароскопические, лапаротомические и комбинированным доступом на матке и придатках; операции по установкам сетчатых имплантов при цистоцеле, ректоцеле, стрессовом недержании мочи, с пластикой влагалища и без.
Всем пациентам женского пола проводили комбинированную ингаляционную анестезию. Индукция: внутривенные гипнотики – пропофол или тиопентал натрия. Пропофол (диизопропилфенол) вводился из расчёта 2,0-2,5 мг/кг массы тела, тиопентал натрия применялся в дозе 3,5-5 мг/кг. В качестве анальгетика вводился фентанил 0,005% раствор в дозе 3,5–6 мкг/кг. При этом биспектральный интегральный показатель глубины седации (Bis) снижался в среднем до 30. Всем применяли миорелаксант рокуроний в дозе 0,6 мг/кг. После контроля уровня NMT - нервно-мышечного блока (TOF), равного 0,1, осуществляли атравматичную оротрахеальную интубацию трахеи трубкой размера 7-7,5 без проводника, давление в манжете поддерживали в пределах 20-25 см вод. ст. Респираторная поддержка проводилась в режиме нормовентиляции наркозно-дыхательным аппаратом «Fabius Tiro Plus (Drager)». Поддержание анестезии осуществляли ингаляционными анестетиками севофлураном или десфлураном (после периода насыщения по стандартным схемам) с минимальным потоком (1 л/мин.) и поддержанием минимальной альвеолярной концентрации (МАК) на уровне 1–0,8, с учетом возраста. Аналгезию обеспечивали введением фентанила в поддерживающей дозировке 3–5 мкг/кг*час (0,1 мг каждые 15–20 мин.). По окончании операции после выключения ингаляционных анестетиков через 7–8 мин. на фоне увеличения потока свежего газа наступало пробуждение пациенток. Экстубация выполнялась при показателях Bis 85-90-95%; TOF 0,9-1,0. Уровень сознания и когнитивных функций оценивали по балльной шкале RASS [5].
Группы исследования. Сочетание препаратов для индукции и для базовой анестезии являлось критерием распределения 141 пациента женского пола на 4 группы.
Группа 1 – тиопентал + десфлуран, n= 39.
Группа 2 – тиопентал + севоран, n=32.
Группа 3 – пропофол + десфлуран, n=37.
Группа 4 – пропофол + севоран, n=33.
Критерии включения пациентов в исследование: плановые оперативные вмешательства на органах малого таза продолжительностью от 60 до 90 минут, комбинированная общая анестезия с применением ингаляционных (севофлуран или десфлуран) и внутривенных (пропофол или тиопентал натрия) анестетиков; возраст 18–63 года; статус по ASA - 1-2 класс.
Критерии исключения: трудный дыхательный путь (ТДП); анафилактические реакции в анамнезе; индекс массы тела (ИМТ) менее 20 и более 34 кг/м2; интраоперационная кровопотеря более 300 мл; отсутствие продуктивного контакта с пациентом.
У пациентов женского пола всех групп анализировали следующие данные из анамнеза: наличие сопутствующих респираторных заболеваний, таких как хроническая обструктивная болезнь легких, астма или дыхательная недостаточность (ДН), наличие вредных привычек – курения.
Объективно оценивали: возраст, индекс массы тела; резервные возможности дыхательной системы – функциональная проба Штанге (с) и Генче (с) по стандартной методике [6, с. 51-52], SpO2, регистрировали длительность оперативного вмешательства (табл. 2); выявляли возможную трудную интубацию.
В раннем послеоперационном периоде (2 часа с момента пробуждения и экстубации):
· оценивали время от окончания операции до экстубации пациента женского пола и уровень сознания по шкале оценки RASS через 1 час после окончания операции;
· в ПИТ у пациентов женского пола регистрировали частоту НРЯ: кашля и дискомфорта в ротоглотке сразу после экстубации, через 1 и 2 часа (табл. 1). Дискомфорт в ротоглотке – это неприятные ощущения при глотании и вдыхании воздуха, вызывающее у некоторых ощущение затрудненного дыхания. Понятие субъективное, сопровождается ощущением першения, удушья, сдавливания, зуда, жжения в ротоглотке. Важный момент - обратимость и кратковременность состояния в отличие от дисфагий [7];
· интенсивность и длительность эпизодов послеоперационного кашля и/или дискомфорта в ротоглотке оценивались по разработанной авторами данной статьи формализованной шкале в баллах (табл. 1).
Таблица1
Оценка выраженности послеоперационных НРЯ
|
Оценка выраженности послеоперационных НРЯ Assessment of the severity of postoperative respiratory events. |
Баллы Scores |
|
Наличие кашля после экстубации и в течение 1-го и 2-го часа: |
|
|
Минимально выражен (в течение 1-го часа) |
1 |
|
Средней степени выраженности (в течение 1-го часа) |
2 |
|
Максимально выраженный (в течение 1-го и 2-го часа) |
3 |
|
Дискомфорт в ротоглотке после экстубации и в течение 1-го и 2-го часа: |
|
|
Минимально выражен (в течение 1-го часа) |
1 |
|
Средней степени выраженности (в течение 1-го часа) |
2 |
|
Средней степени выраженный (в течение 1-го и 2-го часа) |
3 |
|
Максимально выраженный (в течение 1-го и 2-го часа) |
4 |
Данные были проанализированы с помощью программы Statistics 13 (SPSS Inc, США). Предоперационные данные пациента, факторы риска, послеоперационные респираторные инциденты представлялись в виде m±σ или % и сравнивались с применением критерия Стьюдента (T-критерий для зависимых и независимых выборок) или критерия Пирсона (Хи-квадрат), значение р<0,05 считалось статистически значимым. Для определения значимости наиболее влиятельных клинических параметров был применен метод RFECV (Python).
Результаты исследования и их обсуждение
Не было значимых различий между пациентами исследуемых групп по возрасту и исходным данным, в том числе по показателям пробы Штанге, Генче, SpO2 и продолжительности операций (табл. 2).
Таблица 2
Характеристика исследуемых групп по возрасту и исходным клиническим данным (M±σ)
|
Группа, количество |
Возраст |
ИМТ |
Проба Штанге, с |
Проба Генче, с |
SpO2 |
Длительность операции, мин. |
|
1 (n=39) |
36,1±8,8 |
26,5±4,9 |
41,5±6,4 |
28,9±6,3 |
98,6±0,5 |
52,9±17,8 |
|
2 (n=32) |
41,3±9,7 |
28,2±5,2 |
43,1±6,3 |
30,0±6,3 |
98,6±0,6 |
59,5±21,0 |
|
3 (n=37) |
37,7±9,3 |
26,6±4,0 |
43,8±4,7 |
34,5±4,2 |
98,7±0,6 |
57,9±16,9 |
|
4 (n=33) |
40,9±8,9 |
27,3±3,9 |
43,2±5,7 |
33,9±5,6 |
98,8±0,4 |
55,1±17,3 |
|
Достоверность различий между группами: p>0,05. |
||||||
Для определения значимости наиболее влиятельных клинических параметров (факторов риска, клинических данных, значений тестов) на развитие респираторных инцидентов был применен метод RFECV.
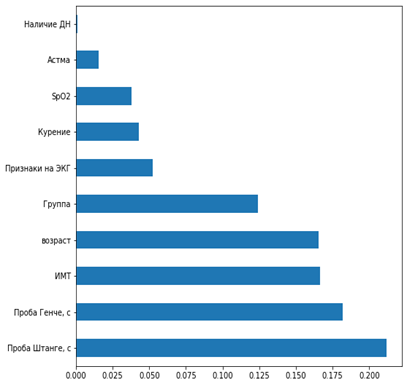
Рис. 1. Значимость наиболее влиятельных критериев на частоту развития кашля в послеоперационном периоде: по оси абсцисс - p-значение в тесте χ²показываетвероятность случайного совпадения (метод RFECV, Python)
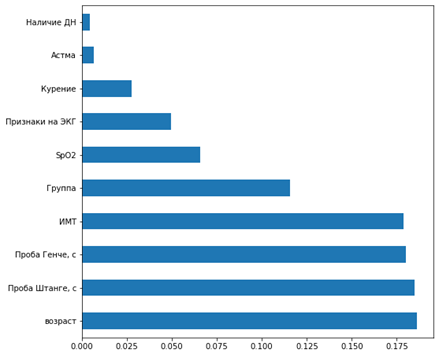
Рис. 2. Значимость наиболее влиятельных критериев на частоту дискомфорта в ротоглотке в раннем послеоперационном периоде: по оси абсцисс - p-значение в тесте χ²показываетвероятность случайного совпадения (метод RFECV, Python)
Как показано на рисунках 1 и 2, наиболее значимыми клиническими критериями, влияющими как на частоту кашля в послеоперационном периоде (p<0,05), так и дискомфорта в ротоглотке (p<0,05), являются наличие дыхательной недостаточности (ДН), астмы, курения и патологических признаков на ЭКГ. На частоту развития кашля также имел влияние исходный уровень SpO2. Не удалось найти зависимость развития респираторных инцидентов в послеоперационном периоде от ИМТ и возраста. Высокие показатели проб Генче и Штанге (в секундах) ассоциировались с минимальным риском развития НРЯ.
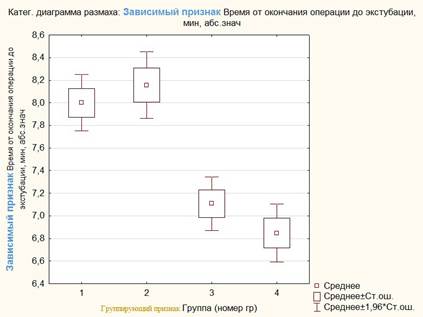
Рис. 3. Время до экстубации у пациенток исследуемых групп
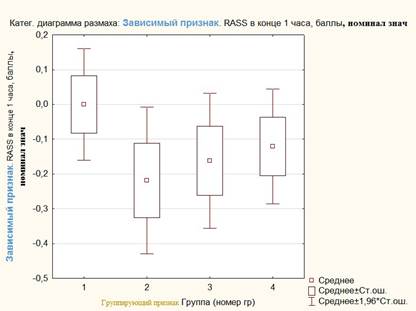
Рис. 4. Оценка по шкале RASS у пациенток исследуемых групп
Период времени до экстубации был короче в группах 3 (7,1±0,7 мин.) и 4 (6,8±0,7 мин.), где для индукции использовался пропофол, по сравнению с группами 1 (8±0,7 мин.) и 2 (8,1±0,8 мин.), где применялся тиопентал (рис. 3). В то же время оценка по шкале RASS через 1 час показала более выраженный уровень сонливости (оценка в баллах «-1») у пациенток 2-й группы, где применялись тиопентал и севофлуран, а состояние бодрствования (оценка в баллах «0») более часто фиксировалось у пациенток из группы 1 (рис. 4).
В раннем послеоперационном периоде (первые 2 часа после пробуждения) кашель был зарегистрирован у 30 пациенток (21,2%), а дискомфорт в ротоглотке - у 91 пациентки (62,33%). Кашель чаще регистрировался в группе 2 – в 11 (34,2%) случаях, и в группе 1 – в 11 (28,0%) случаях. В группе 4 кашель наблюдался только в 1 случае (3%). Однако статистически значимой разницы между группами по частоте развития этого респираторного явления не наблюдается: хи-квадрат Пирсона=12,5, p=0,18 (табл. 3).
Таблица 3
Частота развития и выраженность кашля в послеоперационном периоде в группах
|
Итоговая таблица частот |
||||
|
Кашель, баллы |
Группа 1, n=39 тиопентал + десфлуран |
Группа 2, n=32 тиопентал + севофлуран, |
Группа 3, n=37 пропофол + десфлуран, |
Группа 4, n=33 пропофол + севофлуран, |
|
Кашля нет |
28 (71,7%) |
21 (65,6%) |
30 (81,0%) |
32 (96,9%) |
|
1 |
6 (15,3%) |
5 (15,6%) |
3 (8,1%) |
1 (3,0%) |
|
2 |
4 (10,2%) |
5 (15,6%) |
4 (10,8%) |
0 (0,0%) |
|
3 |
1 (2,5%) |
1 (3,1%) |
0 (0,0%) |
0 (0,0%) |
|
При сравнении ожидаемых частот: хи-квадрат Пирсона=12,5, p>0,05 (0,18). |
||||
Жалобы на дискомфорт в ротоглотке в послеоперационном периоде достоверно чаще предъявляли пациентки группы 1 – 31 (79,3%) случай, достоверно реже – пациентки группы 4 – 18 (51,4%) наблюдений, хи-квадрат Пирсона: 29, p=0,002 (табл. 4).
Таблица 4
Частота развития и выраженность дискомфорта в ротоглотке в послеоперационном периоде в группах
|
Итоговая таблица частот |
||||
|
Дискомфорт, баллы |
Группа 1, n=39 тиопентал + десфлуран |
Группа 2, n=32 тиопентал + севоран |
Группа 3, n=37 пропофол + десфлуран |
Группа 4, n=33 пропофол + севоран |
|
Дискомфорта нет |
8 (20,5%) |
12 (37,5%)* |
17 (45,9%)* |
16 (48,5%)* |
|
1 |
2 (5,1%) |
7 (21,8%) |
8 (21,6%) |
8 (24,2%) |
|
2 |
26 (66,6%)* |
10 (31,2%) |
10 (27,0%) |
7 (21,2%) |
|
3 |
2 (5,1%) |
0 (0,0%) |
0 (0,0%) |
2 (6,0%) |
|
4 |
1 (2,5%) |
3 (9,3%) |
2 (5,4%) |
0 (0,0%) |
|
При сравнении ожидаемых частот: * хи-квадрат Пирсона: 29, p<0,05. |
||||
В группе, где применялось сочетание тиопентала и десфлурана, жалобы на дискомфорт в ротоглотке достоверно чаще выявлялись в виде средней выраженности симптомов в течение 1-го часа после пробуждения – у 26 пациенток (66,6% случаев), p<0,05.
В систематическом обзоре исследования иностранных авторов отмечено, что послеоперационная боль и дискомфорт в горле после общей анестезии встречается более чем у половины взрослых пациентов [3]. Факторами риска этих НРЯ является перенесенная интубация трахеи, женский пол, более молодой возраст, ранее существовавшие заболевания легких, длительная продолжительность анестезии и «трудная интубация», интубация трахеи без нервно-мышечной блокады, высокое давление в манжете интубационной трубки. Часть факторов, влияющих на НРЯ, была исключена из исследования при формировании авторами групп. Результаты авторов согласуются с данными этого систематического обзора (рис. 2).
Пропофол с меньшей частотой вызывает развитие фарингеального дискомфорта и болезненности по сравнению с тиопенталом натрия при использовании надгортанных воздуховодных устройств [8]. Эти выводы согласуются с результатами, полученными авторами данной статьи: в группах, где применялся пропофол, достоверно ниже частота НРЯ, связанных с дискомфортом в ротоглотке (табл. 4). Применение пропофола для поддержания анестезии имеет более благоприятный исход в плане развития фарингеальных и ларингеальных нежелательных явлений и рефлексов, связанных с применением ЛМ, по сравнению с севофлураном [9].
В проспективном рандомизированном контролируемом исследовании были представлены результаты сравнения влияния севофлурана и десфлурана на степень тяжести послеоперационной боли и дискомфорта после тиреоидэктомии. Авторами сделаны выводы, что проявления послеоперационной боли и дискомфорта не зависели от типа ингаляционного анестетика [10]. Синергические взаимодействия в анестезиологии могут быть клинически полезными, если они потенциально уменьшают побочные эффекты. Однако синергизм также может быть связан с усилением побочных эффектов. Ингаляционные анестетики обычно демонстрировали синергизм с внутривенными анестетиками [11]. Для гипнотиков/анестетиков характерно аддитивное поведение [12], и их одновременное применение только способствует увеличению числа нежелательных явлений, как основных, так и побочных, поскольку каждое отдельное действие не суммируется, а усиливается. Результаты исследований авторов статьи также подтверждают, что именно сочетание препаратов и их взаимодействие повышают риск усиления побочных эффектов и возникновение НРЯ в виде дискомфорта и кашля в раннем послеоперационном периоде.
Десфлуран и севофлуран, как и пропофол, вызывают бронходилатацию, однако десфлуран обладает выраженным раздражающим эффектом на верхние дыхательные пути. Севофлурановая анестезия может ослабить кашлевой рефлекс за счет ингибирования легочных рецепторов, как показано в одном из исследований авторов в оптимальном сочетании с пропофолом [13]. Рандомизированное исследование других исследователей показало, что десфлуран достоверно чаще вызывает кашель при стандартной МАК [14]. В исследованиях авторов статьи кашель также регистрировался чаще в группах с десфлураном и реже – при сочетании севофлурана с пропофолом (всего в 3%), однако разница не была достоверной.
При анализе литературы также было найдено исследование, где авторы показали, что десфлуран достоверно чаще, по сравнению с севофлураном и пропофолом, во время общей анестезии с ремифентанилом сужает n-GOA (normalized glottic opening area) и повышает PIPП. Причины возникновения кашля, появляющегося при использовании ингаляционных анестетиков, обусловлены преимущественно влиянием на инспираторную фазу за счет раздражения рецепторов блуждающего нерва в кашлевых рефлексогенных зонах. Анализ полученных данных также показал, что у курильщиков кашель встречается чаще. Эти выводы подтверждаются результатами, приведенными авторами данной статьи [15].
Выводы
1. В раннем послеоперационном периоде кашель чаще регистрировался в группах с тиопенталом в сочетании с севофлураном (34%) или с десфлураном (28% наблюдений), однако разница была недостоверной. При этом в группе, где применялись пропофол и севофлуран, кашель практически не наблюдался.
2. Жалобы на дискомфорт в ротоглотке достоверно чаще предъявляли пациенты женского пола 1-й и 2-й групп, в которых применялось сочетание тиопентала с десфлураном (79%) или севофлураном (62%), (p<0,05).
3. Наиболее значимыми клиническими критериями, влияющими на частоту НРЯ (кашля и дискомфорта) в послеоперационном периоде (p<0,05), являются наличие в анамнезе сопутствующей респираторной патологии и вредной привычки – курения.
Заключение
Таким образом, выбор комбинации внутривенных гипнотиков и ингаляционных анестетиков может влиять на частоту развития кашля и дискомфорта в дыхательных путях у пациентов гинекологического профиля после операций: наиболее комфортно ранний послеоперационный период протекает при использовании комбинации пропофола и севофлурана.



