Введение
На основе данных мировой литературы была обнаружена тесная связь между глобальным дефицитом витамина D и стремительным ростом случаев аутоиммунных заболеваний, особенно с гранулематозным типом воспаления (таких как саркоидоз, гранулематоз с полиангиитом, болезнь Крона и др.), этиология и патогенез которых до конца не изучены [1, 2, 3]. Данная взаимосвязь обусловлена различными иммуномодулирующими эффектами лиганд-ассоциированной активации рецепторов к витамину D [4]. Тем не менее, влияние витамина D и его аналогов (парикальцитола) на патогенез аутоиммунного воспаления с позиций влияния на распределение клеток Лангерганса остается недостаточно изученным.
На основании вышеизложенного была специально создана гранулематозная модель в виде саркоидозподобного аутоиммунного воспаления путем трансформации модели, описанной Yan Huang и соавторами [5]. В работе индуцированное аутоиммунное воспаление (ИАВ) было вызвано искусственно синтезированным пептидом супероксиддисмутазы А (SОD А). SOD A – это фермент, синтезируемый в клетках, который играет ключевую роль в антиоксидантной защите организма, катализируя превращение супероксидного радикала в перекись водорода и молекулярный кислород, что позволяет клеткам выживать в условиях оксидативного стресса [6].
Выбор саркоидозподобного воспаления основан на следующих факторах.
1. Саркоидоз считается эталоном для изучения гранулем, поскольку многие аутоиммунные гранулематозные заболевания могут клинически и морфологически подражать саркоидозу [7].
2. Исследователи выявили, что воспаление у животных, индуцированное SOD А, демонстрирует наличие морфологического и иммунофенотипического профилей саркоидоза, которые тесно взаимосвязаны с профилями при саркоидозе у человека [8].
3. Установлена отрицательная обратная связь между уровнем эндогенного витамина D и тяжестью аутоиммунного процесса, включая саркоидоз [9].
CD1a (cluster of differentiation 1a) является специфическим маркером клеток Лангерганса, которые представляют собой уникальный подвид эпидермальных дендритных клеток [10]. Хотя клетки Лангерганса инициируют как врожденные, так и адаптивные иммунные ответы на антигены, их иммунологические функции в очаге аутоиммунного гранулематозного воспаления остаются неизвестными. Целью данной работы является изучение морфологических особенностей распределения популяции клеток Лангерганса, экспрессирующих маркер CD1a, в очаге ИАВ на фоне введения парикальцитола.
Материалы и методы исследования
Эксперимент над животными проводили в соответствии: с Директивой Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22.09.2010 г. о защите животных, использующихся для научных целей, с Федеральным законом от 27.12.2018 г. № 498-ФЗ (ред. от 27.12.2019) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации», а также с учетом рекомендаций этического комитета ФГАОУ ВО «Крымский федеральный университет имени В.И. Вернадского» (протокол № 9 от 27.10.2022 г.).
Экспериментальная работа выполнена на 40 самцах крыс. В качестве чужеродного антигена использовали искусственно синтезированный пептид SОD А, который является специфическим триггером саркоидоза. Данный пептид был синтезирован в компании AtaGenix Laboratories (Ухань, КНР) в 2023 г. Одновременно, с целью индукции аутоиммунного воспаления, каждой крысе в область задней поверхности шеи вводили 0,25 мл полного адъюванта Фрейнда (InvivoGen, Франция), в котором предварительно растворили 0,05 мг SОD А. Спустя 10 дней каждой крысе повторно вводили 0,05 мг SОD А, которые предварительно растворили в 0,25мл изотонического раствора.
Крыс с ИАВ случайным образом распределили в 4 группы (по 10 крыс в каждой группе): контрольная группа (КГ) с ИАВ, группа с ИАВ на фоне лечения парикальцитолом, который начали давать за 10 дней до сенсибилизации антигеном (П1), группа с ИАВ на фоне лечения парикальцитолом, который начали давать в день сенсибилизации антигеном (П2), и группа с ИАВ на фоне лечения парикальцитолом, который начали давать через 10дней после сенсибилизации антигеном (П3).
Животные с ИАВ в качестве иммунной коррекции получали искусственный витаминD парикальцитол (Земпалар®, Италия), который оказывает минимальное влияние на фосфорно-кальциевый обмен. Лекарственное вещество вводили внутрибрюшинно по средней линии живота из расчета 200 нг/животное каждые 3 дня. На 35-е сутки эксперимент завершили путем парентерального введения 0,1%-ного раствора медетомидина из расчета 0,2мл/животное. После эвтаназии и аутопсии животных были получены образцы тканей в области задней поверхности шеи. В течение суток патологические образцы фиксировали в 10%-ном формалине. Далее осуществили проводку с использованием возрастающей концентрации этанола (начиная с 70% и заканчивая 100%). Для просветления использовали чистый ксилол без разбавления с последующим заключением образцов в парафин. Эти манипуляции были выполнены с помощью модуля Leica EG1150 (Leica Biosystems, Германия) и гистологического процессора Logos (Milestone Medical, Италия). Гистологические срезы стандартной толщины (4 мкм) были приготовлены на автомикротоме Leica RM2255 (Leica Biosystems, Германия). Для оценки морфологических изменений срезы окрашивали гематоксилином и эозином.
Для иммуногистохимического анализа экспрессии маркера CD1a использовали полуавтоматический иммуногистайнер BondMax (Leica Biosystems, Германия). Далее проводили окрашивание в соответствии с рекомендациями производителя с использованием раствора Bond Epitope Retrieval 2 (Leica Biosystems, Германия) и визуализацией с применением системы Bond Polymer Refine (Leica Biosystems, Германия). Этот протокол включает депарафинизацию, высокотемпературную демаскировку, подавление эндогенной пероксидазы, инкубацию с первичными и вторичными антителами и контрастное окрашивание гематоксилином. Между всеми этапами проводили промывку буфером. Для обнаружения клеток Лангерганса в очаге аутоиммунного воспаления использовали специфические поликлональные антитела против CD1a IgG (кат. #DF13391; Affinity Biosciences ®, КНР).
После получения гистологических и иммуногистохимических образцов провели сканирование с помощью гистологического сканера Aperio CS2 (Leica Biosystems, Германия). Полуколичественным методом оценивали степень позитивного окрашивания (сильная реакция, умеренная реакция, минимальная реакция или ее отсутствие).
Морфологический анализ цифровых иммуногистохимических изображений проводили с использованием программного обеспечения Aperio ImageScope (Leica Biosystems, Германия) и ImageJ.14 (NIH, США) [11].
Статистический анализ был проведен с использованием программного обеспечения Statistica (версия 10, StatSoft, Inc., США) и Microsoft Office Excel (версия 16, Microsoft, США). Результаты исследования выражены в виде медианы (Ме), первого (Q1) и третьего (Q3) квартилей. Статистически значимым считали значение p<0,05.
Результаты исследования и их обсуждение
На момент выведения животных из эксперимента формирование саркоидозподобного воспаления подтверждали наличием у животных не только гистопатологических признаков воспаления в виде наличия неказеозных иммунных гранулем, но и макроскопических признаков увеличения лимфатических узлов в области задней поверхности шеи и подмышечной впадине (билатерально). При иммуногистохимическом анализе во всех исследуемых образцах выявили наличие CD1а+ клеток с выраженной или умеренной мембранной иммунопозитивной реакцией. В частности, в контрольной группе выявили единичные иммунопозитивные клетки, экспрессирующие маркер CD1a. Эти клетки были обнаружены в основном в межгранулемных областях на фоне незрелых иммунных гранулем. Также стоит отметить, что была обнаружена иммунонегативная реакция в центральной и периферической области иммунной гранулемы (рис. 1).
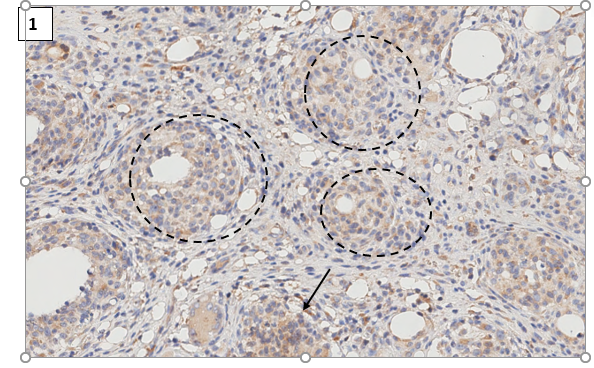
Рис. 1. Экспрессия CD1a в коже (дерме) контрольной крысы с индуцированным аутоиммунным воспалением. CD1а+ клетки в гранулематозном инфильтрате. Иммуногистохимическая реакция с антителами против CD1а антигена. Ув.х400
Примечание: пунктирная линия – незрелые гранулемы, стрелка – клетка Лангерганса
Спустя 35 суток после введения первой дозы парикальцитола у экспериментальных животных группы П1 отмечали наличие сильно положительной экспрессии маркера CD1a не только в межгранулемных областях, но и в перифокальной области, которая окружала зрелые и созревающие иммунные гранулемы (рис. 2). Интересно, что после парентерального введения парикальцитола у экспериментальных животных группы П2 выявили аналогичную иммунопозитивную реакцию, которую определяли не только в перифокальной, но и в центральной области иммунной гранулемы (рис. 3).
Оценивая экспрессию мембранного маркера CD1а в образцах тканей, полученных от крыс группы П3, выявили иммунонегативную реакцию, которая соответствовала контролю (рис. 4). Эти изменения можно объяснить тем, что группа П3 получала парикальцитол значительно меньше по сравнению с другими группами, а также меньшим влиянием парикальцитола на формирование иммунной гранулемы после повторного контакта с антигеном. Это может быть связано с тем, что повторный контакт с антигеном активирует внутриклеточные пути, которые стимулируют иммунные клетки, и ингибирует пути, связанные с лиганд-ассоциированной активацией рецепторов к витамину D.
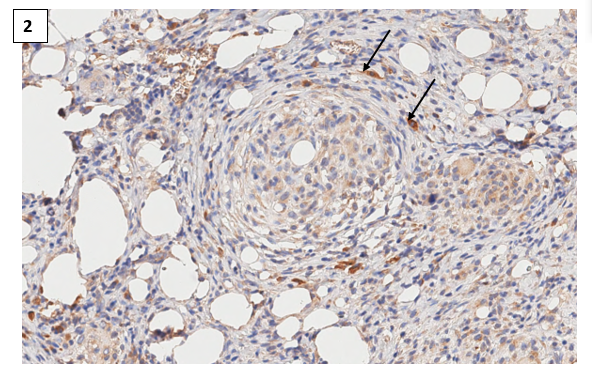
Рис. 2. Экспрессия CD1a в коже (дерме) крысы с индуцированным аутоиммунным воспалением (группа П1). CD1а+ клетки в перифокальной области гранулемы. Иммуногистохимическая реакция с антителами против CD1а антигена. Ув.х400
Примечание: стрелка – клетка Лангерганса
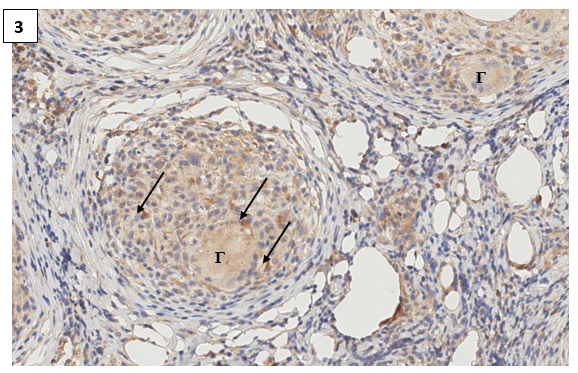
Рис. 3. Экспрессия CD1a в коже (дерме) крысы с индуцированным аутоиммунным воспалением (группа П2). CD1а+ клетки в центральной части зрелой иммунной гранулемы. Иммуногистохимическая реакция с антителами против CD1а антигена. Ув.х600
Примечание: стрелка – клетка Лангерганса, Г – гигантские клетки Пирогова–Лангханса
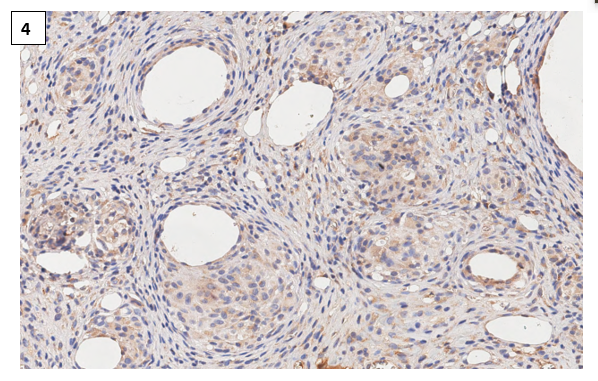
Рис. 4. Экспрессия CD1a в коже (дерме) крысы с индуцированным аутоиммунным воспалением (группа П3). Отсутствие CD1а+ клетки в гранулематозном инфильтрате. Иммуногистохимическая реакция с антителами против CD1а антигена. Ув.х400
При изучении уровня экспрессии маркера CD1a каких-либо статистически достоверных различий между группой КГ – 3,0 [2,0; 6,0] – и П1 – 4,0 [2,0; 6,5], а также между КГ – 3,0 [2,0; 6,0] – и П3 – 3,0 [1,0; 4,0] – выявлено не было (р=0,80 и р=0,24 соответственно). В группе П2 количество CD1a+ клеток было статистически достоверно выше в cравнении с соответствующим показателем в группе контроля и составляло 11,0 [8,0; 15,5] (на 266,6%, р=0,002). Эти изменения можно объяснить тем, что парикальцитол по-разному влияет на активность клеток Лангерганса. Это зависит, с одной стороны, от того, происходит ли контакт с антигеном или нет, с другой стороны – на каком этапе формирования иммунной гранулемы произошел этот контакт – в период сенсибилизации или разрешения. Это подтверждалось данными статистического сравнения плотности клеточной популяции CD1a+ клеток П1 и П2, которая претерпевала характерные изменения, проявляющиеся в увеличении популяции CD1a+ клеток после контакта с антигеном (на 175%, р=0,01).
Результаты исследования показали, что введение парикальцитола приводило к значительному увеличению количества CD1a+ клеток в тканях на фоне созревания иммунной гранулемы. Количество CD1a+ клеток в группе П2 было выше в сравнении с контрольной группой, что указывает на активизацию клеток Лангерганса и усиление их способности к презентации антигенов.
Увеличение экспрессии CD1a может также свидетельствовать о том, что парикальцитол влияет на созревание дендритных клеток в момент первичного контакта с антигеном, повышая их функциональную активность и, следовательно, улучшая иммунный ответ. Эти данные согласуются с исследованиями, показывающими, что витамин D и его аналоги способны модулировать иммунный ответ, способствуя активации клеток, ответственных за воспаление [12, 13].
Заключение
Парентеральное введение парикальцитола в дозе 200 нг увеличивает количество CD1a+ клеток в группе животных, которым давали парикальцитол с момента сенсибилизации антигеном, на 267% по сравнению с контрольной группой (р=0,002). Это указывает на наличие рецепторов к витамину D на клетках Лангерганса, а также на значительное влияние парикальцитола на CD1a+ клетки при формировании и созревании гранулемы, особенно на этапе первичного контакта с антигеном. Полученные результаты свидетельствуют о терапевтическом потенциале парикальцитола в лечении гранулематозных заболеваний путем восстановления пула специализированных дендритных клеток.
Автор выражает особую благодарность старшему преподавателю кафедры физики конденсированных сред, физических методов и информатики в медицине Физико-технического института КФУ Глушенкову А.Н. за оказанную помощь при написании настоящей статьи.



