Рецидив обструкции пиелоуретерального сегмента (ПУС) после первичного хирургического лечения у детей возникает в диапазоне от 5 до 11% случаев [1-3]. Этиология повторных нарушений представляет собой комплекс различных факторов. Чаще всего к рецидиву гидронефроза приводит нарушение техники оперативного вмешательства [3-5]. Однако и особенности самого пациента могут оказаться причиной развития повторной обструкции ПУС (нарушение процессов заживления тканей и изменение возрастной топографии) [6; 7].
Целью настоящего исследования стало выявление взаимосвязи морфологических изменений в удаленных тканях ПУС после пиелопластики у детей с возникновением рецидива гидронефроза.
Материал и методы исследования. Проведено проспективное закрытое когортное нерандомизированное исследование удалённых тканей ПУС от 27 детей с врождённым гидронефрозом. Возраст пациентов был от 5 месяцев до 12 лет. Критерий включения – наличие факта пластической операции на пиелоуретеральном сегменте. Критерий исключения: сопутствующая патология органов мочевыделительной системы с ипсилатеральной стороны.
Для морфологической характеристики здоровой стенки мочеточника был исследован аутопсийный материал от 10 детей в возрасте от 5 дней до 1 года, умерших от интеркуррентных заболеваний.
Набор пациентов осуществлялся в период с декабря 2020 года по декабрь 2021 года. После извлечения удаленных тканей ПУС проводилось измерение длины стенозированного участка и отступа в сторону дистального края резекции (мм) с помощью хирургической линейки, затем осуществлялась маркировка со стороны дистального конца резецированного сегмента. Операционный материал проходил стандартные этапы изготовления гистологических препаратов. Для оценки структуры слоев ткани окрашивались гематоксилином и эозином. Были изучены морфометрические параметры и определен структурный тип изменений мышечного слоя в области стеноза и дистального края резекции.
Дополнительно срезы окрашивались по Ван Гизону, при этом элементы соединительной ткани становятся ярко-розовыми, а мышечные волокна – желтовато-оранжевыми. На основании соотношения цветовых спектров был рассчитан коллагеново-мышечный индекс (КМИ) и математически описана структура мышечного слоя.
КМИ был разработан в 2000 году для числовой характеристики степени фиброза и склероза в мышечном слое мочеточника [8]. Индекс рассчитывается на оцифрованных изображениях тканей и представляет собой соотношение цветовых спектров, отвечающих за соединительнотканные и мышечные волокна соответственно. Авторы методики сопоставили полученные значения с исходом пиелопластики и пришли к выводу, что при значениях до 1,5 наблюдалась прямая взаимосвязь с успешностью проведенного вмешательства в отношении восстановления функции почки и отсутствия рецидива. В 2019 году были предложены скорректированные интервальные значения КМИ для дистального края резекции, которые указывают на благоприятный исход пиелопластики при <1,2 [9].
В настоящем исследовании авторы обозначили ярко-розовый цвет коллагеном, поскольку он представляет собой большую часть внеклеточного матрикса. Анализ оцифрованных цветных изображений с разрешением 16,7/106 был выполнен с использованием программного обеспечения для биологического сканирования Tiny Eye labs, Copyright © 2017 Idée Inc. Рассчитывалось процентное соотношение цветовых спектров, что интерпретировалось как значение КМИ.
Спустя год авторы оценили взаимосвязь полученных значений с исходом пиелопластики. Клинико-инструментальное наблюдение осуществлялось через 3, 6 и 12 месяцев после оперативного лечения посредством осмотра, общих лабораторных исследований и проведения ультразвукового исследования почек (УЗИ) с доплерографией.
Этическая экспертиза. Авторы получили письменное согласие пациентов (их представителей) на обработку ипубликацию персональных данных.
Статистический анализ. Материалы исследования были подвергнуты статистической обработке с использованием программы IBM.SPSS Statistics, версия 26 (2019). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка или критерия Колмогорова–Смирнова. Вариационные ряды количественных признаков с параметрическим характером распределения были описаны с помощью средних арифметических величин (M), средних квадратических отклонений (σ) по стандартным формулам; с непараметрическим характером - с помощью медианы (Me) и процентилей [P25; P75]. Сравнение двух групп по количественному показателю, распределение которого было нормальным при равенстве дисперсий, выполнялся с помощью t-критерия Стьюдента. Сравнение двух связанных выборок по количественному показателю при нормальном распределении осуществлялось с помощью парного t-критерия Стьюдента, а сравнение трех связанных выборок – с помощью анализа ANOVA с повторными измерениями.
Результаты исследования и их обсуждение
Исследуемым пациентам проводилась резекция пиелоуретерального сегмента в пределах макроскопически здоровых тканей. Патологический участок мочеточника, подлежащий резекции, был определен по ряду признаков: сужение просвета, ригидность тканей, отсутствие характерной трабекулярности уротелия.
Причиной обструкции у 20 детей явился стеноз ПУС, у 7 – вазоуретеральный конфликт. Протяженность стенозированного участка составила 10,0 мм [Qmin-Qmax: 4,0;20,0]. Отступ в сторону здоровых тканей мочеточника осуществлялся в среднем на 3 мм [Qmin-Qmax: 1,0;6,0]. Оперативное лечение проведено без технических сложностей в 100% случаев. Осложнений в раннем послеоперационном периоде (до 28 дней после пиелопластики) ни у одного пациента не наблюдалось.
В норме структура мышечного слоя в области ПУС представлена двумя слоями гладкомышечных пучков. Внутренний слой (меньшей толщины) представлен продольно ориентированными пучками, а наружный - циркулярно ориентированными. Пространство между мышечными пучками выполнено рыхлой соединительной тканью.
При гидронефрозе определены два структурных типа изменений ПУС (рис.).
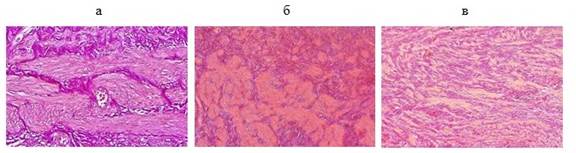
Изменения ПУС в норме и при гидронефрозе, окраска по Ван Гизону: а) аутопсийный материал; б) 1-й тип изменений ПУС; в) 2-й тип изменений ПУС
При 1-м типе (n=24) мышечный слой имел характерную слоистость, мышечные волокна были сформированы в пучки, которые были очагово гипертрофированы и фрагментированы. Межмышечное пространство заполнено избыточно развитой соединительной тканью с явлениями фиброза и склероза. На некоторых участках определялась дискоординация мышечных пучков (отсутствие нормального разделения на слои).
При 2-м типе (n=3) мышечная оболочка не имела слоистости и была представлена многочисленными тонкими хаотично направленными гладкомышечными пучками с вкрапленными между ними коллагеновыми волокнами.
При достаточном объеме резекции в области дистального края резекции должно определяться появление обоих слоев мышечной оболочки, увеличение количества нормально сформированных мышечных пучков, а также уменьшение соединительнотканных волокон с фиброзом и склерозом.
Морфометрическая оценка удаленных фрагментов показала, что средняя толщина мышечного слоя отличалась у детей в норме и при разных типах изменений ПУС (табл. 1).
Таблица 1
Морфометрическая оценка мышечного слоя ПУС
|
Толщина мышечного слоя, мкр/ Muscle layer thickness, µm |
Тип изменений ПУС/ Type of UPJ change |
Аутопсийный материал (3)/ Autopsy |
р |
|
|
1-й тип (n=24) |
2-й тип (n=3) |
|||
|
480,6±137,2 |
677,5±137,9 |
107,1±24,6
|
<0,05* р1-2<0,05 р1-3<0,05 р2-3<0,05
|
|
Примечания: * - изменения показателей статистически значимы (p <0,05). ПУС – пиелоуретеральный сегмент; р - дисперсионный анализ с повторными измерениями.
В норме толщина мышечного слоя ПУС значительно меньше, чем при патологических изменениях (р <0,05). Это связано с тем, что при гидронефрозе отмечается разрастание склеротической ткани, которая увеличивает общий объем мышечного слоя. При 2-м типе изменений ПУС определялись наибольшие значения в связи с обилием как соединительнотканных волокон, так и мышечных пучков.
Полученные значения КМИ в норме и при патологических изменениях ПУС приведены в таблице 2.
Таблица 2
Коллагеново-мышечный индекс в здоровом мочеточнике и при гидронефрозе
|
Тип изменений ПУС/ Type of UPJ change |
КМИ /CMR |
р |
|
|
Стеноз/ Stenosis |
Мочеточниковый край/ Ureteral margine |
||
|
1-й тип/1 type (n=24) |
1,14±0,42 |
0,91±0,43 |
0,018* |
|
2-й тип/ 2 type (n=3) |
1,0±0,1 |
1,07 ±1,1 |
0,067 |
|
Аутопсийный материал/ Autopsy (n=10) |
0,78±0,23 |
0,78±0,23 |
- |
|
Однофакторный дисперсионный анализ/ ANOVA |
0,035* р1-3<0,05 |
>0,05 |
|
Примечания: * - изменения показателей статистически значимы (p<0,05). КМИ – коллагеново-мышечный индекс; ПУС – пиелоуретеральный сегмент; р – t-критерий Стьюдента.
Отмечаются статистически значимые различия КМИ в области стеноза в норме и при гидронефротических изменениях (p=0,035). Выявлено, что в норме КМИ не превышает 1,0, что говорит о превалировании мышечного компонента.
В области стенозированного участка при 2-м типе значения индекса были близки к норме в связи с обилием мышечных пучков наряду с соединительнотканными, а при 1-м типе во всех случаях превышали норму.
К дистальному краю резекции у пациентов с 1-м типом изменений происходило значимое снижение значения КМИ (р = 0,018). При 2-м типе индекс значимо не менялся (p>0,05), что говорит о смене структуры, но не количества мышечных волокон. Поэтому при расчете значения индекса важно учитывать гистологический тип изменений ПУС.
Дополнительно проведен анализ значения КМИ при 1-м типе изменений в зависимости от возраста (табл. 3).
Таблица 3
Возрастные изменения КМИ у детей с низкой степенью дисплазии ПУС
|
Возраст/ Age |
КМИ в мочеточниковом крае /CMR in ureteral margine |
р |
|
0-1 год (1) |
1,0 ± 0,4 (n=5) |
0,045* р1-2; р1-3; р1-4<0,05* |
|
1-3 года (2) |
0,84 ±0,5 (n= 6) |
|
|
4-7 лет (3) |
0,82±0,5 (n=8) |
|
|
9-18 лет (4) |
0,82± 0,2 (n=3) |
Примечания: * - изменения показателей статистически значимы (p <0,05). КМИ – коллагеново-мышечный индекс; ПУС – пиелоуретеральный сегмент; р – критерий Краскела–Уоллиса.
Выявлено, что после 1-го года жизни происходит увеличение процента мышечной ткани (р = 0,045), поэтому референсные значения индекса должны учитывать еще и возрастной фактор.
Наблюдение детей после пиелопластики проводилось в течение года. Выздоровление определялось спустя год при сокращении размеров коллекторной системы и увеличении толщины паренхимы в сравнении с дооперационными показателями, а также при полном восстановлении кровотока по данным цветового доплеровского картирования и индексов резистентности.
В результате у 25 из 27 оперированных пациентов отмечался благоприятный исход.
У 2 детей возник рецидив. Единственным отличием от детей без рецидива было сохранение структурных изменений мышечного слоя к дистальному краю резекции.
У первого пациента (возраст 6 лет) макроскопически стенка мочеточника в области края резекции имела нормальную толщину, что создавало впечатление здоровой ткани. Протяженность патологического участка составила 7,0 мм, а отступ от зоны стеноза – 2,0 мм. Микроскопически определялся 1-й тип изменений, однако с аплазией внутреннего слоя на всём протяжении. В области дистального края резекции сохранялись патологические изменения: мышечный слой был представлен исключительно гипертрофированными циркулярно ориентированными пучками. В дальнейшем это привело к обструкции ввиду порочной перистальтики. В связи с достаточным количеством мышечного компонента показатели КМИ значимо не менялись к дистальному краю резекции и составили 0,78 и 0,74 соответственно (p>0,05). У данного пациента сразу после прекращения дренирования коллекторной системы развилось выраженное нарастание чашечно-лоханочной системы (ЧЛС), потребовавшее экстренной деривации мочи посредством пункционной нефростомии. Обструкция была подтверждена по данным пиелографии и уретерофиброскопии, и спустя 6 месяцев после первичного вмешательства проведена повторная пиелопластика.
У второго пациента (возраст 1 год 10 месяцев) определялся протяженный участок стеноза (до 20,0 мм), а отступ в дистальную сторону составил 1 мм. КМИ составил 1,0 и не менялся к дистальному краю резекции (p>0,05). У данного ребенка спустя месяц после удаления внутреннего стента развилась клиника «блока почки»», что потребовало экстренной госпитализации. Для декомпрессии ЧЛС был установлен внутренний стент. Спустя 6 месяцев стент был удален, после чего отмечалась отрицательная динамика, что послужило показанием к проведению повторного вмешательства.
В проведенном исследовании авторам не удалось доказать влияние КМИ на исход пиелопластики в отношении возникновения повторной обструкции. В работах других авторов колориметрический расчёт в пиелоуретеральном сегменте проводился вне зависимости от структурного типа изменений ПУС, макроскопической протяженности патологического участка и отступа в сторону дистального края резекции, что могло значимо повлиять на результаты проведенных ими исследований [8-10].
Авторами выявлено, что при 2-м типе изменений ПУС количество мышечных пучков будет увеличено наряду с соединительнотканными, КМИ составит менее 1, однако такой участок мочеточника не будет способен к нормальной уродинамике. Поэтому важно не столько опираться на отдельные морфометрические и колориметрические показатели, сколько учитывать сохранение структурных изменений в области дистального края резекции.
В качестве методов профилактики рецидива авторы рекомендуют проведение более протяженной зоны резекции с достаточным отступом от зоны стеноза (более 5 мм) в сторону здоровой ткани мочеточника, при необходимости прибегая к дополнительной мобилизации почки и мочеточника. Для объективной оценки объема дисплазии, в особенности при сложностях её визуальной интерпретации, авторы рекомендуют выполнение срочного гистологического исследования тканей дистального края резекции путем создания криостатных срезов, что возможно осуществить на этапе выполнения оперативного вмешательства.
Заключение. В результате проведенного авторами исследования приведена подробная гистологическая характеристика удаленных тканей после пиелопластики. Определены структурные и морфометрические отличия разных типов изменений мышечного слоя ПУС у детей с врождённым гидронефрозом. Комплексная морфологическая оценка тканей в области стеноза и дистального края резекции ПУС позволила определить соответствие визуальной длины патологического участка с протяженностью гистологических изменений. В результате исследования авторами выявлено, что единственным предиктором развития рецидива является сохранение структурных изменений в области дистального края резекции. Поэтому выполнение адекватного объема резекции мочеточника и интраоперационной экспресс-биопсии позволит профилактировать развитие рецидива гидронефроза.



