Современные требования, которые предъявляются к алгоритму выполнения оперативного вмешательства, подразумевают в том числе сокращение времени выполнения хирургической операции, повышение её результативности, снижение риска развития осложнений и уменьшение расходов, в частности трансфузионных средств [1-3]. Данные условия возможно соблюсти только при помощи адекватного интраоперационного гемостаза. Особенно это касается вмешательств на паренхиматозных органах, поскольку капиллярное кровотечение опасно при травмах, например печени и селезенки, наблюдается массивное кровотечение, которое сложно диагностируется на ранних этапах, но при этом приводит к массивной кровопотере и летальному исходу.
Доступный в настоящее время спектр гемостатических средств, обладающих различными механизмами действия, разнообразен по своему химическому строению и составу. В качестве матрицы для производства данных медицинских изделий традиционно используют коллаген и его гидролизаты (желатин, окисленную форму целлюлозы), фибрин, альбумин, различные виды полисахаридов, неорганические вещества, различные полимеры растительного происхождения, а также синтетические химические соединения и многие другие [4-6].
Применяющиеся интраоперационно гемостатические средства из таких производных целлюлозы, как окисленная форма полимера, метилцеллюлоза, карбоксиметилцеллюлоза, заслуживают особого внимания. Биологическая инертность обуславливает отсутствие местной реакции окружающих тканей. Неоспоримым преимуществом аппликационных гемостатических средств на основе производных целлюлозы являются высокие темпы биодеградации, приводящие к элиминации полимера, не обеспечивая длительный эффективный гемостаз [7]. В свою очередь, коллаген способен вызвать реакцию местных тканей в ответ на имплантацию средств на его основе, однако он обладает более низкими темпами биодеградации, что позволяет пролонгировать гемостатический эффект [8].
Цель исследования: сравнительная оценка выраженности спаечного процесса в качестве реакции тканей на применение местных кровоостанавливающих средств в форме порошка в хроническом эксперименте in vivo.
Материал и методы исследования. Исследование проводили на самцах-кроликах породы советская шиншилла массой 3-3,5 кг, n=30. Животные были равномерно распределены на группы согласно объектам исследования: гемостатические порошки Arista AH (далее – группа № 2), натриевая соль карбоксиметилцеллюлозы (NaКМЦ) medium viscosity (далее – группа № 3). В качестве контроля использовали коагуляционный метод остановки кровотечения (группа № 1).
Исследование выполняли под контролем регионального этического комитета при ФГБОУ ВО «КГМУ» Минздрава России (протокол № 3 от 16.11.2020 г.) с соблюдением национальных и международных стандартов гуманного обращения с животными, используемыми в экспериментальных целях. Все исследования проводились в асептических условиях операционного блока под наркозом лаборатории экспериментальной хирургии и онкологии НИИ экспериментальной медицины КГМУ. Животные содержались на базе экспериментально-биологической̆ клиники КГМУ, где они на всем протяжении эксперимента имели круглосуточный доступ к пище и воде [9].
Для подготовки к операции животных фиксировали на операционном столе в положении лежа на спине. С целью проведения общей анестезии применяли ингаляционный масочный наркоз (концентрация изофлюрана во вдыхаемой̆ газовой смеси – 3%, поток воздуха – 1 л/мин.) [9].
Оперативное вмешательство проводили под контролем видеоэндоскопического оборудования. После стандартной обработки операционного поля в стерильных условиях в мезогастрии при помощи иглы Veresh была выполнена пункция брюшной полости, наложен карбоксиперитонеум с предустановленными параметрами инсуффляции (давление 7 мм рт. ст., поток 1 л/мин.). Ревизию брюшной полости с идентификацией печени проводили при помощи 5-мм эндоскопа, введенного через 5-мм троакар. Затем для инструментов-манипуляторов последовательно устанавливали 2 троакара диаметром 3 и 5 мм [10].
При помощи 3-мм эндоскопического зажима и 5-мм ножниц выполняли тангенциальную резекцию паренхимы средней доли печени и радиально, отступая от нижнего края доли 12 мм (длина браншей 3-мм эндоскопического зажима). Затем, путем помещения гемостатического порошка (ГП) в замкнутую герметичную ёмкость с двумя отверстиями, при помощи подключенного к одному из отверстий компрессору в данной емкости создавали повышенное давление. В режиме постоянной подачи давления порошок распыляли на раневую поверхность при помощи 5-мм поливинилхлоридной трубки, подведенной через лапароскопический порт и подключенной к емкости с порошком. В послеоперационном периоде антибактериальная терапия животным не проводилась.
Каждому животному была проведена контрольно-диагностическая лапароскопия (КДЛ) на 1-е, 3-и и 7-е сутки после моделирования травмы печени. Макроскопически оценивали: морфологию и выраженность спаечного процесса по методам, разработанным профессором Липатовым В.А. [11], распространенность спаечных сращений по модифицированному методу, предложенному О.И. Блинниковым. Животные были выведены из эксперимента под наркозом методом цервикальной дислокации на 14-е послеоперационные сутки [12; 13].
При сравнении данных, полученных в ходе выполнения контрольно-динамической лапароскопии, с учетом их качественного оценочного характера и применения балльной системы для определения уровня статистической значимости использовали критерий χ2 [10]. Считали допустимой для экспериментальных медико-биологических исследований ошибку 5% (уровень p≤0,05). В качестве программного обеспечения использовали программу Statistica 13.0 pro (производитель Dell Software Company, Round Rock, Texas, United States of America) [14; 15].
Результаты исследования и их обсуждение. При оценке морфологии и распространенности спаечного процесса по результатам эксперимента в каждой из исследуемых групп были получены результаты, представленные в таблицах 1 и 2.
Таблица 1
Распространенность спаечного процесса в брюшной полости лабораторных животных, n
|
№ группы |
Название группы |
1-е сутки |
3-и сутки |
7-е сутки |
|
1. |
Электрокоагуляция |
0 |
2 |
3 |
|
2. |
Arista AH |
0 |
2 |
1 |
|
3. |
NaКМЦ medium viscosity |
0 |
1 |
1 |
|
р1 |
|
- |
- |
0,33 |
|
р2 |
|
- |
0,45 |
0,37 |
|
р3 |
|
- |
0,51 |
- |
Примечание: * – статистически значимые значения (p≤0,05), p1 – показатель статистической значимости при сравнении групп № 1 и № 2, p2 – показатель статистической значимости при сравнении групп № 1 и № 3, p3 – показатель статистической значимости при сравнении групп № 2 и № 3.
Таблица 2
Морфология спаек в брюшной полости лабораторных животных, n
|
№ группы |
Название группы |
1-е сутки |
3-и сутки |
7-е сутки |
|
1. |
Электрокоагуляция |
0 |
3 |
4 |
|
2. |
Arista AH |
0 |
1 |
2 |
|
3. |
NaКМЦ medium viscosity |
0 |
0 |
1 |
|
р1 |
|
- |
- |
0,61 |
|
р2 |
|
- |
0,79 |
0,58 |
|
р3 |
|
- |
0,37 |
- |
Примечание: * – статистически значимые значения (p≤0,05), p1 – показатель статистической значимости при сравнении групп № 1 и № 2, p2 – показатель статистической значимости при сравнении групп № 1 и № 3, p3 – показатель статистической значимости при сравнении групп № 2 и № 3.
При межгрупповом сравнении результатов фото- и видеоданных, полученных в ходе КДЛ, в группе № 1 на 1-е послеоперационные сутки отсутствовали активное кровотечение и признаки спаечного процесса, однако в брюшной полости у восьми кроликов отмечалось небольшое количество свободной, еще нелизированной крови (рис. 1А).
На 3-и сутки после моделирования травмы у восьми животных из десяти группы № 1 в месте резекции определяются грубые спаечные сращения с вовлечением большого сальника, при разделении диссектором которых отмечается кровотечение (рис. 1Б). Во всех случаях паренхима в зоне резекции ишемизирована, что подтверждается макроскопическими изменениями по сравнению с интактной тканью. В перифокальной зоне определяются мелкие очаги гемолиза алого цвета. У пяти кроликов в левых отделах брюшной полости расположены организованные сгустки крови.
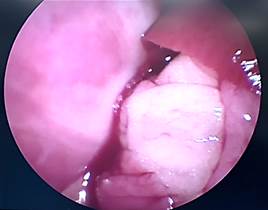
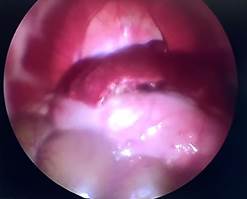
А Б


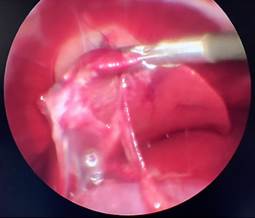
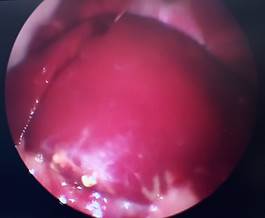
В Г
Рис. 1. Лапароскопия, интраоперационное фото, группа № 1: А – 1-е послеоперационные сутки после резекции печени; Б – 3-и послеоперационные сутки после резекции печени;
В – 7-е послеоперационные сутки после резекции печени; Г – 7-е послеоперационные сутки после резекции печени, определяется шнуровидная спайка, протянувшаяся от большого сальника к брюшной стенке (П – печень, РП – зона резекции, СП – спайка)
На 7-е послеоперационные сутки (рис. 1В) в группе № 1 у семи животных отмечаются спаечные сращения с вовлечением в зону резекции большого сальника, которые субъективно разделялись диссектором с меньшим усилием и кровотечением в сравнении с 3-ми сутками после резекции. Паренхима также ишемизирована, сгустков крови не определяется. Перифокально на поверхности печени выявлено значительное количество белесоватых пятен, которое может свидетельствовать о течении репаративных изменений, одним из этапов которых является разрастание соединительной ткани.
В группе № 1 у всех кроликов также определяются спаечные сращения с вентральной стенкой (рис. 1Г), впервые выявленные на 7-е сутки и представленные шнуровидными тяжами, морфологическим субстратом которых являлся большой сальник. Во всех случаях данные тяжи были отделены от брюшной̆ стенки при помощи биполярной коагуляции и диссектора.
У животных группы № 2 не отмечалось свободной крови и ГП в брюшной полости (рис. 2А). В данной группе на 1-е послеоперационные сутки после резекции печени в четырех случаях наблюдения определялась миграция сальника к месту травмы (рис. 2Б). Вокруг места резекции формируется «белая дымка», появление которой можно связать с организацией и резорбцией ГП. На 3-и сутки после операции у 5 кроликов в месте резекции определялись спаечные сращения с вовлечением большого сальника, при разделении диссектором которых отмечалось незначительное кровотечение (рис. 2В). Субъективно разделение диссектором происходило с меньшим усилием и кровотечением в сравнении с 3-ми сутками после резекции в группе № 1. Во всех случаях паренхима в зоне резекции менее ишемизирована в сравнении с предыдущей группой. Очаги гемолиза и зоны резорбции ГП отсутствуют. Свободной крови в брюшной полости не было. В тех случаях, когда послеоперационная ситуация в брюшной полости не сопровождалась развитием соединительной ткани, в зоне резекции печени при КДЛ отмечаются явления организации (четко визуализируется формирование чрезмерной рубцовой̆ ткани). В 2 случаях из 5 в спаечный процесс, помимо большого сальника, вовлечена соседняя доля печени (рис. 2Г).
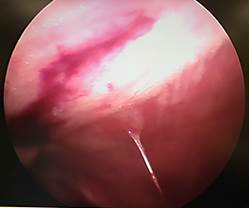
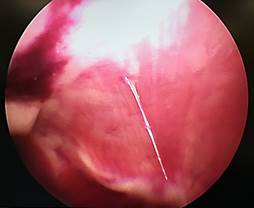
А Б
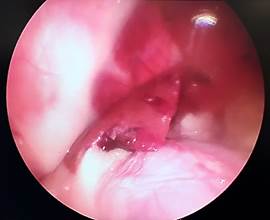
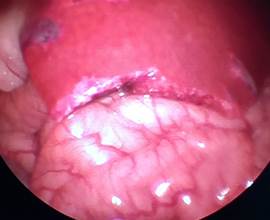
В Г
Рис. 2. Лапароскопия, интраоперационное фото, группа № 2: 1-е послеоперационные сутки после резекции печени, А – типичная картина в данной группе наблюдения; Б – миграция сальника к месту резекции печени; В – 3-и сутки после резекции печени, определяется спаечный процесс с вовлечением большого сальника; Г – 3-и сутки после резекции печени, выявлен спаечный процесс с вовлечением соседней доли печени
На 7-е послеоперационные сутки у 4 кроликов в месте резекции определялись спаечные сращения, которые с минимальным усилием и кровотечением разделялись диссектором (рис. 3А). В случаях без спаечного процесса паренхима в зоне резекции окрашена менее интенсивно в сравнении с таковыми на 3-и сутки после операции, границы рубца нечеткие (рис. 3Б).
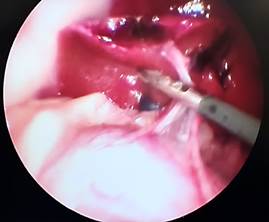
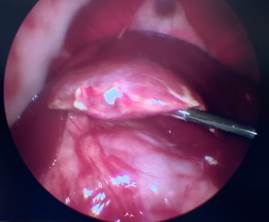
А Б
Рис. 3. Лапароскопия, интраоперационное фото, группа № 2: А – 7-е сутки после резекции печени; Б – 7-е сутки после резекции печени без спаечного процесса
В группе № 2 у 5 кроликов определялись такие же спаечные сращения брюшной полости, как и в группе № 1 (рис. 4), причем на более ранних сроках (3-е и 7-е сутки), в сравнении с группой № 1. Спайки имели плотную консистенцию, но, несмотря на это, разделялись диссектором без развития кровотечения.
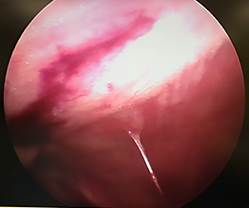
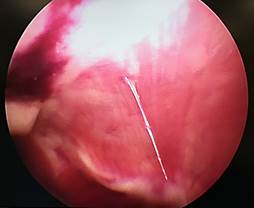
А Б
Рис. 4. Лапароскопия, интраоперационное фото, группа № 2: А – 3-и послеоперационные сутки после резекции печени, шнуровидные спайки; Б – 7-е послеоперационные сутки после травмы печени, шнуровидные спайки
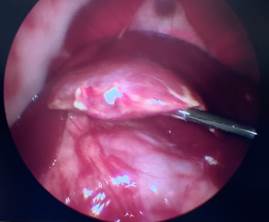
При анализе фото- и видеоматериалов в группе лабораторных животных №3 установлено, что на 1-е сутки после операции (рис. 5А), как и в группе №2, в брюшной полости не определялось свободной крови, частиц ГП и спаечного процесса. Изменений паренхимы печени не визуализировалось. Очаги гемолиза и зоны резорбции ГП отсутствуют. На 3-и сутки (рис. 5Б) после операции выявлены минимальные макроморфологические изменения паренхимы в области травмы в месте резекции, субъективно одинаковой с предыдущей группой № 2. В двух случаях в месте резекции определяется спаечный процесс с вовлечением большого сальника (рис. 5В). Разделение диссектором происходило без технических сложностей и нежелательного кровотечения. На 7-е сутки после резекции в месте операции в одном случае определялся спаечный процесс, который также разделен диссектором без технических сложностей и кровотечения. Спаечных сращений с органами брюшной полости не определялось.
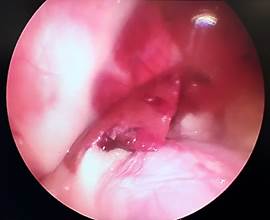
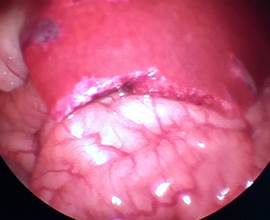
А Б
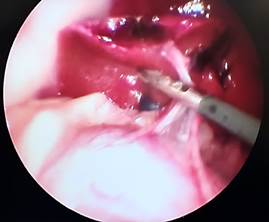
В Г
Рис. 5. Лапароскопия, интраоперационное фото, группа № 2: А – 1-е послеоперационные сутки после резекции печени, типичная картина в данной группе наблюдения; Б – 3-и послеоперационные сутки после травмы печени; В – 3-и сутки после травмы печени, шнуровидные спайки; Г – 7-е послеоперационные сутки после резекции печени
Отдельное внимание привлекает тот факт, что при контрольно-динамической лапароскопии не выявлена деформация органов, вовлеченных в спаечный процесс.
Выводы. Таким образом, в ходе проведенного макроскопического исследования были выявлены единичные и беспорядочно встречающиеся незначимые отличия, которые позволяют точно судить о рациональности проведения сравнительного анализа течения спаечного процесса на нескольких сроках при помощи КДЛ. При проведении контрольно-диагностической лапароскопии было установлено, что практически во всех случаях сращения локализовались на передней брюшной стенке в местах установки лапароскопических портов. Шнуровидные спайки, образованные большим сальником, встречались во всех исследуемых группах. Вопреки наличию спаечного процесса брюшины у кроликов, нами не было выявлено выраженных признаков механической кишечной непроходимости.



