В современной медицине большое внимание уделяется изучению цитотоксического действия различных факторов внешней среды химической, физической и бактериальной природы, которые могут приводить к грубым нарушениям системы кроветворения и непосредственному поражению костного мозга [1; 2]. Костномозговая недостаточность и тяжелые патологические состояния, с ней связанные, регистрируются во всех возрастных группах, имеют тяжелое течение и трудно поддаются коррекции [3].
Несмотря на разные механизмы повреждающего действия экзогенных факторов, приводящих к недостаточности костного мозга, в его основе лежат общие звенья патогенеза, приводящие к опустошению гемопоэтической ткани. Это происходит за счет интерфазной гибели клеток и нарушения митотической активности, что снижает образование форменных элементов, поскольку основной функциональной чертой гемопоэза является продукция огромного количества клеточных элементов в единицу времени [2; 4-6].
Для оценки тяжести течения интоксикации наряду с клинической картиной может быть информативен анализ лейкоцитарной формулы. Расчет лейкоцитарных индексов, по данным некоторых авторов, позволяет делать точные прогнозы в оценке тяжести течения заболевания [7]. Несмотря на то что индекс отношения нейтрофилов к лимфоцитам (индекс Кребса) не получил должного распространения в клинической практике, так как не отображает всех элементов лейкоцитарной формулы, по данным некоторых авторов, он объективно отображает степень интоксикации и может является предиктором летальных исходов различных патологических состояний [8; 9]. Принимая во внимание выраженное цитотоксическое действие сублетальных и летальных доз циклофосфана, которое сопровождается общетоксическими проявлениями, развитием недостаточности костного мозга и высокой летальностью, данное исследование мы посвятили анализу особенностей клиники интоксикации и динамики соотношения нейтрофилов к лимфоцитам как индекса, отражающего соотношение клеток неспецифической и специфической защиты организма. Изучение неспецифических компенсаторно-приспособительных механизмов, обеспечивающих выживаемость биообъекта в случае повреждающего действия факторов внешней среды, является одним из актуальных направлений современной патологической физиологии [8; 10; 11].
Цель исследования. Оценить динамику соотношения нейтрофилов к лимфоцитам и выявить особенности клиники интоксикации у мышей на фоне острого токсического действия летальных доз циклофосфана.
Материалы и методы исследования. Экспериментальные исследования in vivo выполнены в 2 этапа в центральной научно-исследовательской лаборатории ФГБОУ ВПО «ПИМУ» Минздрава России на 260 белых беспородных мышах-самцах ICR (CD-1), массой 27-29 г, полученных из питомника «Андреевка» (Московская обл.). Животных содержали в стандартных условиях вивария (температура воздуха 18–24 °С, относительная влажность воздуха 40–80%). Доступ животных к корму и воде не ограничивали (режим питания – ad libitum).
Эксперименты осуществляли в соответствии с принципами биоэтики и согласно требованиям нормативно-правовых документов о порядке проведения исследовательских работ с применением животных, которые отражены в руководстве «Guide for care and use of laboratory animals (ILAR publication, 1996, National Academy Press)»; межгосударственном стандарте ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами»; РД-АПК 3.10.07.02-09 «Методические рекомендации по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведениях». Указанные правила и требования согласованы с этическим комитетом при ФГБОУ ВПО «ПИМУ» Минздрава России.
Перед проведением эксперимента животные проходили карантин в течение 14 суток, после которого мышей распределяли на группы методом рандомизации с исключением из эксперимента больных и ослабленных животных. Общее количество объектов исследования и распределение их по группам представлено в таблице 1.
Таблица 1
Общее количество объектов исследования и распределение их по группам
|
Этап |
Группы |
Доза ЦФ (мг/кг) |
Экспериментальная модель |
Проводимые исследования |
|
I |
Контрольная 1 (n=20) |
- |
Внутрибрюшинное введение 0,9% раствора NaCL |
1.Оценка общей и посуточной летальности. 2.Оценка общего функционального состояния мышей на фоне интоксикации |
|
Опытная 1.1 (n=20) |
500 |
Внутрибрюшинное введение 5% рабочего раствора ЦФ (50 мг/мл) |
||
|
Опытная 1.2 (n=20) |
750 |
Внутрибрюшинное введение 7,5% рабочего раствора ЦФ (75 мг/мл) |
||
|
II |
Контрольная 2 (n=20) |
- |
Внутрибрюшинное введение 0,9% раствора NaCL |
1.Оценка общей и посуточной летальности. 2. Забор крови для гематологического исследования на 3, 6, 10, 15-е сутки интоксикации у выживших мышей (n=6) |
|
Опытная 2.1 (n=90) |
500 |
Внутрибрюшинное введение 5% рабочего раствора ЦФ (50 мг/мл) |
||
|
Опытная 2.2 (n=90) |
750 |
Внутрибрюшинное введение 7,5% рабочего раствора ЦФ (75 мг/мл) |
Примечание: ЦФ – циклофосфан.
Острый цитотоксический синдром моделировали всем животным в опытных группах путём однократного внутрибрюшинного введения рабочего раствора циклофосфана: в опытных группах 1.1 и 2.1 циклофосфан вводили в дозе 500 мг/кг массы тела, а в опытных группах 2.1 и 2.2 – в дозе 750 мг/кг массы тела. Рабочие растворы циклофосфана нужной концентрации готовили extempore (5% раствор циклофосфана – 50 мг/мл, 7,5% – 75 мг/мл) и вводили внутрибрюшинно из расчёта 0,1 мл на 10 г массы тела мыши. Животным в 1-й и 2-й контрольных группах осуществляли внутрибрюшинное введение 0,9% раствора NaCL из расчета 0,1 мл на 10 г массы тела мыши.
Продолжительность наблюдения за животными составила 15 суток. На первом этапе исследования оценивали общую и посуточную летальность, среднюю продолжительность жизни (СПЖ) на фоне интоксикации и динамику изменения коэффициента массы тела (km=1-m0/mx). Общее функциональное состояние мышей на фоне интоксикации циклофосфаном оценивали в баллах согласно ранее разработанной методике по 8 параметрам, которые описывали состояние шерстяного покрова, ориентировочно-исследовательские реакции и общую двигательную активность. Показатели общего функционального состояния мышей в экспериментальных группах представляли как среднее значение (М) ± стандартная ошибка среднего (mx) [12].
На 2-м этапе исследования помимо оценки летальности и общего функционального состояния у выживших мышей на 3, 6, 10 и 15-е сутки интоксикации циклофосфаном после декапитации проводили забор крови в пробирки с антикоагулянтом К3 EDTA для гематологического исследования и подсчета лейкоцитарной формулы. Мазки крови (по три на каждую особь) были фиксированы по Май-Грюнвальду с последующей окраской по Романовскому-Гимза («Арбис», Россия). Подсчет лейкоцитов проведен из расчета на 100 клеток, с использованием светооптического микроскопа Leica CME, при увеличении х1000 с масляной иммерсией. Индекс соотношения нейтрофилов к лимфоцитам (индекс Кребса) рассчитывали как отношение всей суммы процентного содержания нейтрофилов (НФ) к такому же количеству лимфоцитов (ЛЦ) (ИК = НФ (%) / ЛЦ (%)).
Статистическая обработка данных. Результаты представлены как среднее (М) ± стандартная ошибка среднего (mx). Ошибку средней величины частоты встречаемости признаков (в процентах) с доверительным интервалом для вероятности 95% вычисляли с применением программных пакетов Statistica 10 и MS-Exсel. Достоверность различий между экспериментальными группами определяли с применением критерия Стьюдента, критерия Фишера и не непараметрического U-критерия Манна - Уитни. Различия считались статистически значимыми при p <0,05.
Результаты исследования и их обсуждение. На первом этапе исследования на основании отрицательной динамики коэффициента массы тела, общего функционального состояния мышей и высокой летальности было установлено, что циклофосфан в дозах 500 и 750 мг/кг оказывает выраженное цитотоксическое действие на мышей.
В 1-й контрольной группе динамика массы тела у мышей была положительная и с 6-х суток наблюдения отмечали прирост Km, который на 15-е сутки наблюдения составил 0,173±0,014, что статистически значимо отличалось при сравнении с исходным значением (р=0,003). Напротив, после введения циклофосфана в дозе 500 и 750 мг/кг в опытных группах 1.1 и 1.2 наблюдали значительное снижение Km у мышей, который имел отрицательную динамику и на 15-е сутки интоксикации составил (-0,348±0,08) и (-0,984±0,053) соответственно. Начиная с 3-х суток показатели Km у мышей в опытных группах 1.1 и 1.2 носили статистически значимые отличия при сравнении с 1-й контрольной группой и исходными значениями (р1,2=0,000), что соответствует предыдущим исследованиям авторов при моделировании острого цитотоксического синдрома [12].
Острое токсическое действие циклофосфана в дозах 500 и 750 мг/кг сопровождалось значительной отрицательной динамикой общего функционального состояния мышей. В опытных группах 1.1 и 1.2 у мышей наблюдали грязный, тусклый цвет шерсти, признаки алопеции, снижение или полное отсутствие ориентировочно-исследовательских реакций и общей двигательной активности вплоть до потери позы. Начиная с 6-х суток интоксикации циклофосфаном и в течение всего периода наблюдения средние показатели общего функционального состояния мышей в опытных группах 1.1 и 1.2 носили статистически значимые различия с 1-й контрольной группой и исходным состоянием (p1,2=0,000) (табл. 2).
Таблица 2
Оценка общего функционального состояния мышей на фоне острого цитотоксического синдрома (M±m)
|
Группа |
Доза в-ва (мг/кг) |
Общее функциональное состояние (баллы)
|
||||
|
0 сут. |
3 сут. |
6 сут. |
10 сут. |
14 сут. |
||
|
Контроль 1 |
- |
8,0±0,0 |
8,0±0,0 |
8,0±0,0 |
8,0±0,0 |
8,0±0,0 |
|
Опыт 1.1 |
500 |
8,0±0,0 |
6,8±0,2 |
5,2±0,2*#(р1,2=0,000) |
5,7±0,2*#(р1,2=0,000) |
5,9±0,2*#(р1,2=0,000) |
|
Опыт 1.2 |
750 |
8,0±0,0 |
6,3±0,2 |
4,1±0,2*#(р1,2=0,000) |
3,6±0,0*#(р1,2=0,000) |
-& |
Примечание: * - p1 <0,01 - различия статистически значимы при сравнении с группой контроля, критерий Стьюдента; # - p2<0,01 - различия статистически значимы при сравнении с исходным значением, критерий Стьюдента; & - число животных в группе меньше статистически значимого числа (n <4).
Клиническая картина интоксикации и общее функциональное состояние мышей на 2-м этапе исследования не отличалась от результатов, полученных на 1-м этапе, а острое цитотоксическое действие циклофосфана сопровождалось высокой летальностью. Общую и посуточную летальность оценивали на 1-м и 2-м этапах исследования, так как при проведении экспериментов в разное время года в случае использования дозы токсиканта, близкой к DL50, возможны колебания показателя летальности, что не наблюдается при токсическом действии более высоких доз [12] (рис. 1).
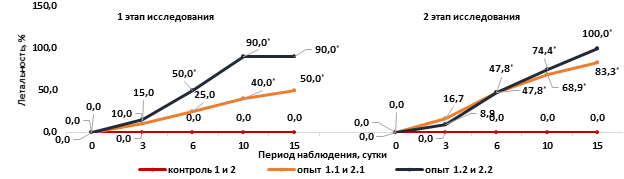
Рис. 1. Посуточная летальность мышей на фоне острого цитотоксического синдрома, вызванного циклофосфаном
Примечание. Контроль 1 и 2 – однократное внутрибрюшинное введение 0,9% раствора NaCL из расчета 0,1 мл на 10 г массы тела мыши. Опыт 1.1 и 2.1 - однократное внутрибрюшинное введение циклофосфана в дозе 500 мг/кг на 1 и 2 этапах исследования. Опыт 1.2 и 2.2 – однократное внутрибрюшинное введение циклофосфана в дозе 750 мг/кг на 1 и 2 этапах исследования. * - статистически значимые различия по сравнению с 1 и 2 контрольными группами, p <0,05 (критерий Фишера).
Первую гибель мышей наблюдали в первые трое суток интоксикации. За этот период не было установлено различий в показателях летальности в опытных группах на 1-м и 2-м этапах исследования. Массовую гибель мышей отмечали с 6-х суток интоксикации: на 1-м этапе исследования в опытной группе 1.1 летальность не превышала 25%, а в опытной группе 1.2 составила 50%; на 2-м этапе в опытных группах 2.1 и 2.2. летальность составила 47,8%. После введения циклофосфана в дозе 500 мг/кг на 10-е и 15-е сутки интоксикации в опытной группе 1.1 летальность составила 40% и 50%, в то время как в опытной группе 2.1 на те же сутки достигала 68,9% и 83,3%. После введения циклофосфана в дозе 750 мг/кг в опытной группе 1.2 на 10-е и 15-е сутки интоксикации летальность достигла 90%, а в опытной группе 2.2 была 74,4% и 100%. Несмотря на разную динамику посуточной летальности на 1-м и 2-м этапах исследования, в первые сутки интоксикации статистически значимых различий между опытными группами установлено не было (p>0,05), при этом начиная с 6-х суток в опытных группах отмечали статистически значимые различия показателя летальности при сравнении с контрольными группами (р=0,01) (рис. 1).
На 2-м этапе экспериментального исследования после введения циклофосфана в дозах 500 и 750 мг/кг в ходе гематологического анализа периферической крови были выявлены значительные изменения содержания форменных элементов у мышей, особенно лейкоцитов. Исходное содержание лейкоцитов в периферической крови у мышей в контрольной и опытных группах было в пределах физиологической нормы, различий между группами установлено не было (р>0,05). За период наблюдения содержание лейкоцитов в периферической крови у мышей во 2-й контрольной группе не претерпевало значимых изменений, а анализ лейкоцитарной формулы не выявил отклонений от нормы (рис. 2).
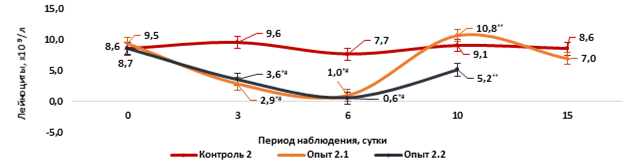
Рис. 2. Динамика изменения лейкоцитов у мышей в периферической крови на фоне острого цитотоксического синдрома, вызванного циклофосфаном
Примечание. Контроль 2 – однократное внутрибрюшинное введение 0,9% раствора NaCL из расчета 0,1 мл на 10 г массы тела мыши. Опыт 2.1 - однократное внутрибрюшинное введение циклофосфана в дозе 500 мг/кг. Опыт 2.2 – однократное внутрибрюшинное введение циклофосфана в дозе 750 мг/кг. * - статистически значимые различия по сравнению с контрольной группой, p1 <0,05; # - статистически значимые различия по сравнению с исходным значением, p2 <0,05; ** - статистически значимые различия по сравнению с содержанием лейкоцитов на 6-е сутки интоксикации в опытных группах, p3 <0,05 (критерий Манна - Уитни).
Напротив, в периферический крови у мышей в опытных группах 2.1 и 2.2 на фоне действия циклофосфана на 3-и сутки интоксикации наблюдали выраженную лейкопению – общее содержание лейкоцитов было в 3 раза меньше, чем исходное значение и во 2-й контрольной группе, а на 6-е сутки лейкоциты не подлежали подсчету гематологическим анализатором (рис. 2). В этот период к лейкопении присоединилась тромбоцитопения. Значения лейкоцитов в опытных группах 2.1 и 2.2 на 3-и и 6-е сутки интоксикации носили статистически значимые отличия по сравнению с исходными значениями и показателями во 2-й контрольной группе (p1,2=0,01). Однако следует отметить, что на 10-е и 15-е сутки интоксикации у выживших мышей в опытных группах 2.1 и 2.2 в периферической крови наблюдали статистически значимое (p3=0,01) увеличение содержания общего количества лейкоцитов по сравнению с значениями на 6-е сутки интоксикации. Увеличение общего количества лейкоцитов было обусловлено значительным выбросом сегментоядерных нейтрофилов, а также появлением юных и морфологически незрелых форм, об этом свидетельствует анализ лейкоцитарной формулы (рис. 2, 3).
.
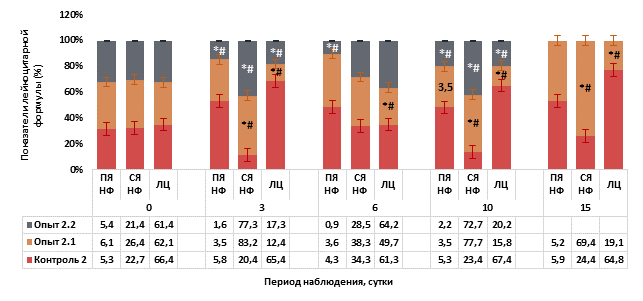
Рис. 3. Основные показатели лейкоцитарной формулы периферической крови у мышей на фоне острого цитотоксического синдрома, вызванного циклофосфаном
Примечание. ПЯ НФ - палочкоядерный нейтрофил; СЯ НФ - сегментоядерный нейтрофил; ЛЦ - лимфоцит. Контроль 2 – однократное внутрибрюшинное введение 0,9% раствора NaCL из расчета 0,1 мл на 10 г массы тела мыши. Опыт 2.1 - однократное внутрибрюшинное введение циклофосфана в дозе 500 мг/кг. Опыт 2.2 – однократное внутрибрюшинное введение циклофосфана в дозе 750 мг/кг. * - статистически значимые различия по сравнению с контрольной группой, p1 <0,05; # - статистически значимые различия по сравнению с исходным значением, p2 <0,05 (критерий Манна - Уитни).
Начиная с 3-х суток интоксикации циклофосфаном и весь период наблюдения в опытных группах 2.1 и 2.2 отмечали лимфоцитопению, при этом содержание лимфоцитов в периферической крови носило статистически значимые различия при сравнении с исходными значения и 2-й контрольной группой (p1,2=0,03) (рис. 3). Наряду с этим на 3, 10 и 15-е сутки интоксикации циклофосфаном у мышей опытных групп 2.1 и 2.2 в периферической крови отмечали статистически значимое увеличение содержания сегментоядерных нейтрофилов (p1,2=0,01). Следует отметить, что в мазках периферической крови были отмечены незрелые формы всех ростков кроветворения: эритроциты с базофильной, оксифильной и полихроматофильной окраской, метамиелоциты, миелоциты, промиелоциты, бластные клетки и пролимфоциты, а также промегакариоциты и мегакариоциты.
На фоне острого токсического действия циклофосфана динамика соотношения сегментоядерных нейтрофилов и лимфоцитов (индекс Кребса) носила ярко выраженный характер, и в некоторых случаях содержание нейтрофилов в 6-8 раз превышало содержание лимфоцитов, что свидетельствует о выбросе в периферический кровоток клеток быстрого иммунного реагирования – нейтрофилов, на фоне гибели и медленного восстановления клеток более совершенного иммунного ответа – лимфоцитов (рис. 4).
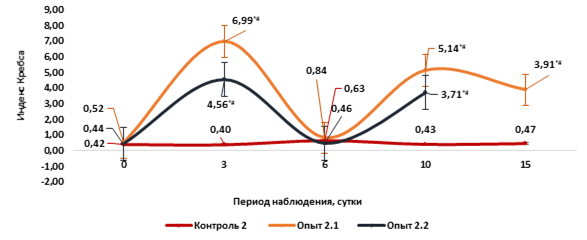
Рис. 4. Динамика индекса Кребса у мышей на фоне острого цитотоксического синдрома, вызванного циклофосфаном
Примечание. Контроль 2 – однократное внутрибрюшинное введение 0,9% раствора NaCL из расчета 0,1 мл на 10 г массы тела мыши. Опыт 2.1 - однократное внутрибрюшинное введение циклофосфана в дозе 500 мг/кг. Опыт 2.2 – однократное внутрибрюшинное введение циклофосфана в дозе 750 мг/кг. * - статистически значимые различия по сравнению с контрольной группой, p1 <0,05; # - статистически значимые различия по сравнению с исходным значением, p2 <0,05 (критерий Манна - Уитни).
В течение всего периода наблюдения за животными индекс Кребса у мышей во 2-й контрольной группе не претерпевал значительных изменений и был в диапазоне [0,42-0,47]. Напротив, в опытных группах 2.1 и 2.2 динамика ИК носила волнообразный характер. На 3-и сутки интоксикации отмечали значительное увеличение ИК в опытных группах 2.1 и 2.2, а на 6-е сутки на фоне максимального снижения лейкоцитов в периферической крови у мышей ИК приближался к исходным значениям. На 10-е сутки интоксикации вновь отмечен подъем значений ИК, а незначительное снижение этого показателя отмечали на 15-е сутки у мышей после введения циклофосфана в дозе 500 мг/кг. На 3, 10 и 15-е сутки интоксикации значения ИК в опытных группах 2.1 и 2.2. носили статистически значимые различия по сравнению с исходными значениями и 2-й контрольной группой (р1,2=0,01) (рис. 4).
Полагаем, что динамика ИК демонстрирует соотношение неспецифической и специфической защиты организма на фоне острого цитотоксического действия циклофосфана. Подъем ИК на 3-и сутки интоксикации соответствует неспецифической реакции костного мозга, как результат действия гормонов стресса в ответ на массированный распад клеточных элементов. В результате этого происходит значительный выброс в периферический кровоток нейтрофилов, как клеток неспецифического иммунного ответа, при этом снижается содержание клеток более совершенного, специфического иммунного ответа – лимфоцитов, за счет их гибели и медленного восстановления. На 6-е сутки интоксикации, когда распад лейкоцитов достигает своего максимального значения, ИК снижается до исходных значений за счёт массовой гибели нейтрофилов, поступивших в кровоток. На 10-е сутки интоксикации у выживших животных вновь активируются неспецифические компенсаторно-приспособительные механизмы, и в периферический кровоток в большом количестве выбрасываются НФ, как клетки неспецифической иммунной защиты, о чем свидетельствует увеличение ИК и общее содержание лейкоцитов в периферической крови. При этом в периферической крови остаётся низким содержание клеток специфической иммунной защиты – лимфоцитов (рис. 2-4).
Следует отметить, что у мышей в опытной группе 2.1 ИК был в 1,5 раза выше, чем у мышей в опытной группе 2.2 (рис. 4). Возможно, это связано с тем, что на фоне действия летальных доз циклофосфана 750 мг/кг наблюдается более выраженный распад клеточных элементов, поступающих из костного мозга, а также угнетение их продукции, что в меньшей степени проявляется при использовании циклофосфана в дозе 500 мг/кг. Таким образом, соотношение общего содержания лейкоцитов, индекса Кребса, общего функционального состояния и посуточной летальности у мышей после введения циклофосфана в дозе 500 мг/кг в опытной группе 2.1 позволяет наглядно проследить реализацию неспецифических компенсаторных реакций у мышей с острым цитотоксическим синдромом (рис. 5).
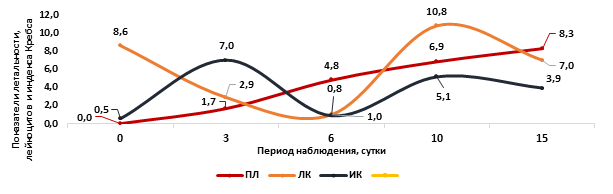
Рис. 5. Соотношение летальности, общего содержания лейкоцитов и индекса Кребса у мышей на фоне острого токсического действия циклофосфана в дозе 500 мг/кг
Примечание. ПЛ - показатель летальности: летальность (%) * 10-1; ЛК – содержание лейкоцитов, *109/л; ИК – индекс Кребса: отношение всей суммы процентного содержания нейтрофилов к такому же количеству лимфоцитов.
На основании динамики показателей, представленных на рисунке 5, полагаем, что на фоне действия сублетальных доз циклофосфана развивается цитотоксический синдром, который приводит к снижению уровня лейкоцитов в периферической крови. В ответ на распад форменных элементов реализуются неспецифические компенсаторные реакции, в том числе с участием гормонов стресса, которые способствуют выбросу в периферический кровоток неспецифических клеток иммунной защиты. В результате этого соотношение нейтрофилов и лимфоцитов меняется в сторону нейтрофилов, что приводит к увеличению значения ИК. На фоне реализации данной неспецифической компенсаторной реакции летальность у мышей в первые 3 суток интоксикации не превышает 17%. На 6-е сутки интоксикации, на фоне продолжающегося цитотоксического действия циклофосфана, происходит значительный распад клеточных элементов, которые поступили в кровоток. У мышей в опытных группах это проявляется отрицательной динамикой общего функционального состояния, максимальным снижением количества лейкоцитов в периферической крови, относительным выравниванием соотношения НФ к ЛЦ и снижением ИК, что приводит к массовой гибели животных, и летальность может достигать 47,8%. На 10-е сутки интоксикации у выживших мышей при успешной реализации второй волны неспецифических компенсаторных механизмов увеличивается общее содержание лейкоцитов в периферической крови за счет выброса в кровоток клеток неспецифической иммунной защиты нейтрофилов, что снова меняет соотношение НФ к ЛЦ, увеличивается ИК. В результате этого при успешной реализации компенсаторных механизмов летальность не превышает 50%, а при менее успешной достигает 83,3%.
Таким образом, в результате реализации компенсаторно-приспособительных механизмов в ответ на токсическое действие циклофосфана после введения его в дозе 500 мг/кг, у выживших мышей начиная с 15-х суток интоксикации наблюдали стабилизацию состояния. Несмотря на содержание в периферическом кровотоке морфологически незрелых и изменённых клеток крови, это обеспечивало выживаемость мышей и снижало высокий риск развития поздних осложнений острого цитотоксического синдрома – инфекционного и органического поражения центральной нервной системы.
Выводы. Однократное внутрибрюшинное введение циклофосфана в дозах 500 и 750 мг/кг приводит к развитию острого цитотоксического синдрома. Он сопровождается отрицательной динамикой общего функционального состояния мышей и развитием лейкопении, с содержанием в периферической крови бластных клеток всех ростков кроветворения. За первые 15 суток интоксикации развивающиеся функциональные и гематологические изменения приводят к высокой летальности, которая после введения циклофосфана в дозе 500 мг/кг составляет 50,0-83,3%, а после введения дозы 750 мг/кг – 90-100%.
Неспецифические компенсаторные реакции организма на фоне острого токсического действия циклофосфана проявляются сдвигом соотношения нейтрофилов к лимфоцитам в сторону нейтрофилов. Это выражается увеличением значения индекса Кребса и способствует сохранению жизни мышей. В свою очередь, снижение индекса Кребса до исходных значений на фоне выраженной лейкопении соответствует началу массовой гибели мышей.



