Нормальное заживление ран представляет собой динамичный и сложный многофазный процесс, включающий скоординированные взаимодействия между факторами роста, цитокинами, хемокинами и различными клетками. Любой сбой на этих этапах может привести к хронизации раны с образованием аномального рубца. Такие повреждения кожи влияют на качество жизни пациентов и требуют повторного лечения. Таким образом, много усилий было направлено на разработку новых терапевтических подходов к лечению ран. Одним из таких подходов стало лечение стволовыми клетками. Оно продемонстрировало значительный потенциал для улучшения скорости и качества заживления ран и регенерации кожи. Тем не менее, есть много проблем с использованием стволовых клеток для регенерации кожи [1].
В данном обзоре приведен анализ современных подходов, методов лечения ран и профилактики образования рубцов с применением постнатальных стволовых клеток на примере мезенхимальных стволовых клеток, полученных из костного мозга. (МСК-КМ) мезенхимальных стромальных клеток жировой ткани (МСК-ЖТ), включая стромально-васкулярную фракцию (СВФ), и мезенхимальных стволовых клеток, полученных с пуповины человека (МСК-ПК)
Рана – это любое нарушение нормальной структуры кожи, которое может развиваться вследствие травматизации тканей, от длительного давления или недостаточного кровообращения и приводит к нарушению связи в тканях тела [2]. Клинически раны делят на острые и хронические. Раны, нарушающие целостность мягких тканей и закрывающиеся спонтанно в результате своевременного и упорядоченного прогрессирования (между 4 и 6 неделями), классифицируются как острые. Хронические раны могут образовываться вследствие инфекции, воздействия физических агентов, воспаления и опухолей. В отличие от острых ран заживление хронических замедлено (более 12 недель) из-за длительного патологического воспаления [3]. Заживление дермальных ран представляет собой высокодинамичный процесс, включающий взаимодействие между клетками эпидермиса, дермы, внеклеточного матрикса (ВКМ) и белков плазмы (координируемые цитокинами и факторами роста) [4]. Он состоит из координации трех перекрывающихся, но различных фаз – воспаления, пролиферации и ремоделирования – и регулируется секрецией различных факторов роста, цитокинов и хемокинов [5]. Нарушение клеточных и молекулярных сигналов на какой-либо из этих стадий может привести к образованию хронических ран (рис.1). Хронические раны характеризуются большим количеством клеток Лангерганса, нейтрофилов, провоспалительных макрофагов и протеаз, которые не только расщепляют компоненты дермального ВКМ, но также разрушают факторы роста и цитокины (например, TNF -β) [6].
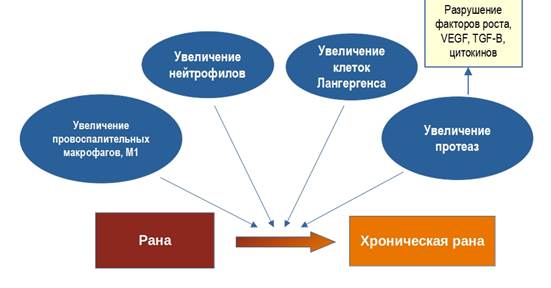
Рис. 1. Обобщенная схема процесса хронизации ран кожи
Непосредственной целью репарации является достижение гомеостаза и целостности тканей. Активное распространение получила регенеративная медицина на основе применения мезенхимальных стволовых клеток (МСК) [7, 8]. Значительный интерес к применению стволовых клеток связан с их способностью к самообновлению и дифференцировке во множество типов клеток, что имеет решающее значение для физиологического обновления и регенерации тканей после повреждения [9]. Большинство стволовых клеток, используемых в регенерации кожи и заживлении ран, представляют собой взрослые стволовые клетки, так как они обладают значительной пролиферативной способностью, долгосрочным потенциалом самообновления и способностью дифференцироваться в другие популяции. Они обнаружены в различных тканях, включая кожу, сердце, печень, головной мозг и костный мозг. Среди различных типов взрослых стволовых клеток особое внимание привлекли мезенхимальные стволовые клетки (МСК) и стромальные клетки жирового происхождения (АСК) как метод для усиления регенерации тканей [10]. Однако определение оптимального источника, способа обработки и введения МСК в реальной клинической ситуации все еще остается проблемой для их применения в заживлении ран [11].
Мезенхимальные стволовые клетки (МСК): общие эффекты. МСК определяются как мультипотентные СК, обладающие способностью к самообновлению и дифференцировке в различные линии тканей, образующие клетки, включая хондроциты, миоциты, остеобласты, теноциты и адипоциты. МСК характеризуются экспрессией маркеров клеточной поверхности, включая CD 44+, CD 90+, CD 73+, CD 105+ и отрицательный по маркерам, включая HLA DR, CD45, CD 14, CD 34.[12] МСК, полученные из различных участков (костный мозг, жировая ткань, амниотическая жидкость, пуповинная кровь и дерма), считаются источником для терапевтических подходов из-за их многолинейной дифференциации, высокой частоты, легкости выделения и характеристик, а также способности МСК мигрировать в место повреждения [13]. Эти клетки участвуют во всех трех фазах процесса заживления ран за счет иммуномодуляции, выработки факторов роста, которые усиливают неоваскуляризацию, реэпителизацию и стимулируют ангиогенез [14]. В исследованиях сообщалось, что при введении МСК происходит ускоренное закрытие раны и усиливается миграция дермальных фибробластов и кератиноцитов. Также комбинация мезенхимальных стволовых клеток человека (МСКЧ) и фактора роста фибробластов в модели дефекта кожи улучшало заживление кожных ран, поскольку МСКЧ могут дифференцироваться в эпителий. МСК секретируют растворимые факторы, индуцирующие пролиферацию, миграцию и хемотаксис дермальных фибробластов Во время нормального процесса заживления ран ангиогенез является одной из наиболее важных стадий, на которой МСК секретируют различные проангиогенные факторы, такие как VEGF, для стимуляции пролиферации эндотелиальных клеток и формирования новых сосудов [15]. Недавнее исследование показало, что локальная трансплантация МСК улучшает заживление кожных ран посредством VEGF-паракрина, секретируемого из МСК. Механическая нагрузка МСК приводит к паракринной стимуляции ангиогенеза, скорее всего, за счет регуляции сети из нескольких ангиогенных молекул. Экспериментальные исследования установили, что МСК могут управлять воспалительной реакцией после повреждения ткани [16]. Также было описано, что МСК способны модулировать аллогенные ответы иммунных клеток за счет снижения секреции TNF-α и интерферона-γ (IFN-γ) [17]. Лечение ожоговых поражений, особенно тяжелых, всегда было сложной проблемой, однако применение МСК оказывало благотворное терапевтическое воздействие на заживление ожоговых ран. Отчет о радиационных ожогах показал эффективность нового терапевтического подхода, сочетающего хирургию и местную клеточную терапию с использованием аутологичных МСК.[18] Проведено клиническое исследование новой методики лечения хронической длительно незаживающей раны (диабетической язвы) с использованием аутотрансплантата, состоящего из аутологических фибробластов кожи на биодеградируемой коллагеновой мембране (Коладерм) в сочетании с аутологичными МСК, полученными из костного мозга пациента. Рана показала устойчивое общее уменьшение размера и увеличение васкуляризации дермы и толщины дермы раневого ложа через 29 дней комбинированного лечения[19]. МСК также могут ингибировать экспрессию матриксной металлопротеиназы (ММП)-1, которая предотвращает деградацию ВКМ и может способствовать пролиферации фибробластов – процесс, который нарушается в хронических ранах [5]. В исследованиях также было показано, что основные терапевтические преимущества МСК не ограничиваются исключительно их межклеточными взаимодействиями. МСК секретируют широкий спектр биоактивных молекул, включая белки, нуклеиновые кислоты, протеасомы, экзосомы, микроРНК и мембранные везикулы, известные под общим названием секретом, в ответ на окружающую среду. Далее секретом МСК (MSC-S) влияет на соседние клетки и регулирует множество биологических процессов. В настоящее время паракринные или трофические свойства рассматриваются как первичные пути терапевтического действия МСК. Хотя МСК, происходящие из разных органов, имеют общие фенотипические и регенеративные характеристики, их секретом различен и зависит от их происхождения, что, следовательно, может привести к разным терапевтическим возможностям [20].
Несомненно, многие исследования показали, что мезенхимальные клетки считаются подходящими кандидатами для клеточных терапевтических подходов, но, несмотря на развитие терапии на основе МСК, существует ряд ограничений в их использовании. Одним из потенциальных ограничений в применении МСК для лечения является их низкая жизнеспособность после имплантации, что ограничивает долгосрочный профиль безопасности. Однако были разработаны некоторые стратегии для улучшения выживаемости трансплантированных МСК [21]. Способность МСК к самообновлению и их молекулярный механизм неизвестны, и до сих пор неясно, как расширение культуры изменяет клеточный состав и функцию популяций [22].
Влияние мезенхимально-стволовых клеткок, полученных из костного мозга на заживление ран. (МСК-КМ). МСК-КМ считаются основным источником МСК у взрослых и хорошим кандидатом для лечения различных типов ран [23]. Доклинические исследования с использованием аутологичных МСК-КМ показали потенциальный терапевтический эффект этих клеток в восстановлении дермы и уменьшении рубцевания при хронических ранах [24]. Было подтверждено, что МСК-КМ улучшают показатели, связанные с заживлением ран, за счет увеличения реэпителизации и толщины регенерированного эпидермиса [25]. Ван и др. продемонстрировали, что трансплантация аллогенных мезенхимальных стволовых клеток, полученных из костного мозга, может способствовать ускорению заживления ран у крыс с диабетом [26]. Культивированные аутологичные МСК-КМ, доставляемые в раны с помощью системы распыления фибрина, могут способствовать заживлению кожных ран у мышей и человека [27]. Исследование на 8 пациентах, чьи незаживающие диабетические язвы лечили комбинацией стволовых клеток костного мозга, тромбоцитов, фибринового клея и коллагенового матрикса, показало успешное заживление у трех пациентов и значительное восстановление у оставшихся пяти пациентов [28]. Ву и др. обнаружили, что МСК-КМ улучшают заживление ран у мышей без диабета, способствуя реэпителизации, клеточной инфильтрации. Кроме того, исследование показало, что циркулирующие костномозговые МСК, находящиеся в периваскулярных участках в критически ишемизированной ткани, проявляют паракринную функцию и усиливают микрогемодинамику. Эти эффекты были опосредованы артериогенезом и ангиогенезом, что способствовало регенерации сосудов [29]. Было показано, что МСК-КМ увеличивают миграцию фибробластов и кератиноцитов и усиливают ангиогенез путем повышения уровня сосудистого эндотелиального фактора роста (VEGF) и фактора роста гепатоцитов (HGF) (рис 2).
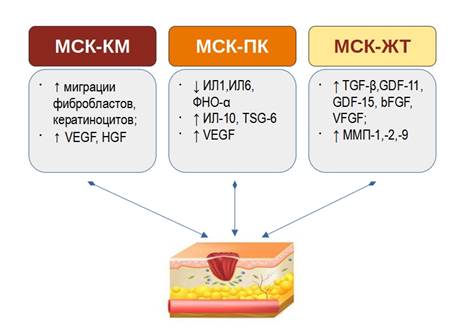
Рис. 2. Схематическое изображение эффектов МСК, взятых из разных источников на заживление ран
МСК-КМ успешно могли бы применяться в клинической практике, но существенным препятствием для клинического использования является их выделение, которое требует получения аспирата костного мозга. Эта процедура может вызвать побочные эффекты у пациентов и не позволяет получить достаточное количество клеток, необходимых для лечения [5].
Влияние мезенхимальных стволовых клеток, полученных из пуповинной крови человека, на заживление ран (МСК-ПК). МСК-ПК демонстрируют многообещающие терапевтические эффекты благодаря иммунологической совместимости, длительному выживанию, потенциалу разнонаправленной дифференцировки и простоте выделения. Эксперименты in vitro показали, что лечение диабетических ран с помощью МСК-ПК демонстрирует более высокую пролиферацию клеток и синтез коллагена по сравнению с фибробластами [30]. Аналогичное наблюдение показало, что трансплантация МСК-ПК ускоряет закрытие ран у мышей с диабетом. При трансплантации МСК-ПК в кожные раны крыс заживление ран происходило значительно быстрее на фоне заметного снижения количества инфильтрированных воспалительных клеток и уровня ИЛ-1, ИЛ-6 и ФНО-а, а также увеличения уровня ИЛ-10 и ТСГ-6 в ране (рис 2).
Кроме того, МСК-КМ повышали уровень VEGF в тяжелых ожоговых ранах и стимулировали раневой ангиогенез. Раны крыс, обработанные МСК пуповины человека, показали меньшее количество воспалительных клеток и провоспалительных цитокинов, таких как интерлейкин (ИЛ)-1 и фактор некроза опухоли (ФНО), что способствовало ускоренному заживлению. Выбор МСК-ПК для применения при заживлении ран имеет преимущества перед МСК-КМ, что обусловлено простотой их выделения и получением большего количества клеток [31].
Влияние мезенхимально-стволовых клеток, полученных из жировой ткани на заживление ран (МСК-ЖТ) Мультипотентные мезенхимальные/стромальные стволовые клетки (МСК) были идентифицированы как остаточные стволовые клетки почти во всех взрослых органах, особенно в жировой ткани (ЖТ). Эти клетки in vitro обладают типичными характеристиками мезенхимальных клеток и изолированы в составе стромально-васкулярной фракции (СВФ) [32]. МСК-ЖТ являются более пролиферативными клетками и обладают иммуносупрессивными свойствами, которые способны инактивировать Т-клетки [33, 34]. Также известно, что МСК-ЖТ имеет преимущественно адипогенную дифференцировку, по сравнению с МСК-КМ и пуповины МСК-ПК. Однако их мультипотентные свойства обладают большим потенциалом для восстановления экто- и эндодермальной ткани [34, 35].
Как свидетельствует большинство сообщений, МСК-ЖТ способны секретировать богатый секретом, благодаря чему происходит пролиферация и дифференцировка клеток, миграция и улучшение защиты клеток и микроокружения [36, 37] Этот секретом соответствует группе трофических факторов, таких как цитокины, факторы роста и хемокины, которые позволяют МСК-ЖТ действовать преимущественно через паракринные эффекты, а не посредством клеточной компенсации. Используемый в качестве экзосом, этот секретом открыл путь к недавно появившейся бесклеточной терапии [37, 38]. МСК-ЖТ были идентифицированы в подкожной клетчатке [39]. Их присутствие позволяет нам ожидать, что они будут играть ключевую роль в восстановлении и регенерации кожи. Выявляясь в базальном слое, они самообновляются и дифференцируются, постоянно заселяя эпидермис кератиноцитами, фибробластами и меланоцитами [40] Эти клетки могут влиять на физиологические характеристики поврежденной кожи и обладают большой способностью к миграции и рекрутированию в раневые участки [41]. Наконец, изменения клеточного состава дермы и способности различных эпителиальных клеток секретировать специфические факторы роста, такие как TGF-β, GDF11, GDF15, b-FGF, VEGF, MMP-1, MMP-2, MMP-9 и белки внеклеточного матрикса (ECM), обеспечивают возможность установления баланса между регенерацией клеток и омоложением клеток в микроокружениии [32] (рис 2).
Целью регенерации кожи является достижение структурной и функциональной реконструкции, уменьшение образования рубцов и улучшение качества заживления ран. Терапия на основе стволовых клеток положила начало новой и мощной стратегии лечения ожогов и ран. Было показано, что стволовые клетки обладают значительным потенциалом в регенерации тканей кожи, поскольку эти клетки могут не только регенерировать утраченные ткани, но и способствовать заживлению ран паракринным путем. Последние данные показали, что мезенхимальные стволовые клетки обеспечивают уникальную и эффективную поддержку для стимуляции процесса заживления ран при хронических ранах. В конечном счете, эти клетки обладают способностью подавлять чрезмерное воспаление и уменьшать рубцевание, одновременно стимулируя ангиогенез de novo в раневом ложе, что приводит к многообещающим результатам при заживлении хронических ран. Несмотря на быстрый прогресс в оценке эффективности трансплантации МСК для заживления ран, еще предстоит решить несколько вопросов. Клинические данные показали, что аутологичная трансплантация МСК способствует заживлению на всех этапах заживления раны. Однако сбор и выделение оптимизированного пула МСК высокой чистоты препятствует развитию новых методов лечения. Таким образом, характеристика МСК с нишевыми факторами по-прежнему остается сложной задачей для исследователей. Чтобы преодолеть эти ограничения, необходимо понимание клеточных и молекулярных механизмов, лежащих в основе действия стволовых клеток. Впоследствии необходимо усовершенствование методов доставки стволовых клеток и определение идеального источника для клинического применения этих клеток при заживлении ран. Кроме того, отсутствует информация об отдаленных результатах лечения кожных ран с использованием таких регенеративных методов лечения. Благодаря развитию клеточной биологии, тканевой инженерии и регенеративной медицины в ближайшее время эти вопросы будут решены.



