В настоящее время известно, что воспаление при акне формируется на ранней стадии и, являясь персистирующим, диагностируется при появлении микрокомедонов, закрытых комедонов, воспалительных папул и пустул и завершается поствоспалительными эритемой и гиперпигментацией, а также образованием рубцов [1].
Рубцы постакне являются результатом патологической реакции заживления ран на воспаление в коже. Частота встречаемости рубцов постакне варьирует и составляет от 11 до 95 %. Наиболее часто встречаются атрофические рубцы постакне. Показано, что воспалительные клеточные инфильтраты обнаруживаются у 77 % пациентов с атрофическими рубцами. Различные филотипы Cutibacterium acnes (C. acnes) дифференцированно активируют эпидермальный врожденный иммунитет, обуславливая различные степени тяжести акне. У пациентов, не подверженных рубцеванию, на ранних этапах развития акне активируется неспецифический иммунный ответ, интенсивность которого постепенно уменьшается при регрессе высыпаний. Напротив, у пациентов, склонных к рубцеванию, ранние высыпания характеризуются меньшим количеством интрадермальных лимфоцитов CD4+, что обеспечивает гиперактивацию ответной иммунной реакции при разрешении высыпаний.
Патологический процесс синтеза и деградации коллагена во время процесса регенерации при акне приводит к различным видам рубцов постакне. Имеются сведения, что в 80–90 % случаев при полном разрушении коллагена в дерме формируются атрофические рубцы. Реже отмечается избыточный синтез коллагена, который приводит к гипертрофическим или келоидным рубцам.
Одним из важных направлений исследования патофизиологических механизмов в патогенезе рубцов постакне является изучение роли генетической регуляции. Имеются данные об ассоциации -1997 G/T, +1245 G/T гена COL1A1 с развитием келоидных рубцов [2].
Показано, что дефект организации коллагена и его накопления, в частности коллагенов I и III типов, может являться причиной формирования рубцов [3].
На сегодняшний день имеются данные о различных полиморфных локусах при различных формах акне, однако полученные результаты не воспроизводились другими авторами и нередко являются противоречащими друг другу.
Целью настоящего исследования было определение и анализ вариантов нуклеотидной последовательности генов коллагена COL1A1, COL2A1, COL1A2, COL3A1, COL5A1, COL7A1 у пациентов с акне тяжелой степени.
Материалы и методы исследования
Для достижения поставленной цели в 2017–2020 гг. проведено проспективное открытое нерандомизированное одноцентровое сравнительное исследование.
Под нашим наблюдением в клинических условиях на кафедре кожных болезней и косметологии ФДПО ФГАОУ ВО РНИМУ им. Н.И. Пирогова МЗ РФ находилось 70 чел., из них 50 пациентов основной группы и 20 участников группы сравнения в возрасте от 15 до 46 лет (медиана – 22,1 [10,2; 25,4] год). Размер выборки предварительно не рассчитывали. Исследование проведено с информированного согласия всех пациентов, включенных в исследование, в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2008 г., протокола Конвенции Совета Европы о правах человека и биомедицине 1999 г., и в соответствии со статьями 20, 22, 23 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 г. № 323-ФЗ (ред. от 21.07.2014).
В основной группе было 50 пациентов (29 мужчин и 21 женщина) с тяжелой формой акне в возрасте на момент исследования от 15 до 46 лет (медиана – 23,2 [11,5; 26,6] года). Группу сравнения составили 20 условно здоровых лиц (13 мужчин и 7 женщин) от 16 до 40 лет (медиана – 19,4 [10,0; 23,1] года). Таким образом, основная группа и группа сравнения были сопоставимы по половозрастным характеристикам (p < 0,05).
Мoлекулярно-генетическое исследование было проведено всем 50 пациентам основной и 20 условно здоровым лицам группы сравнения методом высокопроизводительного секвенирования ДНК – секвенирования «нового поколения» (next-generation sequencing, NGS) в лаборатории молекулярной биологии ФГБУ «НМИЦ ДГОИ им. Дм. Рогачева» МЗ РФ. Геномная ДНК былa выделенa из образцов цельной крови обследованных больных с использованием набора CellSep Advanced Kit. (DiaSorin Ireland Ltd., Ирландия) согласно инструкции производителя. Проведено секвенирование генов коллагена COL1A1, COL2A1, COL1A2, COL3A1, COL5A1, COL7A1. Индивидуальные лигированные библиотеки собирали с помощью набора NebNext Ultra II DNA Library Prep Kit for Illumina (New England Biolabs, США). Для пробоподготовки применялась методика гибридизационного селективного обогащения фрагментами ДНК с кастомной панелью зондов (Roche, Швейцария), по протоколу производителя о проведении реакции обогащения с библиотекой зондов SeqCap EZ для секвенаторов «Illumina». Анализ ДНК пациентов проводили на платформе MiSeq (Illumina, США). Данные секвенирования обрабатывали с использованием автоматизированного алгоритма биоинформатического анализа.
Для оценки популяционных частот полученных вариантов были проанализирогваны параметры международного проекта gnomAD Exomes (ExAC) для экзонных вариантов и базы gnomAD Genomes для интронных вариантов. Анализ патогенности найденных миссенс-вариантов проведен с помощью компьютерных программ предсказания патогенности замен аминокислот (SIFT, PolyPhen-2, PROVEAN, UMD Predictor). Анализ компьютерного предсказания эффекта изменений в сайтах сплайсинга или прилежащих к сайту сплайсинга участках проводилась посредством программ MutationTaster, Human Splicing Finder и NNSplice.
Статистически результаты рассчитаны с применением программного обеспечения XLSTAT2019. Оценку соответствия распределения количественных показателей нормальному закону проводили с применением критерия Шапиро – Уилка. В случае распределения показателя, отличного от нормального, он описывался медианой (Ме) и верхним и нижним квартилями [Q1; Q3]. Значимость различия в независимых выборках оценивали посредством критерия Манна – Уитни. Для оценки связи номинальных и порядковых признаков строили таблицы сопряженности и на их основе рассчитывали критерий χ2 Пирсона.
Для оценки факторов риска рассчитывали отношение шансов (odds ratio, OR). OR – критерий отношения шансов, который показывает относительный риск развития заболевания при определенном генотипе по сравнению с группой контроля. Полученные данные интерпретировали: OR = 1, то шанс для основной группы равен шансу для контрольной группы, OR > 1, то шанс для основной группы больше шанса для контрольной группы; OR < 1, то шанс для основной группы меньше шанса для контрольной группы.
Для определения функционального значения генов коллагена в биологических путях организма использованы онлайн-программа с базой данных STRING. Программа осуществляет математическое прогнозирование на основании баз данных Genomic Context Predictions, High-throughput Lab Experiments, (Conserved) Co-Expression, Automated Textmining. База данных STRING в настоящее время охватывает 24 584 628 белков от 5 090 организмов [4, 5]. Статистически значимыми различия считали при р < 0,05.
Результаты исследования и их обсуждение
Для оценки регуляторной значимости идентифицированных однонуклеотидных полиморфизмов (single nucleotide polymorphism, SNP) в экзонах (несинонимичные замены) была выполнена их стратификация на кодируемые этими генами типы коллагена. В результате было выявлено 27 SNPs генов COL1A1, COL2A1, COL1A2, COL3A1, COL5A1, COL7A1.
Характеристика полиморфных локусов генов коллагена COL1A1 и COL1A2 в экзонах у больных акне представлены в табл. 1.
Таблица 1
Характеристика полиморфных локусов генов COL1A1 и COL1A2 в экзонах у больных акне
|
Ген |
Полиморфный локус (SNP) |
Позиция (hg19) |
Номер экзона |
Вид и позиция замены ДНК |
p-value (z-тест для пропорций) |
OR (95 % доверительный интервал), уровень значимости |
|
COL1A1 |
rs1800215 |
17:48265495 |
44 |
c.A3223G |
0,199 |
0,26 (0,014–5,032), p = 0,376 |
|
COL1A1 |
-(.) |
17:48273526 |
15 |
c.C992T |
0,368 |
2,06 (0,097–43,775), p = 0,644 |
|
COL1A1 |
-(.) |
17:48276621 |
5 |
c.C437T |
0,526 |
1,22 (0,049–30,606), p = 0,903 |
|
COL1A1 |
rs546629502 |
17648277279 |
2 |
c.C133G |
0,113 |
0,13 (0,005–3,285), p = 0,216 |
|
COL1A2 |
rs201463779 |
7:94039566 |
20 |
c.C1048T |
0,113 |
0,13 (0,005–3,285), p = 0,216 |
|
COL1A2 |
rs42524 |
7:94043239 |
28 |
c.C1645G |
0,255 |
1,56 (0,725–3,338), p = 0,257 |
|
COL1A2 |
-(.) |
7:94056540 |
48 |
c.G3200T |
0,113 |
0,13 (0,005–3,285), p = 0,216 |
Примечание. Здесь и в табл. 2 и 5 -(.) – впервые выявленный полиморфный локус.
Как представлено в табл. 1, по результатам расчета OR выявлено, что два полиморфных локуса COL1A1 ((.), OR = 2,06; (.), OR = 1,22) и один полиморфный локус COL1A2 (rs42524, OR = 1,56), вероятно, ассоциированы с тяжелым течение акне (р > 0,05). По два SNPs гена COL1A1 и COL1A2, имеют вероятную ассоциацию по протективному эффекту акне (OR < 1; p > 0,05). При этом 2 SPS гена COL1A1 и 1 SPS гена COL1A2 были диагностированы нами впервые.
Характеристика полиморфных локусов генов коллагена COL2A1 в экзонах у больных акне представлены в табл. 2.
Таблица 2
Характеристика полиморфных локусов гена COL2A1 в экзонах у больных акне
|
Ген |
Полиморфный локус (SNP) |
Позиция (hg19) |
Номер экзона |
Вид и позиция замены ДНК |
p-value (z-тест для пропорций) |
OR (95 % доверительный интервал), уровень значимости |
|
COL2A1 |
rs2070739 |
12:48367976 |
52 |
c.G4006A |
0,299 |
0,56 (0,186–1,693), p = 0,305 |
|
COL2A1 |
rs12721427 |
12:48368541 |
51 |
c.G3784A |
0,105 |
4,82 (0,601–38,639), p = 0,139 |
|
COL2A1 |
rs146046296 |
12:48371857 |
43 |
c.G2840A |
0,113 |
0,13 (0,005–3,284), p = 0,216 |
|
COL2A1 |
-(.) |
12:48377516 |
29 |
c.C1738T |
0,526 |
1,22 (0,049–30,606), p = 0,903 |
|
COL2A1 |
-(.) |
12:48377883 |
28 |
c.C1721A |
0,526 |
1,22 (0,049–30,606), p = 0,903 |
|
COL2A1 |
rs3803183 |
12:48398080 |
1 |
c.A25T |
0,086 |
2,15 (0,887–5,207), p = 0,049 |
Как видно из данных табл. 2, при этом один SNPs гена COL2A1 (rs3803183, OR = 2,15; p = 0,049) достоверно ассоциирован с развитием тяжелого акне. Тогда как четыре SNPs гена COL2A1 (rs12721427, OR = 4,82; -(.), OR = 1,22; -(.), OR = 1,22; rs3803183, OR = 2,15) ассоциированы с тяжелым течением акне. При этом 2 из 4 SNPs идентифицированы нами впервые и не были описаны ранее ни при одном заболевании. 2 SNPs гена COL2A1 (OR < 1), вероятно, оказывают протективное действие в развитии акне.
Характеристика полиморфных локусов генов коллагена COL3A1 в экзонах у больных акне представлены в табл. 3.
Таблица 3
Характеристика полиморфных локусов гена COL3A1 в экзонах у больных акне
|
Ген |
Полиморфный локус (SNP) |
Позиция (hg19) |
Номер экзона |
Вид и позиция замены ДНК |
p-value (z-тест для пропорций) |
OR (95 % доверительный интервал), уровень значимости |
|
COL3A1 |
rs112185887 |
2:189855743 |
11 |
c.G812A |
0,526 |
1,22 (0,049–30,606), p = 0,903 |
|
COL3A1 |
rs35795890 |
2:189861933 |
25 |
c.C1804A |
0,526 |
1,22 (0,049–30,606), p = 0,903 |
|
COL3A1 |
rs41263773 |
2:189864023 |
30 |
c.G2035A |
0,139 |
0,23 (0,017–2,179), p = 0,183 |
|
COL3A1 |
rs1800255 |
2:189864080 |
30 |
c.G2092A |
0,633 |
1,23 (0,531–2,827), p = 0,634 |
|
COL3A1 |
rs1516446 |
2:189875421 |
50 |
c.T4059G |
0,049 |
2,48 (0,048–127,204), p = 0,049 |
Как видно из табл. 3, в одном SNPs гена COL3A1 rs41263773 частота альтернативного аллеля имела достоверные отличия в основной группе от группы контроля (р = 0,049). По данным OR = 2,49 (p = 0,049) этот полиморфный локус имеет сильную ассоциативную связь по риску развития в отношении тяжелой формы акне. При этом три из пяти SNPs гена COL3A1 (rs112185887, OR = 1,22; rs35795890, OR = 1,22; rs1800255, OR = 1,23), вероятно, ассоциированы с тяжелой формой акне, а один SNPs COL3A rs41263773 (OR = 0,23) по-видимому, оказывает протективное значение в формировании акне (p > 0,05).
Характеристика полиморфных локусов генов коллагена COL5A1 в экзонах у больных акне представлены в табл. 4.
Таблица 4
Характеристика полиморфных локусов гена COL5A1 в экзонах у больных акне
|
Ген |
Полиморфный локус (SNP) |
Позиция (hg19) |
Номер экзона |
Вид и позиция замены ДНК |
p-value (z-тест для пропорций) |
OR (95 % доверительный интервал), уровень значимости |
|
COL5A1 |
rs145178917 |
9:137591855 |
3 |
c.G378T |
0,499 |
0,40 (0,024–6,456), p = 0,514 |
|
COL5A1 |
rs138579182 |
9:137593099 |
4 |
c.G574A |
0,565 |
0,55 (0,04–3,656), p = 0,569 |
|
COL5A1 |
rs61735045 |
9:137642654 |
13 |
c.G1588A |
0,149 |
4,66 (0,252–86,351), p = 0,301 |
|
COL5A1 |
rs61736966 |
9:137688701 |
36 |
c.A2852G |
0,268 |
2,91(0,147–57,579), p = 0,484 |
Из данных табл. 4 следует, что два полиморфных локуса COL5A1 (rs61735045,OR = 4,66; rs61736966, OR = 2,91) являются, вероятно, ассоциированными с акне тяжелого течения (p > 0,05). Два полиморфных локуса COL5A1 (rs145178917, OR = 0,40; rs138579182, OR = 0,55) (OR < 1), обеспечивают вероятное профилактическое влияние в развитии акне.
Характеристика полиморфных локусов генов коллагена COL7A1 в экзонах у больных акне представлены в табл. 5.
Таблица 5
Характеристика полиморфных локусов гена COL7A1 в экзонах у больных акне
|
Ген |
Полиморфный локус (SNP) |
Позиция (hg19) |
Номер экзона |
Вид и позиция замены ДНК |
p-value (z-тест для пропорций) |
OR (95 % доверительный интервал), уровень значимости |
|
COL7A1 |
-(.) |
3:48602258 |
117 |
c.G8776A |
0,526 |
1,22 (0,049–30,606), p = 0,903 |
|
COL7A1 |
rs79378857 |
3:48621017 |
40 |
c.C4373T |
0,526 |
1,22 (0,049–30,606), p = 0,903 |
|
COL7A1 |
rs35761247 |
3:48623124 |
30 |
c.C3830T |
0,917 |
0,86 (0,22–3,784), p = 0,917 |
|
COL7A1 |
rs200268115 |
3:48623834 |
26 |
c.A3481G |
0,526 |
1,22 (0,048–30,606) , p = 0,903 |
|
COL7A1 |
rs2228561 |
3:48628014 |
14 |
c.C1784T |
0,713 |
0,81 (0,311–2,223), p = 0,714 |
Как видно из данных табл. 5, три SNPs гена COL7A1 (-(.), OR = 1,22; rs79378857, OR = 1,22; rs200268115, OR = 1,22) ассоциированы с тяжелой формой акне. При этом один SNPs гена COL7A1 были определены нами впервые. Два SNPs гена COL7A1 (rs35761247, OR = 0,86; rs2228561, OR = 0,81), вероятно, обеспечивают протективную роль при акне.
Известно, что основным компонентом внеклеточного матрикса являются коллагены – суперсемейство белков, которое включает 29 генетически гетерогенных коллагенов (I-XXIX). Молекулы коллагена состоят из трех субъединиц полипептидной природы – α-цепей. При этом некоторые коллагены являются гомотримерами, другие могут быть гетеротримерной структуры, состоящие из двух или даже трех генетически различных полипептидных субъединиц. Поэтому имеется более 40 генов, которые кодируют субъединицы разных генетически гетерогенных молекул коллагена.
Показано, что на основании структуры волокон коллагена в тканях генетически различные коллагены были разделены на разные подгруппы. Так установлено, что в формировании больших внеклеточных фибрилл участвуют коллагены I, II, III, V типов, в связи, с чем они названы фибриллообразующими. Коллаген IV типа формирует в структуре базальной мембраны сетчатый каркас, коллаген VI типа компонуется в микрофибриллы, а коллаген VII типа обеспечивает синтез якорных фибрилл. Существует группа коллагенов – FACIT (fibril-associated collagens with interrupted triple helices, ассоциированные с фибриллами коллагены с прерывистыми тройными спиралями), включающая коллагены IX, XII, XIV, XIX, XX и XXI типов [6].
Основными коллагенами в коже человека являются типы I и III, которые составляют примерно 80 % и 10 % от общей массы коллагена соответственно (табл. 6). Эти два коллагена объединяются с образованием широких внеклеточных волокон, характерных для дермы человека. Коллаген V типа представлен в большинстве соединительных тканей, включая дерму, в которой содержится в количестве менее 5 % от общего количества коллагена. В дерме имеется коллаген V типа, который расположен на поверхности крупных волокон коллагена, которые состоят из коллагенов I и III типа. При этом коллаген V типа регулирует латеральный рост этих волокон. Другим важным коллагеном кожи является коллаген IV типа, присутствующий в дермо-эпидермальном соединении, а также в мембранах сосудов.
Таблица 6
Генетическая гетерогенность коллагена в коже человека
|
Тип |
Состав цепи тропоколлагена |
Разновидность коллагена |
Гены, кодирующие коллаген |
Преимущественное распределение в тканях |
|
I |
[α1 (I)]2α2 (I) |
Фибриллярный |
COL1A1 COL1A2 |
Дерма, кость, сухожилия |
|
II |
[α1 (II)]3 |
Фибриллярный |
COL2A1 |
Ядро межпозвоночных дисков, хрящ, стекловидное тело глаза |
|
III |
[α1 (III)]3 |
Фибриллярный |
COL3A1 |
Дерма плода, кровеносные сосуды, желудочно-кишечный тракт |
|
IV |
[α1 (IV)]2α2 (IV)а |
Базальная мембрана |
COL4A1 COL4A2 |
Во всех тканях |
|
V |
[α1 (V)]2α2 (V)a |
Фибриллярный |
COL5A1 COL5A2 |
Во всех тканях |
|
VI |
α1 (VI) α2 (VI) α3 (VI)а |
Микрофибриллы |
COL6A1, COL6A2, COL6A3, COL6A4, COL6A5, COL6A6 |
Во всех тканях |
|
VII |
[α1 (VII)]3 |
Якорные фибриллы |
COL7A1 |
Якорные фибриллы |
|
VIII |
[α1 (VIII)]3 |
Формирует сеть |
COL8A1 |
Ткань эндотелия |
|
XIII |
[α1 (XIII)]3 |
Трансмембранный |
COL13A1 |
Встречается во всех тканях, включая эпидермис |
|
XIV |
[α1 (XIV)]3 |
FACITb |
COL14A1 |
Кожа, роговица |
|
XV |
[α1 (XV)]3 |
Базальная мембрана |
COL15A1 |
Встречается во всех тканях |
|
XVII |
[α1 (XVII)]3 |
Трансмембранный |
COL17A1 |
Полудесмосомы в коже, роговице, слизистой оболочке |
|
XXIX |
Неизвестно |
Неизвестно |
COL19A1 |
Эпидермис |
Примечание. aДополнительные α-цепи были идентифицированы. bКоллагены, связанные с фибриллами, с прерывистыми тройными спиралями. Показано распространение в коже и других основных тканях; меньшие количества могут присутствовать в других тканях.
Дополнительно к основным типам коллагена, в коже человека имеется несколько минорных коллагенов, локализующихся в ограниченных участках, однако являющихся необходимыми для обеспечения стабильности кожи. Среди таких коллагенов отмечен коллаген VII типа, который входит в структуру якорных фибрилл, а также в коллаген XVII.
Коллаген XVII типа локализуется в полудесмосомах в комплексе с интегрином α6β4, плектином и ламинином-332 (ламинином-5). Имеются сообщения, что коллаген типа XXIX является предполагаемым эпидермальным коллагеном и максимально экспрессируется в супрабазальных слоях. Имеются сведения, что коллаген имеет значение при атопическом дерматите, однако его характеристика в настоящее время неполная.
Установлено, что якорные фибриллы являются специализированными комплексами на границе эпителий/мезенхима в ряде тканей. Так, в коже якорные фибрилллы фиксируются с одной стороны к нижней порции дермо-эпидермальной базальной мембраны и с другой – к нижележащей верхней части сосочкового слоя дермы. По данным иммуногистохимических исследований установлено, что большинство якорных фибрилл обоими концами прикрепляются к lamina densa, что обеспечивает фиксацию интерстициальных волокон коллагена в U-образные структуры [6].
Показано, что процесс синтеза и увеличения количества коллагена во внеклеточном матриксе регулируется совокупностью регуляторных механизмов, которые включают воспаление и ростовые факторы. Так, установлено, что в процессе фиброгенеза основным регулирующим фактором является воспаление. При этом выявлено, что трансформирующий фактор роста b (transforming growth factor-b, TGF-β) избыточно экспрессируется во всех фиброзных тканях, что вызывает активацию синтеза коллагена. Кроме того, TGFβ1, кодируемый геном TGFB, относится к профиброзирующим факторам, который стимулирует синтез коллагена, снижает разрушение внеклеточного матрикса и вызывает приток фибробластов в зону фиброза [7].
Полученные результаты проведенного нами исследования позволили дать характеристику идентифицированных вариантов нуклеотидной последовательности генов коллагена COL1A1, COL2A1, COL1A2, COL3A1, COL5A1, COL7A1 у пациентов с тяжелой формой акне. Все SNPs генов коллагена (4 SNPs гена COL1A1, 3 SNPs гена COL1A2, 6 SNPs гена COL2A1, 5 SNPs гена COL3A1, 4 SNPs гена COL5A1, 5 SNPs гена COL7A1) впервые выявлены нами у больных тяжелой формой акне. Анализ выявленных в нашем исследовании вариантов нуклеотидной последовательности генов коллагена показал, что акне тяжелого течения достоверно ассоциировано с COL2A1 rs3803183 и COL3A1 rs41263773.
Ген COL1A1 кодирует про-альфа1 цепи коллагена типа I, являющийся фибриллообразующим коллагеном, входящим в состав большинства соединительных тканей. Мутации в этом гене вызывают несовершенный остеогенез типов I–IV, синдром Элерса – Данлоса, болезнь Каффи и идиопатический остеопороз [8]. Отмечается, что в формировании гипертрофических рубцов участвует именно COL1A1 [9].
Ген COL1A2 кодирует про-альфа2 цепь коллагена I типа, и мутации в этом гене связаны с несовершенным остеогенезом типов I–IV, синдромом Элерса – Данлоса, идиопатическим остеопорозом и атипичным синдромом Марфана. Однако симптомы, связанные с мутациями в этом гене, обычно менее серьезны, чем мутации в гене альфа-цепи коллагена I типа (COL1A1), что отражает различную роль альфа-цепей в целостности матрикса [10].
Ген COL2A1 кодирует альфа-1 цепь коллагена типа II, который является основным компонентом внеклеточного матрикса. Молекулярные дефекты в гене COL2A1 вызывают широкий спектр редких аутосомно-доминантных состояний, известных как коллагенопатии типа II. Показано, что мутации в COL2A1, гене коллагена типа II, могут приводить к широкому разнообразию фенотипов в зависимости от природы мутации. Однако на сегодня четкое соотношение генотип – фенотип пока остается неизвестным [11].
Ген COL3A1 кодирует про-альфа1 цепи коллагена III типа, являющийся структурным компонентом соединительной ткани кожи, легких, матки, кишечника и сосудов. Коллаген III типа классифицируется как один из основных фибриллярных коллагенов и составляет около 5–20 % от всего содержания коллагена в организме человека. Мутации в этом гене связаны с синдромом Элерса – Данлоса типа IV, а также с аневризмами аорты и артерий. Подробный анализ экспрессии мРНК, основанный на секвенировании РНК 27 различных органов и тканей человека от 95 чел., был проведен Fagerberg et al. [12].
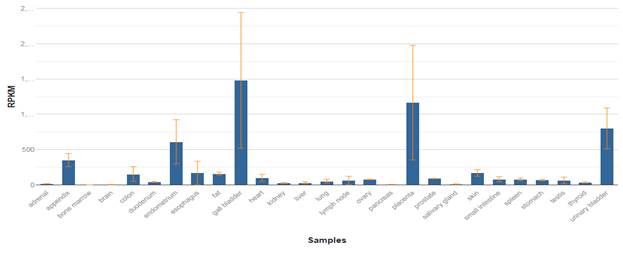
Рис. 1. Распределение мРНК COL3A1 в тканях человека [12]
В настоящее время известно, что тромбоциты взаимодействуют с коллагеном типа III через специфические гликопротеины и рецепторы, не являющиеся интегринами. Коллаген типа III также участвует в клеточной адгезии, миграции, пролиферации и дифференцировке посредством взаимодействия с интегринами, которые являются рецепторами клеточной поверхности. Показано, что в фибробластах кожи человека аденозин действует через свои рецепторы и стимулирует экспрессию COL3A1 через канонический и неканонический путь передачи сигналов Wnt / β-catenin.
Повышенное количество коллагена III типа обнаруживается при многих приобретенных фиброзных заболеваниях человека, таких как фиброз почек и печени, а также системный склероз. Коллаген типа III, как известно, взаимодействует с коллагенами типа I и II в образовании фибрилл и является важным регулятором диаметра фибрилл; увеличение содержания коллагена III типа приведет к образованию более тонких фибрилл. Коллаген III типа также является критическим компонентом агрегации тромбоцитов и, таким образом, запускает каскад свертывания крови [13].
Ген COL5A1 кодирует альфа-цепь коллагена V типа, который может быть структурным белком тканей наряду с коллагеном I типа и возможным регулятором сборки гетеротипических волокон. Кодируемый белок проколлагена регистрируется в качестве гетеротримера про-альфа1 (V) -про-альфа1 (V) -про-альфа2 (V). Имеются данные, что мутации в этом гене выявляются при синдроме Элерса – Данлоса I и II типов [14].
Ген COL7A1 кодирует альфа-цепь коллагена VII типа. Мутации в этом гене связаны со всеми формами дистрофического буллезного эпидермолиза. Однако при отсутствии мутаций приобретенная форма этого заболевания может быть результатом аутоиммунного ответа на коллаген VII типа [15].
Результаты анализа ген-генных взаимодействий представлены на рис. 2.
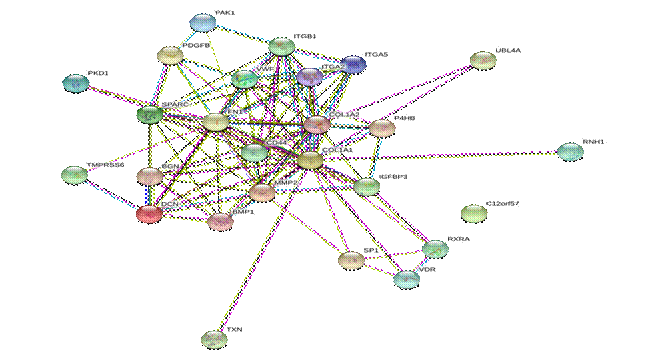
Рис. 2. Ген-генные взаимодействия генов коллагена.
Цвет линий отражает характер взаимодействий: бирюзовый – из известных баз данных, фиолетовый – экспериментальные данные, зеленый – сродство генов, красный – слияние генов, синий – совпадение генов, желтый – текстовый майнинг, черный – коэкспрессия, голубой – гомология белков [4]
Заключение
Полученные данные по вариантам полиморфных локусов генов коллагена COL1A1, COL1A2. COL2A1, COL3A1, COL5A1, COL7A1, по-видимому, ассоциированы с развитием тяжелой формы акне. В результате это, возможно, является фактором риска дисбаланса коллагенообразования в очагах поражения при акне и, вследствие хронической воспалительной реакции, обуславливает пролонгацию фазы заживления с последующим формированием рубцов.
Таким образом, проведенные исследования позволили впервые выявить полиморфные локусы генов коллагена, дисбаланс синтеза и деградации которого, вероятно, является патофизиологическим механизмом акне. Для подтверждения роли ассоциации SNP с различными патогенетическими механизмами тяжелого течения акне необходимо продолжение данного направления исследований.



