Надо отметить, что в патогенезе значительного числа заболеваний лежат окислительный стресс и воспалительный процесс. Поэтому для комплексной терапии и профилактики большинства заболеваний рекомендуются препараты с антиоксидантной и противовоспалительной активностью. С этой точки зрения привлекают внимание фитопрепараты, содержащие одновременно природные антиоксиданты и противовоспалительные вещества. Перспективным источником биологически активных веществ и фитопрепаратов, обладающих антиоксидантной, антирадикальной и противовоспалительной активностью, является репейничек волосистый – Agrimonia pilosa Ledeb. (Rosaceae). A. pilosa – многолетнее травянистое растение с широким ареалом, издавна применяемое в народной и традиционной медицинах как противораковое, антиоксидантное, противовоспалительное, антидиабетическое средство. Противораковую активность A. pilosa связывают с активностью агримониина (полифенола), ингибирующего рост опухоли in vivo [1]. Экстракты A. pilosa уменьшают чувство усталости и утомления, используются при астении и для купирования воспалений при аллергических заболеваниях [2]. Полифенолы и тритерпеноиды A. pilosa ингибируют окислительный стресс и гипергликемию при сахарном диабете 2-го типа [3]. Cухой водный экстракт надземной части A. pilosa эффективен для коррекции десинхроноза ритма «сон – бодрствование» [4]. Широкий спектр биологической активности, проявляемый A. pilosa, объясняется наличием разнообразных биологически активных веществ (БАВ) в сырьевой части растения, большая часть из которых обладают антиоксидантной и противовоспалительной активностью [2, 3, 5, 6]. Исследования взаимосвязи химического состава, антиоксидантной активности и противовоспалительного действия экстрактов A. pilosa не проводились.
Цель исследования – выявление взаимосвязи химического состава, антиоксидантной и противовоспалительной активности экстрактов, полученных из надземной части A. pilosa.
Материал и методы исследования
Материал для исследований – Agrimoniae pilosae экстракт травы сухой (СЭ) и жидкие экстракты (ЖЭ) травы и морфологических частей A. pilosa.
Жидкие экстракты получены методом трехкратной экстракции при нагревании (60–900С), в качестве экстрагентов использовались: вода очищенная и водно-спиртовые смеси с содержанием этилового спирта 40% и 90%. Способ получения СЭ заключался в трехкратной экстракции надземной части A. pilosa спиртом этиловым 40% (гидромодуль 1:20) при нагревании (900С) с последующим отгоном спирта этилового, упариванием и сушкой в вакуум-сушильном аппарате [7].
Полученные ЖЭ исследовали на наличие антиоксидантной активности (АОА) по их способности защищать адреналина гидрохлорид в растворе от аутоокисления [8]. Данный метод является экспрессным, не требует сложного оборудования, прост в исполнении и дает однозначные результаты, что является его преимуществом перед другими методами определения АОА. Суть методики заключается в следующем: 0,2 мл раствора 0,1%-ного адреналина гидрохлорида в 3 мл карбонат гидрокарбонатного буфера (pH=10,65) после экспозиции при обычном освещении и при комнатной температуре (в течение 10 минут) спектрофотометрируют на приборе СФ-56 при длине волны 347 нм на фоне карбонат гидрокарбонатного буфера – опыт № 1 (ОП 1). Опыт № 2 – к 0,2 мл раствора 0,1%-ного адреналина гидрохлорида в 3 мл карбонат гидрокарбонатного буфера добавляют по 0,02 мл исследуемых ЖЭ и спектрофотометрируют через 10 минут экспозиции при тех же условиях на фоне смеси 3 мл карбонат гидрокарбонатного буфера с 0,02 мл исследуемых ЖЭ (ОП 2). Расчет показателя АОА проводят по формуле:
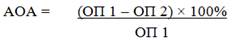
Значение показателя АОА более 10% свидетельствует о наличии антиоксидантной активности у исследуемых ЖЭ.
Оценка противовоспалительной активности СЭ
Противовоспалительную активность (при остром и хроническом воспалении) исследовали на белых крысах-самцах массой 180–200 г. Животных содержали в стандартных условиях вивария (в клетках по 6–7 животных, на дне древесная стружка, свободный доступ к воде и пище) (Центральная научно-исследовательская лаборатория ФГБОУ ВО НГМУ, г. Новосибирск). При проведении экспериментов руководствовались принципами, изложенными в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации. Исследование одобрено локальным этическим комитетом ФГБОУ ВО НГМУ (приказ № 66 от 01.03.2021 г.).
Дизайн эксперимента: для исследования противовоспалительной активности СЭ всех животных разделили на 6 групп по 6–7 животных в каждой. В 3 группах животных провели исследование на модели острого асептического воспаления, в 3 группах – на модели хронического воспаления, из них: 2 группы животных – контрольные, 2 группы – экспериментальные, 2 группы – сравнения.
Исследуемый СЭ растворяли в подогретой воде очищенной и вводили через зонд в желудок животным экспериментальных групп ежедневно (7 дней) в одно и то же время суток (утром) в дозе 100 мг/кг (содержание суммы веществ фенольной природы составляет около 40 мг).
Контрольной группе животных при тех же условиях вводили воду очищенную.
В качестве препарата сравнения использовали кислоту ацетилсалициловую (АСК). Выбор препарата сравнения обусловлен несколькими факторами: во-первых, АСК является производной салициловой кислоты (фенолокислоты), что сближает ее с фенольными соединениями в СЭ, во-вторых, физиологические механизмы противовоспалительного действия АСК к настоящему времени подробно изучены. Проявление противовоспалительного и болеутоляющего действия наблюдается в диапазоне высоких и стандартных доз [9]. Нами выбрана стандартная доза. АСК в виде раствора в воде очищенной вводили животным через зонд в желудок в дозе 20 мг/кг в течение 7 дней (группа сравнения).
Модель «каррагенинового отека». При введении каррагенина (0,1 мл 1%-ного водного раствора) под плантарный апонефроз задней правой лапки животного развивается острое асептическое воспаление, наблюдаются покраснение, увеличение объема лапки, повышение температуры и болезненность в месте введения. На пике воспаления (через 3,5 часа) определяют величину отека по объему вытесненной лапкой воды (в мл).
Модель «ватной гранулемы». Имплантацией под кожу животного стерильного ватного тампона (10 мг) вызывают пролиферативное хроническое воспаление. Сформировавшиеся гранулемы на 8-й день эксперимента вычленяют и взвешивают (масса сырой гранулемы), затем сушат при 600С, доводят до постоянной массы и вновь взвешивают (масса высушенной гранулемы). Пролиферативную активность исследуемого СЭ оценивают по разнице между исходной массой ватного тампона (10 мг) и массой высушенной гранулемы. Влияние на экссудативную часть воспалительного процесса оценивают по разнице между массами сырой и высушенной до постоянной массы гранулемы.
Анализ состава и содержания элементов в СЭ проводили методом масс-спектрометрии с индуктивно связанной плазмой (МС-ИСП) с использованием масс-спектрометра ELAN DRC-е ICP-MS и оптико-эмиссионного спектрометра Agilent 715 ICP-OES. Пробоподготовка для анализа элементов включала обработку навески СЭ азотной кислотой с последующим использованием микроволновых систем разложения Speedwave TM MWS-3+ и BERGHOF. Контроль проводили методом добавок [10].
Статистическую обработку результатов фармакологических исследований проводили в соответствии с ОФС 1.1.0013.15 (Государственная фармакопея 14-го издания) [11]. Для расчетов использовали программу Statistica 8.0. Статистическую значимость различий оценивали с использованием критерия Стьюдента. Различия сравниваемых величин считали достоверными при p≤0,05.
Результаты исследования и их обсуждение
При анализе электронных спектров поглощения исходного 0,1%-ного раствора адреналина гидрохлорида и смеси 0,1%-ного раствора адреналина гидрохлорида с исследуемыми ЖЭ A. pilosa в карбонат гидрокарбонатном буфере было отмечено, что все ЖЭ предотвращают окисление адреналина, но в разной степени (рис. 1).
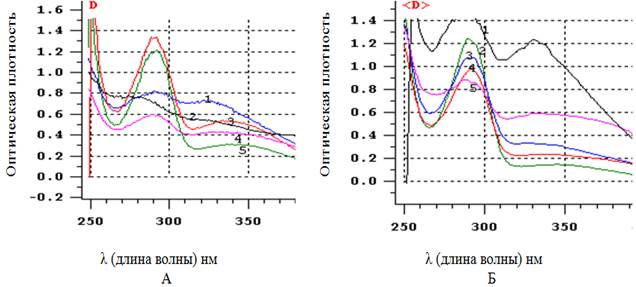
Рис. 1. Спектры поглощения 0,1%-ного раствора адреналина гидрохлорида в карбонат гидрокарбонатном буфере (спектр № 1) и продуктов взаимодействия 0,1%-ного раствора адреналина гидрохлорида с исследуемыми ЖЭ A. pilosa в карбонат гидрокарбонатном буфере. Спектры поглощения: А – водные ЖЭ (2 – из травы, 3 – из стеблей, 4 – из листьев, 5 – из соцветий); Б – спиртовые ЖЭ (2 – из соцветий, 3 – из травы, 4 – из листьев, 5 – из стеблей)
Биоэлементный комплекс (биологически активные вещества и элементы с переменной валентностью), содержащийся в исследуемых ЖЭ, в значительной степени предотвращает аутоокисление адреналина гидрохлорида, что находит отражение в снижении показателя поглощения продуктов их взаимодействия в ряду: ЖЭ из соцветий ˃ ЖЭ из листьев ˃ ЖЭ из травы ˃ ЖЭ из стеблей (рис. 1).
Результаты расчетов показателей АОА исследуемых ЖЭ представлены на рисунке 2. Наибольшие показатели АОА выявлены для ЖЭ, полученных из соцветий и листьев, наименьшие – для ЖЭ, полученного из стеблей. Такая закономерность наблюдается для всех ЖЭ, полученных с использованием разных экстрагентов.
Ранее при исследовании накопления основных групп БАВ в траве и в отдельных морфологических частях A. pilosa нами было установлено, что наибольшая концентрация антиоксидантов (флавоноидов, дубильных веществ, каротиноидов, аскорбиновой кислоты, хлорофиллов, оксикоричных и фенолкарбоновых кислот) наблюдается в листьях и соцветиях [12]. Полученные результаты по АОА, проявляемой ЖЭ из листьев и соцветий A. pilosa, подтверждают наличие прямой зависимости между содержанием биоэлементного комплекса и степенью проявления данной активности. Надо отметить, что проявляемая АОА зависит от экстрагента, используемого для получения ЖЭ. ЖЭ, полученные с использованием спирта этилового 40%-ного, проявляют большую АОА, чем ЖЭ, полученные экстракцией водой очищенной и спиртом этиловым 90%-ным. Это связано с тем, что спирт этиловый 40%-ный извлекает из травы и морфологических частей A. pilosa биологически активных веществ и элементов, ответственных за АОА, в большей степени, чем вода и спирт этиловый 90%-ный [7]. Из этой закономерности выбиваются все ЖЭ из соцветий, значения показателей АОА которых наиболее высоки и близки между собой (рис. 2). Надо отметить, что ЖЭ из травы (включающей все морфологические части) проявляет большую АОА, чем ЖЭ из листьев (получены экстракцией спиртом этиловым 40%-ным).
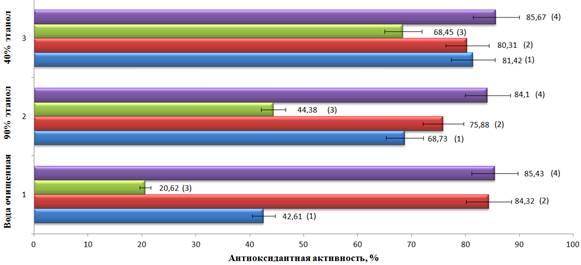
Рис. 2. Зависимость антиоксидантной активности СИ A. pilosa от используемого экстрагента и морфологической части растения. СИ: 1 – из травы, 2 – из листьев, 3 – из стеблей, 4 – из соцветий
Для дальнейших исследований из травы A. pilosa был получен СЭ (экстрагент спирт этиловый 40%-ный) [7]. Органолептические показатели СЭ: мелкозернистый порошок светло-коричневого цвета, со слабым травяным запахом, горького вкуса, вяжущего действия. СЭ хорошо растворим в спирте этиловом 40%-ном при 200С и воде очищенной при нагревании; гигроскопичный.
Фитохимический анализ СЭ показал значительное содержание полифенольных окисляемых соединений (танинов) (до 30%), флавоноидов (до 5%), кумаринов (до 3,5%), фенолкарбоновых и оксикоричных кислот (до 6%), аминокислот (до 2%), аскорбиновой кислоты (14 мг%), хлорофиллов (71 мг%), каротиноидов [7].
Элементный состав СЭ включает 61 элемента, за исключением элементов-органогенов (C, H, N, O), которые методом МС-ИСП не определяются. В СЭ присутствуют все жизненно необходимые макро- и микроэлементы [4, 13]. При расположении элементов по убыванию их концентраций (до 1 мкг/г) получили следующий аккумулятивный ряд: K > Mg > Ca > P > Si > Na > Al > Br > Fe > B > Zn > Mn > Rb > Sr > La > Ti > Cu > Ni > As > Cr > Cs > Sb > V > Co, подтверждающий наличие и значительное содержание элементов с переменной валентностью (выделены в ряду) в СЭ, что очень важно для проявления антиоксидантной активности (рис. 3).
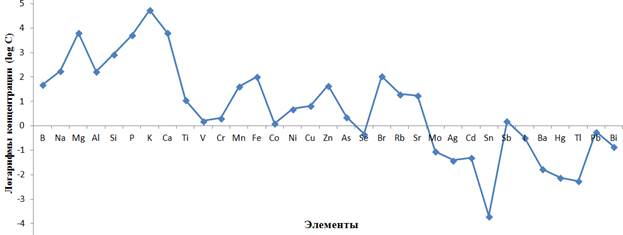
Рис. 3. Состав и содержание элементов в Agrimoniae pilosae экстракте травы сухом (в логарифмической шкале log10)
Содержание токсичных элементов в СЭ не превышает ПДК, принятых для чая и напитков [14].
Известно, что при одновременном присутствии в экстрактах растений соединений-антиоксидантов, относящихся к разным химическим классам, наблюдается синергизм в проявлении их АОА [5]. Возможно, в проявлении высокой АОА Agrimoniae pilosae экстракта травы сухого мы наблюдаем явление синергизма активности БАВ, преимущественно веществ фенольной природы и элементов с переменной валентностью.
При введении каррагенина в лапку животного контрольной группы наблюдаются развитие припухлости (отек), покраснение, повышение температуры и болезненность в месте его введения. При наблюдении за животными в течение 6 часов с момента введения флогогенного агента максимальный размер отека наблюдался через 3,5 часа. При введении каррагенина на фоне СЭ и АСК также наблюдались увеличение объема лапки животного, наличие покраснения, повышения температуры и болезненность в месте введения, но в меньшей степени. При сравнительном анализе экспериментальных данных по противовоспалительной активности СЭ (100 мг/кг) и препарата сравнения – АСК (20 мг/кг) при остром воспалении выявлено, что СЭ и АСК значительно снижают (на 50% и 52,2% соответственно) объем отека лапки животного по сравнению с контрольной группой (рис. 4А). Снижение объема отека лапки животного связано с уменьшением проницаемости капилляров и нормализацией процессов микроциркуляции. Снижение проницаемости капилляров и улучшение микроциркуляции происходят за счет высокой концентрации фенольных соединений (флавоноидов и кумаринов) в СЭ, а стабилизирующее действие на клеточные стенки лизосом могут оказывать полифенольные соединения (дубильные вещества).
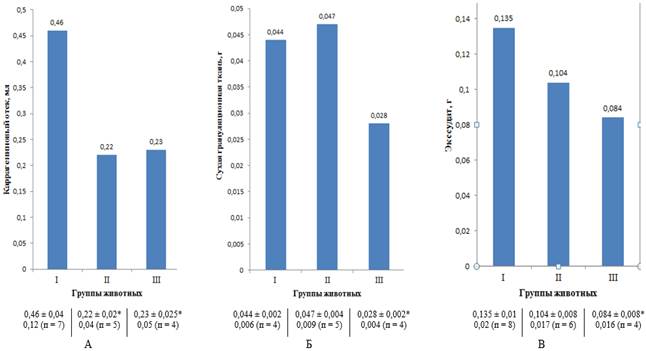
Рис. 4. Противовоспалительная активность сухого экстракта A. pilosa (n=6),
(M±m; р≤0,05); А – острое воспаление (модель «каррагенинового отека»),
Б, В – хроническое воспаление (модель «ватной гранулемы»), группы животных:
1 – контрольная (модель патологии + вода очищенная эквиобъемно опытному введению),
2 – сравнения (модель патологии + АСК (20 мг/кг)),
3 – опытная (модель патологии + СЭ (100 мг/кг));
* – достоверно по отношению к контролю
Хронические, вялотекущие воспалительные процессы часто приводят к нежелательным последствиям – разрастанию гранулематозно-фиброзной ткани и замещению ею нормальных тканей – и, как следствие, к деформации, потере функций. Поэтому наличие антипролиферативного действия у исследуемого СЭ является его преимуществом перед другими противовоспалительными препаратами, обладающими активностью только в острой фазе воспаления. При пероральном введении крысам раствора СЭ в дозе 100 мг/кг на фоне хронического воспаления наблюдается значительное снижение массы гранулематозно-фиброзной ткани по сравнению с группой контроля (на 36,6%). Препарат сравнения (АСК в дозе 20 мг/кг) при том же способе введения на фоне хронического воспаления, показавший значительное противовоспалительное действие при остром воспалительном процессе, в данном случае активности не проявил, даже оказал пропролиферативное действие (рис. 4Б).
При сравнительном анализе влияния СЭ (100 мг/кг) и АСК (20 мг/кг) при их пероральном введении на фоне хронического воспаления на массу экссудата было выявлено, что СЭ оказывает антиэкссудативное действие в большей степени, чем препарат сравнения, поскольку снижал массу экссудата на 37,8%, а АСК – на 23,1% по сравнению с группой контроля (рис. 4В).
Экспериментальные результаты по исследованию антиоксидантной и противовоспалительной активности СЭ A. pilosa, полученные в данной работе, в высокой степени коррелируют с результатами экспериментов, проведенных с использованием других методик исследования данных видов биологической активности in vivo и in vitro [3].
Выводы
1. Экстракты, полученные из травы и морфологических частей A. pilosa, обладают выраженной антиоксидантной активностью. Наибольшую антиоксидантную активность проявили экстракты, полученные из травы, соцветий и листьев при использовании спирта этилового 40%-ного в качестве экстрагента.
2. Снижение объема экссудата при остром и хроническом воспалении (на 50% и 37,8% соответственно) и массы гранулематозно-фиброзной ткани (на 36,6%) при использовании Agrimoniae pilosae экстракта травы сухого свидетельствует о наличии у него противовоспалительной активности, сравнимой с противовоспалительной активностью препарата сравнения (ацетилсалициловой кислотой).
3. Высокая антиоксидатная и противовоспалительная активность Agrimoniae pilosae экстракта травы сухого определяется его биоэлементным комплексом: в нем присутствуют полифенольные окисляемые соединения (танины) (до 30%), флавоноиды (до 5%), кумарины (до 3,5%), фенолкарбоновые и оксикоричные кислоты (до 6%), аминокислоты (до 2%), аскорбиновая кислота, хлорофиллы и элементы с переменной валентностью (Si, Br, Fe, Mn, Cu, Ni, Cr, Co).
4. Наблюдается взаимосвязь между химическим составом и проявлением антиоксидантной активности и противовоспалительного действия суммарных извлечений из травы и морфологических частей Agrimoniae pilosae.



