Действие наркотических веществ на организм человека сопровождается ответом физиологических и метаболических систем, что включает в себя изменения гормонального баланса, особенно гормонов гипоталамо-гипофизарно-надпочечниковой системы, нейромедиаторного обмена, экспрессии нейротрофических факторов и других белков нервной ткани, активацию воспаления, синтез и секрецию провоспалительных факторов – цитокинов, интенсификацию свободнорадикальных процессов и др. Такой широкий спектр метаболических изменений на фоне развития наркотической зависимости создает основу для разработки лабораторных диагностических технологий [1, 2]. Сама диагностика наркопатологии традиционно основана на определении самих субстанций наркотических веществ или их метаболитов в биологических жидкостях на базе химико-токсикологических лабораторий. Вышеперечисленные группы лабораторных маркеров нацелены на решение других задач – лабораторный мониторинг и прогнозирование течения синдрома зависимости. При этом традиционно указанные задачи решаются на основе субъективных данных клинического обследования, тогда как клиническая лабораторная диагностика в этих условиях призвана объективизировать весь диагностический процесс [3, 4].
Среди показателей, которые могут потенциально использоваться в лабораторном мониторинге наркопатологии, отдельно стоит выделить маркеры состояния прооксидантно-антиоксидантной системы и отдельно – маркеры тиолового гомеостаза как наиболее чувствительного звена системы антиоксидантной защиты. Такие показатели, как уровень тиоловых групп, концентрация восстановленного глутатиона и активность ферментов его метаболизма, – одни из наименее специфичных параметров, тем не менее, их высокая чувствительность часто позволяет использовать их для динамического наблюдения за развитием и прогрессированием патологического процесса, контролировать эффективность проводимой терапии, прогнозировать развитие осложнений или рецидивов, особенно характерных для заболеваний наркологического профиля [5]. Высокая чувствительность данного звена системы неспецифической резистентности организма связана с наиболее низким уровнем Red-Ox потенциала SH-групп белков и низкомолекулярных соединений, что позволяет проявлять наиболее выраженные восстановительные свойства и антиоксидантные характеристики [6]. Оценка одновременно неферментных параметров плазмы крови (белковые SH-группы) и эритроцитарной взвеси (восстановленный глутатион), а также ферментативного звена (глутатионпероксидаза, глутатионредуктаза, глутатионтрансфераза и др.) позволяет комплексно охарактеризовать состояние окислительного гомеостаза, что актуально ввиду многоуровневого характера структурной и функциональной организации системы антиоксидантной защиты [7].
Цель исследования – оценка изменений показателей тиолового гомеостаза в крови больных с синдромом зависимости от опиоидов и психостимуляторов в процессе проведения дезинтоксикационно-стабилизационного и реабилитационно-противорецидивного лечения.
Материалы и методы исследования
Исследование было выполнено с участием 20 относительно здоровых испытуемых лиц мужского пола, включенных в контрольную группу (1-я группа). Данные испытуемые лица проходили диспансеризацию на базе Клиники ФГБОУ ВО КубГМУ Минздрава России, в ходе которой у них осуществляли забор крови из локтевой вены в объеме 4–5 мл в пробирки с натриевой солью ЭДТА в качестве антикоагулянта и хелатора металлов с переменной валентностью, что должно было остановить интенсификацию свободнорадикальных процессов в процессе хранения и транспортировки биологической жидкости. Все лабораторные исследования были выполнены в день забора биоматериала. Основную группу испытуемых лиц составили 18 больных с синдромом зависимости от опиоидов или психостимуляторов (2-я группа), которые наблюдались и проходили курс лечения на базе ГБУЗ «Наркологический диспансер» Министерства здравоохранения Краснодарского края. У больных 2-й группы осуществляли забор крови из локтевой вены в объеме 4–5 мл в пробирки с натриевой солью ЭДТА на 4 этапах: на этапе поступления в стационар до начала купирования психических нарушений (1-й этап), по окончании дезинтоксикационно-стабилизационного этапа терапии (2-й этап), в начале реабилитационного этапа (3-й этап) и в конце реабилитации (4-й этап). Длительность дезинтоксикационного этапа терапии составляла 15–18 суток, после чего в течение нескольких дней решался вопрос о начале реабилитации, продолжавшейся на протяжении 4–5 месяцев. Включение добровольцев или больных в исследование осуществляли только после получения письменного добровольного информируемого согласия.
В крови исследуемых лиц контрольной и основной групп н всех этапах лечения определяли показатели, характеризующие состояние системы тиолового гомеостаза. Уровень SH-групп в плазме крови определяли с помощью методики, основанной на реакции с дитиобиснитробензойной кислотой, при этом отдельно определяли легко- и труднодоступные тиоловые группы, реагирующие в течение 3 и 30 минут соответственно. В эритроцитарной взвеси после осаждения белков сульфосалициловой кислотой определяли содержание восстановленной формы трипептида глутатиона, данная методика была также основана на реакции с дитиобиснитробензойной кислотой и высвобождении желтого тионитрофенильного аниона пропорционально концентрации тиолсодержащего метаболита. Активность глутатионпероксидазы определяли энзиматическим способом, основанным на регистрации скорости использования глутатиона в реакции восстановления трет-бутил гидропероксида [8].
Статистическую обработку данную осуществляли с использованием программы StatPlus версия 7 (AnalystSoft Inc.). Характер распределения показателей отличался от гауссовой кривой, поэтому данные в работе были представлены в виде медианных значений и процентилей (25-го и 75-го), а сравнение показателей осуществляли с помощью непараметрических критериев. Сравнение показателей 1-й и 2-й группы между собой проводили с помощью критерия Манна–Уитни, сравнение показателей 2-й группы, полученных на разных этапах терапии, проводили с помощью критерия Уилкоксона. Различия между показателями считали статистически значимыми при уровне р<0,05.
Результаты исследования и их обсуждение
Исследование состояния тиолового звена системы антиоксидантной защиты показало развитие у больных с синдромом зависимости от психостимуляторов и опиоидов нарушений, характеризующихся снижением уровня тиоловых групп в плазме крови, снижением концентрации глутатиона и активности глутатионпероксидазы в эритроцитарной взвеси. На этапе поступления больных 2-й группы в стационар уровень общих SH-групп был снижен на 27% относительно контроля. При этом также было отдельно определено содержание легко- и труднодоступных тиоловых групп. Уровень 1-й фракции сульфгидрильных групп на начальном этапе был даже несколько увеличен – на 25% относительно контроля, содержание 2-й фракции тиоловых групп было в аналогичных условиях снижено в 2 раза. Концентрация глутатиона в эритроцитарной взвеси больных 2-й группы на этапе поступления в стационар была снижена относительно нормальных значений, характерных для исследуемых лиц 1-й группы, на 26%. Активность глутатионпероксидазы также на этапе, предшествовавшем началу терапии, была ниже контрольных цифр на 49% (таблица).
Изменения показателей тиолового гомеостаза в плазме крови и эритроцитах больных с синдромом зависимости от опиоидов и психостимуляторов в процессе лечения и реабилитации (Ме(р25;р75))
|
Исследуемые показатели |
Исследуемые группы |
||||
|
1-я (контрольная группа) |
2–1 |
2–2 |
2–3 |
2–4 |
|
|
Глутатион-пероксидаза, мкмоль/л*мин |
458 (427;480) |
235* (214;258) |
303*^ (278;320) |
304* (281;324) |
601*^ (545;627) |
|
Глутатион, мкмоль/л |
2,42 (2,36;2,52) |
1,78* (1,70;1,85) |
1,95*^ (1,86;2,02) |
1,80* (1,74;1,92) |
2,31^ (2,21;2,38) |
|
SHобщие, 100*е.о.п./г белка |
0,62 (0,60;0,64) |
0,45* (0,43;0,47) |
0,49* (0,48;0,52) |
0,47* (0,45;0,50) |
0,47* (0,46;0,51) |
|
SHл, 100*е.о.п./г белка |
0,20 (0,18;0,22) |
0,25* (0,22;0,27) |
0,19 (0,18;0,22) |
0,21 (0,18;0,23) |
0,16 (0,15;0,20) |
|
SHт, 100*е.о.п./г белка |
0,42 (0,41;0,44) |
0,21* (0,19;0,24) |
0,27*^ (0,24;0,29) |
0,27* (0,25;0,29) |
0,30*^ (0,28;0,34) |
Примечания: статистически значимые отличия от показателя контрольной группы; ^ – статистически значимые отличия от показателя, полученного на предыдущем этапе наблюдения.
После проведения лечения и реабилитации рассматриваемые показатели имели тенденцию к увеличению в сторону нормальных значений. Проведение дезинтоксикационно-стабилизационного лечения, включавшего купирование основных психических нарушений и снижение проявлений эндогенной интоксикации, сопровождалось статистически значимым увеличением активности глутатионпероксидазы – на 29% относительно данных, полученных на этапе поступления в стационар. В это же время было определено небольшое увеличение концентрации глутатиона в эритроцитарной взвеси – на 10% и уровня труднодоступных тиоловых групп в плазме крови на 29%. Этот этап лечения характеризовался положительными тенденциями, тем не менее, практически все показатели по-прежнему заметно отставали от контрольного уровня. Активность глутатионпероксидазы в этих условиях отставала от значения соответствующего параметра исследуемых лиц 1-й группы на 34%, концентрация глутатиона – на 19%, уровень SH-групп – на 21%. Перевод больных на реабилитационный этап сопровождался в некоторых случаях некоторой задержкой после проведения дезинтоксикационно-стабилизационного курса терапии, поэтому значения показателей на начало реабилитации также были определены отдельно. Тем не менее, статистически значимых отличий между параметрами на 2-м и 3-м этапах наблюдения выявлено не было.
Проведение реабилитационных мероприятий наиболее значительно отражалось в изменениях показателей состояния тиолового звена системы антиоксидантной защиты. Это может быть связано как с исходно сравнительно менее выраженным дисбалансом прооксидантно-антиоксидантной системы, так и большей длительностью данного этапа ведения больных с синдромом зависимости от опиоидов и психостимуляторов. Так, после 4-го этапа наблюдения активность глутатионпероксидазы увеличивалась в 2 раза относительно 3-го этапа и даже превышала контрольные значения аналогичного параметра на 31%. Такой характер изменений, вероятнее всего, подтверждает частичную нормализацию ферментных систем метаболизма глутатиона с переходом от фазы декомпенсации к изменениям компенсаторного характера (рисунок).
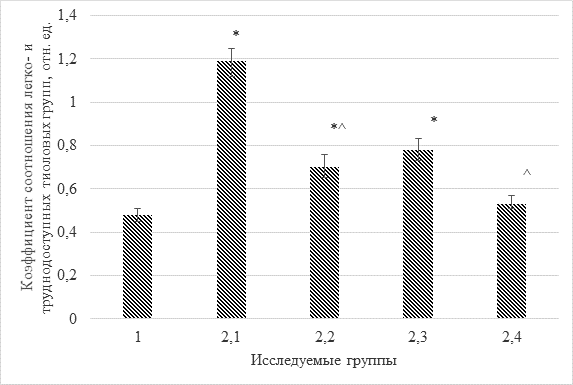
Изменения соотношения легко- и труднодоступных тиоловых групп в плазме крови больных с синдромом зависимости от опиоидов и психостимуляторов в процессе лечения и реабилитации (Ме(р25;р75))
Примечания: статистически значимые отличия от показателя контрольной группы; ^ – статистически значимые отличия от показателя, полученного на предыдущем этапе наблюдения.
Также после проведения реабилитационно-противорецидивных мероприятий отмечалось статистически значимое увеличение концентрации глутатиона в эритроцитарной взвеси больных 2-й группы. Более того, уровень рассматриваемого лабораторного показателя достигал контрольных значений, определенных у исследуемых лиц 1-й группы. Только уровень тиоловых групп в плазме крови оставался таким же сниженным, как и на этапе поступления в стационар еще на 1-м этапе лечения. При этом происходили изменения отдельных фракций тиоловых групп, направленные на увеличение доли труднодоступных SH-групп и снижение уровня легкодоступных. Уровень легкодоступных SH-групп уже на 2-м этапе наблюдения соответствовал контрольным цифрам, а содержание медленно реагирующих или труднодоступных тиоловых групп постепенно возрастало. Рост последнего параметра составлял 43% относительно значения, полученного на этапе поступления больных в стационар. Тем не менее, и данный показатель, как и уровень общих сульфгидрильных белковых групп, оставался статистически значимо ниже контрольного значения даже после проведения реабилитации (таблица). Полученные данные свидетельствуют о сохранении нарушений тиолового гомеостаза, что может также проявляться как низкоинтенсивный окислительный стресс у больных с синдромом зависимости от опиоидов и психостимуляторов и формировать неблагоприятный метаболический фон для прогрессирования заболевания и рецидивирования.
Лучшим способом оценить изменения соотношений отдельных типов SH-групп является определение коэффициента их соотношения (рисунок). На представленном рисунке хорошо заметно наиболее значительное снижение анализируемого параметра уже после проведения дезинтоксикационно-стабилизационного этапа лечения больных, а в дальнейшем – даже полная нормализация соотношения легко-/труднодоступных тиоловых групп белков плазмы крови. Изменения анализируемого показателя могут быть обусловлены окислительными повреждениями белковых молекул или изменениями их конформации при связывании с эндотоксинами, что ведет к перестройке и перераспределению фракций SH-групп. Таким образом, нормализация данного соотношения может свидетельствовать о восстановлении организма после окислительного стресса и эндогенной интоксикации. Остается только проблема сниженного содержания общего количества тиоловых групп, которую потенциально может решить дополнительная метаболическая поддержка на реабилитационном этапе с использованием широкого спектра средств антиоксидантной направленности действия.
Заключение
Представленные в работе данные показали динамику нормализации нарушений окислительного гомеостаза на примере изменений лабораторных показателей крови, характеризующих состояние тиолового звена системы антиоксидантной защиты. Основным результатом стало определение тенденции к нормализации показателей тиолового обмена после дезинтоксикационно-стабилизационного этапа терапии, наиболее выраженной уже после проведения реабилитации. Тем не менее, даже после проведения полноценного курса лечения были определены увеличенное значение активности глутатионпероксидазы и сниженная концентрация тиоловых групп в плазме крови. Это указывает на сохранение некоторого дисбаланса прооксидантно-антиоксидантной системы, но уже имеющего признаки компенсаторного характера. Для полноценного восстановления функционального состояния компонентов подсистемы тиолового гомеостаза в перспективе может быть использована антиоксидантная терапия.
Исследование выполнено при финансовой поддержке Кубанского научного фонда в рамках научного проекта № МФИ-20.1/117.



