Ювенильный идиопатический артрит (ЮИА) – распространенный тип хронического ревматоидного заболевания, поражающего детей в возрасте до 16 лет и являющегося одной из важных причин ранней инвалидизации [1]. Эпидемиологические исследования показали, что уровень заболеваемости ЮИА колеблется от 1,6 до 23 на 100 000 детей в год, а распространенность ЮИА составляет 3,8–400 на 100 000 детей в Европе. Девочки имеют более высокий уровень заболеваемости, чем мальчики (10,0 на 100 000 по сравнению с 5,7 на 100 000) [1–3]. Негативное воздействие ЮИА на физическое и психическое развитие детей наносит серьезный ущерб качеству жизни больных детей, вызывая боли в суставах, физическую инвалидность, беспокойство и депрессию [4–7]. Патогенетических средств от ЮИА пока нет. Тем не менее, ЮИА требует интенсивного лечения, чтобы контролировать его развитие и симптоматику. Для этого тяжелого заболевания с до сих пор неясной этиологией важно понять лежащие в его основе молекулярные механизмы, определяемые в настоящее время с помощью новых высокотехнологичных подходов, в первую очередь, благодаря развитию высокопроизводительных омикс-технологий.
Целями данной работы явились рассмотрение основных трудностей и проблем классификации ЮИА с учетом неясной этиологии данного заболевания, эволюции классификации ЮИА путем сравнения с классификацией артритов у взрослых, поиск решения проблем этиологии и классификации с помощью современных методов молекулярной генетики.
Материалом данного обзорного и дискуссионного исследования явились публикации отечественных и зарубежных авторов по теме классификации артритов у детей и взрослых в свете клинических данных и современных результатов молекулярно-генетических исследований.
Результаты исследования и их обсуждение
ЮИА является группой заболеваний, весьма разнородных по этиологии и клинической картине. В настоящее время он подразделяется на семь подтипов в соответствии с Рабочей группой по педиатрии Международной лиги ассоциаций ревматологов (ILAR) [8], включая системный артрит, олигоартрит, RF-отрицательный полиартрит, RF-положительный полиартрит, псориатический артрит, энтезит-ассоциированный артрит и недифференцированный артрит [9]. Олигоартрит является самой распространенной категорией ЮИА, на которую приходится 50–60% всех случаев; частоты других подтипов: полиартрит – 30–35%, системный ЮИА – 10–20%, псориатический артрит – 2–15%, энтезит-ассоциированный артрит – 1–7% [10]. По прошествии 25 лет с момента клинического применения классификации ILAR на сегодняшний день стало понятно, что некоторые подтипы ЮИА весьма гетерогенны, например RF-отрицательный полиартрит и псориатические субтипы [10]. Неоднозначность классификации некоторых пациентов также была проблемой. В настоящее время предпринимаются клинические усилия по пересмотру классификации ILAR [11].
Подтипы ILAR представляют собой незавершенную работу, и их недостатки в настоящее время широко признаны. К ним относятся сложные и часто противоречивые критерии включения и исключения; смена подтипов у пациентов, отслеживаемых с течением времени; и растущее количество доказательств того, что границы ILAR не отражают биологию основного заболевания. По сути, возрастное ограничение на возрасте 16 лет определено без какой-либо патофизиологической или эпидемиологической основы и представляет собой зияющий номенклатурный разрыв, который разделяет педиатрическую и взрослую ревматологию [12]. Поскольку количество новых методов лечения сейчас превышает доступность пациентов для клинических исследований, сейчас, как никогда, важно определить биологические подгруппы в рамках детского артрита, чтобы выявить пациентов, которые получат пользу от таргетного воздействия на конкретный механизм заболевания, учитывая результаты, полученные у пациентов с артритом в разных странах мира. Возрастные рамки не должны применяться из-за неточности номенклатуры по всему возрастному диапазону.
Сейчас задача состоит в том, чтобы более точно определить характеристики подгрупп пациентов. В недавних попытках решения этой сложной проблемы использовались клинические биомаркеры и биомаркеры крови, морфологические характеристики и обоснованные мнения экспертов [13]. Тем не менее, такие исследования ограничены педиатрическими пациентами и сталкиваются с дополнительной проблемой, заключающейся в том, что отдельные процессы могут давать конвергентные клинические фенотипы. Например, серонегативный и серопозитивный ревматоидный артрит (РА) взрослых обнаруживает значительное клиническое совпадение, несмотря на фундаментальные различия в роли аутоантител, комплемента и синовиальных Т-клеток [14]. Фенотипическая конвергенция аналогичным образом проиллюстрирована на животных моделях артрита, в которых сходные клинические признаки могут проявляться совершенно разными путями. Таким образом, хотя фенотипирование пациента важно для определения подгруппы и действительно потребуется для клинической практики, дополнительные подходы остаются необходимыми. Одним из таких подходов являются генетические исследования. Эволюция классификации ЮИА и ревматоидного артрита взрослых представлена в таблице 1 и на рисунке 1.
Таблица 1
Классификация ювенильных артритов
|
Американская коллегия ревматологов (ACR), 1977 |
Европейская лига против ревматизма (EULAR), 1977 |
Международная лига ревматологических ассоциаций (ILAR), 1997 |
|
Ювенильный ревматоидный артрит
Системный
Полиартрикулярный
Олиго-(пауци-)артрикулярный
|
Ювенильный хронический артрит:
Системный
Полиартрикулярный Ювенильный ревматоидный артрит (РФ+)
Олиго-(пауци-) артрикулярный
Ювенильный псориатический артрит
Ювенильный анкилозирующий спондилит |
Ювенильный идиопатический артрит:
Системный
Полиартрикулярный (РФ-)
Полиартрикулярный (РФ+)
Олигоартрикулярный Персистирующий Прогрессирующий
Псориатический артрит
Артрит, ассоциированный с энтезитом Недифференцированный артрит |
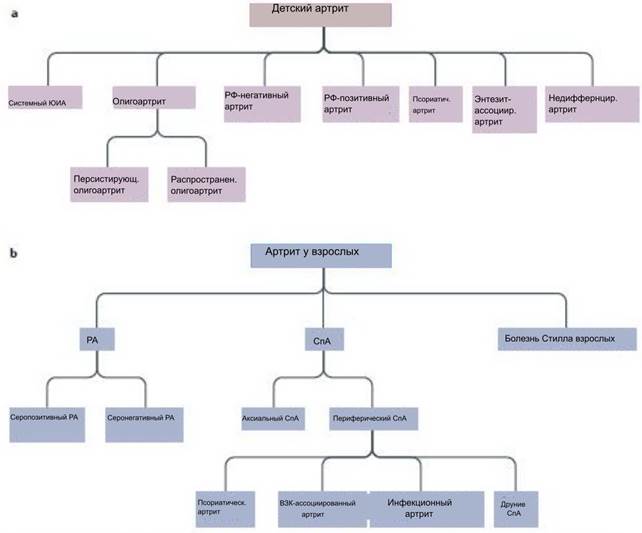
Рис. 1. Современная классификация артритов у детей и взрослых. a) Основные диагностические категории воспалительного артрита, начинающегося в детском возрасте (до шестнадцатилетнего возраста), согласно номенклатуре Международной лиги ассоциаций ревматологов; b) Основные диагностические категории воспалительного артрита, начинающегося во взрослом возрасте (16 лет и старше). РФ – ревматоидный фактор; РА – ревматоидный артрит; СпА – спондилоартрит; ВЗК – воспалительное заболевание кишечника
При учете неясной этиологии ЮИА и неоднозначности его классификации идентификация моногенных форм ЮИА позволила получить значительные знания о некоторых важнейших молекулярных механизмах (табл. 2).
Таблица 2
Гены, коррелирующие с моногенными формами ювенильного идиопатического артрита (ЮИА)
|
Гены |
Причинные мутации (PMID) |
Связанный подтип ЮИА |
Функциональное доказательство (PMID) |
Механизм |
|
LRBA |
|
Олигоартрит |
Генотип LRBA -/- у мышей продуцирует высокие уровни сывороточного и секреторного IgA (28652580) |
Дефекты периферической толерантности |
|
NFIL3 |
p.Ml701 (30552177) |
Системный ЮИА |
Мутации NFIL3 вызывают повышение уровня IL-1β (30552177) |
Сенсибилизация при артрите. Перепрограммирование иммунной системы на сверхэкспрессию IL-1 |
|
LACC1 |
p.Cys284Arg(27881174) p.Ile254Val (27881174) rs3816311 (27098602) p.Arg414Ter (2917096) p.Ile330del (2917096) p.Cys43Tyrfs*6 (30872671)
|
Системный ЮИА |
Уровень TNF был повышен у мышей с генотипом LACC -/-Транскрипты и белок LACC1 имели повышенный уровень под воздействием LPS и других TLR-лигандов в макрофагах и дендритных клетках (30510070) |
Регулирование процесса воспаления |
|
UNCD13 |
c.117 + 143A>G (29409136) 753+3[G>A] (18240215) 1579[C>T] R527W (18240215) |
Системный ЮИА |
Munc13-4 имел высокую экспрессию в дифференцированных человеческих NK-клетках и эффекторных CD8+ T-лимфоцитах. Уровни экспрессии Munc13-4 избирательно повышались при дифференцировке цитотоксических лимфоцитов (24842371) |
Нарушение связывания фактора транскрипции |
В последние годы многочисленные локусы восприимчивости были идентифицированы с помощью полногеномных ассоциативных исследований (GWAS) аутоиммунных заболеваний. С применением молекулярно-генетических и геномных технологий в исследованиях ЮИА в семьях ЮИА были идентифицированы некоторые патологические генетические варианты [15]. Хотя некоторые факторы риска расположены в кодирующих областях генов, влияющих на структуру белка и приводящих к заметной клинической значимости, существенно большее количество факторов риска связано с некодирующими областями, содержащими регуляторные элементы, которые могут влиять на структуру хроматина или связывание некодирующей РНК, и, соответственно, влияют на экспрессию генов тканеспецифичным или иным образом [16]. Исследования функциональных генов в этих локусах значительно расширили наши знания о патогенезе, лежащем в основе этого сложного заболевания.
Среди идентифицированных генетических локусов ЮИА локус лейкоцитарного антигена человека (HLA) оказывает сильнейшее влияние на генетическую предрасположенность к ЮИА, поскольку он играет важную роль в аутоиммунной деструкции [17]. Гены HLA локализованы в области Chr6 p21.3, включая гены классов HLA I и HLA II. Антигены, представленные молекулами HLA класса I, имеют внутриклеточное происхождение, тогда как антигены, представленные молекулами HLA класса II, происходят из внеклеточных белков. Белки HLA на сегодняшний день являются наиболее полиморфными продуктами, кодируемыми геномом человека (табл. 3). Множественные вариации их аминокислотного состава были обусловлены эволюционным преимуществом гетерозиготности, что позволяет представлять многочисленные антигены от возникающих патогенов, несмотря на повышенный риск многих полигенных заболеваний [17].
Таблица 3
HLA-аллели, ассоциированные с различными подтипами ЮИА
|
Подтип ЮИА |
Аллели риска |
Протективные аллели |
|
Олигоартрит и полиартрит |
A2, DRB1*01, DRB1*08, DRB1*11 |
DRB1*04, DRB1*07, DRB1*15:01 |
|
РФ-негативный артрит |
DRB1*13, DPB1*02, DPB1*03, DQB1*04 |
|
|
РФ-позитивный артрит |
DRB1*04:01, DRB1*04:05 |
|
|
Системный ЮИА |
HLA-DRB*11 |
|
|
Энтезит-ассоциированный артрит |
B*27:04, B*27:05 |
На сегодняшний день проведено множество исследований для проверки связи между ЮИА и функциональными генами-кандидатами с известными биологическими функциями или ассоциациями с другими аутоиммунными заболеваниями, такими как ревматоидный артрит у взрослых (РА) и диабет 1-го типа (СД1). Кроме того, ряд ассоциированных с ЮИА локусов, не относящихся к HLA, был идентифицирован с помощью метода полногеномных ассоциативных исследований (GWAS). Большинство этих локусов расположены в некодирующих областях, примерно половина из них перекрывается с локусами ревматоидного артрита у взрослых [18].
Сейчас идентифицированы 23 локуса ЮИА, несущих 33 гена, за пределами области HLA, имеющие общегеномное значение. Для систематического изучения потенциальных плейотропных эффектов генов, связанных с различными аутоиммунными заболеваниями, был проведен метаанализ GWAS в 10 различных группах детей с аутоиммунными заболеваниями [19]. SNP в 7 локусах ADGRL2, PTPN22, TENM3, ANKRD55, IL2RA, IL21 и ANKRD30A – были идентифицированы в связи как с ЮИА, так и с другими аутоиммунными заболеваниями, такими как общий вариабельный иммунодефицит, аутоиммунный тиреоидит, анкилозирующий спондилит, целиакия, язвенный колит, болезнь Крона и системная красная волчанка, хотя некоторые локусы имеют противоположное направление действия [20]. Гены в локусах ЮИА GWAS обогащены сигнальными путями, играющими ключевую роль как при врожденных иммунных ответах, так и в адаптивном иммунитете, демонстрируя взаимодействия друг с другом.
Хорошо известно, что только около 2% последовательностей в геноме человека кодирует белки [20]. Какую же роль играют остальные 98% некодирующих регионов? Исследования различных участков генома представили доказательства того, что некодирующие последовательности действительно могут транскрибироваться в функциональные молекулы РНК или связывать факторы транскрипции для тонкой настройки транскрипции генов как в нормальных физиологических, так и в патологических процессах [21, 22]. В эпоху GWAS исследователи обнаружили, что подавляющее большинство SNP, ассоциированных с заболеваниями, были сопоставлены с некодирующими областями генома человека, включая интронные и межгенные области [23].
Ellis et al. в полногеномном анализе идентифицировали дифференциальное метилирование ДНК промоторных областей в Т-клетках периферической крови пациентов с ЮИА, ранее не получавших метотрексат, по сравнению со здоровым контролем. Было обнаружено, что снижение метилирования в IL32 гене было связано с ЮИА [24]. Ai et al. собрали фибробластоподобные синовиоциты (FLS) у 4 пациентов с ранним РА и 3 пациентов с ЮИА и использовали ранее описанные 11 случаев длительного РА и 11 случаев остеоартрита в качестве контроля для изучения метилома ДНК. Исследование показало, что ранний РА и ЮИА объединяются с давним РА, но отличаются от остеоартрита. ЮИА отделился от группы длительного РА и сформировал подмножество в супергруппе РА. Эти данные свидетельствуют о том, что воспалительные повреждения при ЮИА и РА могут быть вызваны аномальным метилированием, а уровни метилирования связаны с типами и стадиями заболевания [25].
Гистоновые деацетилазы (HDAC) представляют собой «стиратели» ацетилирования, которые могут деацетилировать как гистоновые, так и негистоновые белки. HDAC участвуют в клеточной передаче сигналов, эпигенетической регуляции и играют важную роль в регуляции функции Teff-клеток и Treg-клеток [26]. Помимо вышеупомянутых молекул HLA II, связанных с системным ЮИА, исследования показали эпигенетические эффекты HDAC9 в регуляции критических врожденных иммунных процессов посредством деацетилирования гистоновых белков [27, 28]. Ингибиторы HDAC (HDACi), которые широко исследуются в качестве препаратов для лечения аутоиммунных заболеваний, в настоящее время исследуются при ЮИА [29, 30], что повышает вероятность того, что HDACi представляют собой возможные таргетные терапевтические стратегии при ЮИА.
В генетической лаборатории Национального медицинского исследовательского центра детской ортопедии и травматологической хирургии им. Г.И. Турнера также ведется работа по поиску генетических маркеров этиологии и патогенеза ЮИА. Был исследован ряд полиморфизмов гена интерлейкина 6, генов апоптоза FasL и TRAIL [31, 32].
Выявлены достоверные различия в распределении генотипов между пациентами с ЮИА и контрольной группой в российской популяции (Санкт-Петербург). Это указывает на то, что данные полиморфизмы могут в определенной степени служить диагностическими маркерами при изучении патогенеза ЮИА в европейской популяции Российской Федерации. В настоящее время нами продолжаются исследования других провоспалительных цитокинов, а также других возможных генетических, фармакогенетических и эпигенетических маркеров этиопатогенеза ЮИА. В частности, исследуются гены, связанные с апоптозом, и гены фолатного цикла. По нашему мнению, основные рекомендации для будущих исследований ЮИА лежат также в плоскости эпигенетических модификаций воспалительных процессов, которые приводят к запуску аутоиммунного переключения у больных ЮИА и людей, находящихся в группе риска.
Заключение
Таким образом, ЮИА – это группа заболеваний, весьма разнородных по этиологии и клинической картине. Исследования мультиомики вносят значительный вклад в понимание генетической основы и молекулярного механизма патогенеза ЮИА. Подобно другим сложным заболеваниям человека, лишь небольшая часть семейных случаев ЮИА может быть связана с мутациями одного гена. В большинстве спорадических случаев ЮИА развитие болезни определяется генетическими, эпигенетическими элементами и факторами окружающей среды. Хотя ЮИА был разделен на 7 подтипов, между подтипами наблюдается фенотипическое перекрытие, что свидетельствует об общей генетической и эпигенетической основе. Помимо генетических компонентов, эпигенетические модификации также вносят вклад в патогенез и развитие ЮИА. Общие и различные эпигенетические регуляции между подтипами ЮИА еще мало понятны, а взаимодействие между генетическими и эпигенетическими механизмами требует дальнейшего изучения. ЮИА и РА у взрослых также имеют ряд сходств и различий в этиологии и патогенезе. В первую очередь, различия происходят оттого, что патологический процесс практически любого заболевания имеет свои возрастные особенности. Не являются исключением и различные виды артритов. Тем не менее, ряд сходных черт в этиологии и патогенезе имеется у целого ряда артритов независимо от возраста, в частности при наличии ревматоидного фактора. Интегративный анализ генетических, эпигенетических и транскриптомных данных необходим для выяснения полной картины молекулярных механизмов, лежащих в основе подтипов ЮИА и РА, их этиологической основы и для классификации случаев ЮИА и РА по молекулярным маркерам, а также для дальнейшего облегчения разработки лекарств и их репозиционирования.



