Всемирная организация здравоохранения (ВОЗ) 11 марта 2020 г. объявила глобальную пандемию новой коронавирусной инфекции (НКИ), которая охватила к настоящему времени 187 стран мира. Клиническая картина НКИ может характеризоваться как отсутствием симптомов или их умеренным количеством, так и критическими проявлениями заболевания, включая полиорганную недостаточность и смерть.
Сахарный диабет (СД) связан как с более тяжелым течением инфекции во время пандемии НКИ, так и с повышенным риском смерти у госпитализированных пациентов. Риск поступления в отделение интенсивной терапии и госпитальной смертности увеличивается в 2–3 раза из-за наличия у пациентов с пневмонией НКИ сахарного диабета[1].
СД как сопутствующее заболевание при НКИ считается одним из значимых факторов риска развития неблагоприятных исходов вследствие более тяжелого течения инфекции в условиях гипергликемии и других отягощающих факторов у данных пациентов, таких как пожилой возраст, ожирение, высокая частота сопутствующих патологий (артериальной гипертензии, сердечно-сосудистых заболеваний). Высокие показатели смертности, осложнения и потребность в интенсивной терапии отражают негативное влияние сахарного диабета на прогноз больных НКИ [2].
Для успешного лечения НКИ на фоне СД важно выявить предикторы неблагоприятных исходов с сочетанием НКИ и СД, чтобы своевременно выбрать оптимальную тактику ведения таких пациентов. Для этого необходимо раскрыть механизмы заболевания, связанные с более тяжелым течением сочетанной патологии, без чего невозможен правильный выбор патогенетической терапии.
Цель исследования – изучить прогностическое значение таких показателей, как СРБ, ИЛ-6, лейкоциты, тромбоциты и Д-димер, у пациентов с сочетанием сахарного диабета второго типа и COVID-19.
В большом количестве современных исследований показано, что больные СД – это наиболее уязвимая категории лиц при НКИ. Так, по статистике, уровень летальности пациентов с СД и коронавирусной инфекцией и пациентов, страдающих только СД, в Китае составляет 7,8% против 2,7%, в США – 28,8% против 6,2%, в Англии – 31,4 % против 14,2% соответственно [3].
По данным многочисленных исследований было выявлено, что существует связь между уровнем СРБ, ИЛ-6, лейкоцитов, гемоглобина, тромбоцитов и Д-димера и тяжестью течения НКИ у пациентов с СД. Так, проанализированные данные наглядно демонстрируют, что у пациентов с СД и НКИ имеются более высокие значения данных показателей по сравнению с пациентами, страдающими только НКИ.
В настоящее время рассматриваются несколько патогенетических механизмов связи между СД и тяжестью НКИ. К ним относятся: иммунная дисфункция, повышенная воспалительная нагрузка, вирусная нагрузка.
Иммунная дисфункция влияет на функциональные свойства нейтрофилов. Так, снизилась их хемотаксическая и фагоцитарная способность при СД при повышении скорости апоптоза. Неполноценные нейтрофилы были признаны в качестве медиаторов тяжелого течения НКИ, так как способствовали развитию острого респираторного дистресс-синдрома через усиленную выработку мощнейших окислителей молекул, таких как супероксидные радикалы и H2O2, и поддержание воспалительного состояния в легких, вызывая выработку провоспалительных цитокинов [4].
V. Brinkmann et al. (2012) выявили, что нейтрофилы высвобождают гранулированные белки и волокна хроматина с образованием внеклеточного матрикса, известного как нейтрофильная внеклеточная ловушка (НВЛ), которая иммобилизует патогены, такие как бактерии и вирусы, и способствует иммунной защите [5].Однако стойкое образование НВЛ оказывает провоспалительный эффект, как при НКИ, где выработка большого количества НВЛ была связана с сосудистыми осложнениями, повреждением легких и тяжестью заболевания [6].
По результатам исследования W. Zhou et al. (2020), продолжающееся воспаление у пациентов, страдающих сочетанной патологией – СД и НКИ, может являться причиной развития неблагоприятных исходов [7]. Глубокая воспалительная реакция и активация «цитокинового шторма» при НКИ в сочетании с разрушением эндотелиальных клеток с последующим высвобождением прокоагулянтных молекул способствуют активации коагуляционного каскада и развитию тромботических осложнений.
Повышенный уровень ИЛ-1β у пациентов с НКИ свидетельствует о том, что воспалительному процессу предшествует клеточный пироптоз, опосредованный активацией NOD-подобного рецептора семейства инфламмасомы. Так, при СД окислительный стресс индуцирует образование инфламмасомы NLRP3 через активацию пути NF-kB [8]. При НКИ активация инфламмасомы происходит с помощью различных механизмов. С одной стороны, проникновение SARS-CoV-2 в клетки альвеолярного эпителия может приводить к их пироптозу, в дальнейшем, как следствие, происходит высвобождение молекул, запускающих активацию NRP3 альвеолярных макрофагов [9].С другой стороны, вирус связывает рецепторы ACE2 на пневмоцитах, в то время как его N-белки активируют каскад комплемента и высвобождают анафилатоксины C3a и C5a, которые также индуцируют активацию инфламмасомы [10].
Хроническое воспаление играет важную роль в патогенезе диабетических микро- и макрососудистых осложнений, которые, в свою очередь, являются основными факторами риска неблагоприятных исходов НКИ во многих когортах [11, 12, 13].
В проанализированных исследованиях был изучен уровень С-реактивного белка (СРБ) у больных НКИ и СД [14, 15]. Было установлено, что уровень данного маркера достоверно выше у пациентов, страдающих НКИ и СД, чем у пациентов только с НКИ. Результаты представлены на рисунке 1 [16, 17, 18].
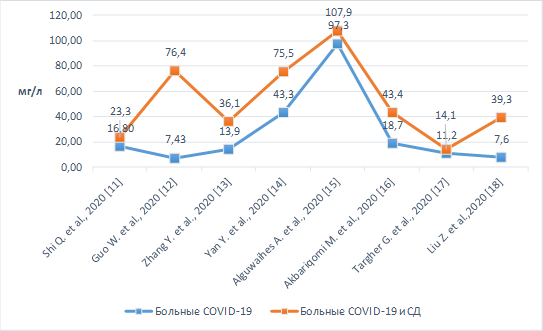
Рис. 1. Уровень СРБ у пациентов с СД и НКИ и у пациентов только НКИ
Известно, что «цитокиновый шторм» – это гипервоспалительное состояние, которое обусловливает сверхзащитное состояние организма. Данное явление может характеризовать тяжелое течение НКИ. «Цитокиновый шторм» провоцирует развитие отека легких, системного капиллярного кровотечения, гипотензивного шока и иногда – развитие полиорганной недостаточности. Полиорганная недостаточность связана у пациентов с СД и НКИ в первую очередь с хроническим воспалением, которое усиливает гипервоспалительное состояние. Таким образом, определение уровня СРБ может отразить степень вовлечения тканей в воспалительный процесс, а также прогнозировать тяжесть течения заболевания у пациентов с НКИ и СД. Необходим динамический контроль при лабораторном обследовании пациентов с НКИ, так как лечение должно быть направлено на снижение воспалительного повреждения. Данный биомаркер не позволяет полностью объяснить развитие неблагоприятных исходов, наблюдаемых у пациентов с СД и НКИ, но является одним из предикторов тяжелого течения.
Для оценки состояния пациентов также имеет значение уровень ИЛ-6, который считается ранним прогностическим маркером высокого риска летального исхода при тяжелой степени гипоксии. Проанализированные исследования свидетельствуют о том, что уровень ИЛ-6 у пациентов с НКИ и СД находится на более высоком уровне по сравнению с пациентами, страдающими только НКИ. Результаты определения уровня ИЛ-6 по данным исследований у больных СД и НКИ отображены на рисунке 2, являются достоверными [13, 19, 20].
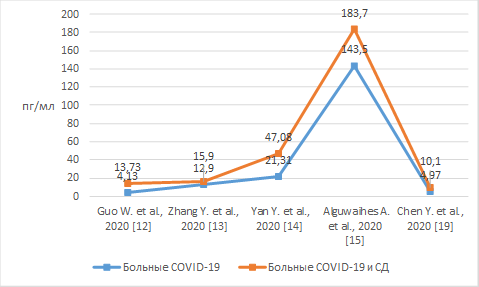
Рис. 2. Уровень ИЛ-6 у пациентов с СД и НКИ и у пациентов только с НКИ
Повышенные уровни ИЛ-6 у пациентов с НКИ и СД рассматриваются как важный параметр в прогнозировании наиболее тяжелого течения заболевания и необходимости интенсивной терапии.
ИЛ-6 относится к цитокинам воспаления, избыточная выработка которого приводит к «цитокиновому шторму». При НКИ острый респираторный дистресс-синдром (ОРДС) вызван чрезмерным выделением цитокинов [21]. ОРДС приводит к поражению клеток, экспрессирующих поверхностные рецепторы ангиотензинпревращающего фермента 2 (АПФ2), далее происходят активная репликация и высвобождение вируса. Запускается механизм высвобождения поврежденных молекулярных структур клетками хозяина (такими как АТФ, нуклеиновые кислоты, олигомеры ASC (аскорбиновая кислота)). Эпителиальные клетки, эндотелиальные клетки и альвеолярные макрофаги распознают данные молекулы и запускают продукцию провоспалительных цитокинов, включая ИЛ-6. К месту инфекции присоединяются моноциты, макрофаги и Т-клетки. Воспалительная реакция прогрессирует, и заболевание протекает в тяжелой форме. Таким образом, у пациентов с СД риск и скорость прогрессирования ОРДС выше в связи с хронически повышенным уровнем ИЛ-6 на фоне гипергликемии [22].
Степень повышения уровня ИЛ-6 коррелирует с выраженностью инсулинорезистентности. Одним из механизмов инсулинорезистентности является глюкозотоксичность, длительная гипергликемия, которая снижает действие инсулина. Происходит десентизация глюкозотранспортных систем (ГЛЮТ) в бета-клетках поджелудочной железы и адипоцитах. Считается, что дисфункция ГЛЮТ связана с гиперпродукцией ИЛ-6 [23]. В исследовании Guo W et al. указано на то, что пациенты с СД больше подвержены образованию «воспалительного шторма», который в конечном итоге приводит к быстрому ухудшению течения НКИ [12].
Пациенты с СД с неудовлетворительным контролем гликемии подвержены более высокой активности «цитокинового шторма» и риску неблагоприятного исхода вирусной инфекции [24]. Более частый контроль уровня гликемии необходим для своевременной коррекции углеводного обмена.
Гипергликемию следует принимать во внимание при оценке тяжести и прогноза у пациентов с НКИ и СД. У пациентов с НКИ при высоком уровне HbA1c может наблюдаться более тяжелое течение заболевания, сама инфекция также может привести к повышению уровня HbA1c [25]. В исследовании Z. Wang et al. (2020) была выявлена положительная корреляционная связь между концентрацией HbA1c и маркерами воспаления (СРБ, СОЭ, ферритин) в случаях НКИ и СД [26].
Кроме того, хроническая гипергликемия во время инфекции НКИ может увеличить высвобождение воспалительных цитокинов, привести к риску развития кетоацидоза и сосудистых осложнений, что позволяет объяснить тяжесть инфекции SARS-CoV-2 у больных сахарным диабетом [26].
Авторами многочисленных исследований было установлено, что количество лейкоцитов было достоверно выше у пациентов с диабетом и НКИ, чем у пациентов без диабета, что может быть объяснено тем фактом, что первые были более восприимчивы к патогенам после вирусной инфекции из-за иммунной дисфункции [27]. Результаты определения уровня лейкоцитов у больных СД и НКИ и больных НКИ представлены на рисунке 3 [11, 19, 20].
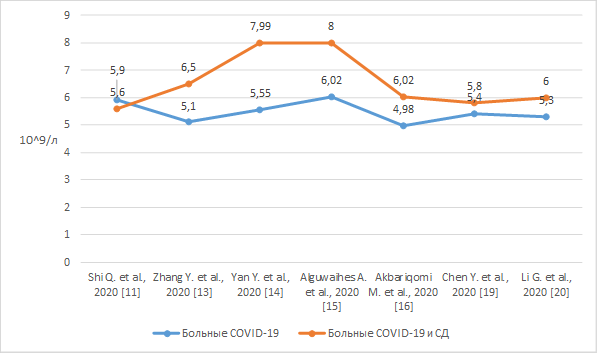
Рис. 3. Уровень лейкоцитов у пациентов с СД и НКИ и у пациентов только с НКИ
Гипергликемия также считается независимым предиктором высокого количества лейкоцитов и уровня СРБ у пациентов с НКИ. Таким образом, гипергликемия коррелирует с высоким уровнем воспаления [28]. Массивное высвобождение цитокинов и глюкокортикостероидов во время подавляющей вирусной инфекции индуцирует стимуляцию глюконеогенеза и повышенную резистентность к инсулину, а также возможность острогоповреждения β-клеток поджелудочной железы с помощью ангиотензинпревращающего фермента 2, что может способствовать повышению уровня глюкозы в крови.Эти результаты послужили основанием для предположения, что гипергликемия ассоциирована с более тяжелым течением заболевания у пациентов с СД и НКИ.
Клинически значимым для оценки степени тяжести пациентов является уровень тромбоцитов. На сегодняшний день существует предположение, что количество тромбоцитов следует использовать в качестве маркера патофизиологических изменений в организме при НКИ. Частые измерения количества тромбоцитов могут быть полезны для лечения НКИ на фоне СД. Количество тромбоцитов пациентов с НКИ и СД снижалось на ранних стадиях, так как возбудитель SARS-CoV-2 вызывает повреждение легочной ткани, это приводит к активации, агрегации и захвату тромбоцитов.Возникший тромбоз увеличивает потребление тромбоцитов, что вызывает снижение их общего числа [27].
Также вирусная инфекция может вызывать иммунные повреждения тромбоцитов, индуцируя аутоантитела и иммунные комплексы.Использование иммуномодуляторов и коротких курсов кортикостероидов в дозах от низкой до умеренной потенциально может быть полезно для тяжелобольных пациентов с НКИ.
Д-димер может быть рассмотрен в качестве биомаркера тяжести течения заболевания у пациентов с СД и НКИ.
Результаты проанализированных нами исследований представлены на рисунке 4 [19, 20]. Из представленных данных видно, что значение Д-димера достоверно выше у пациентов с НКИ и СД, чем у пациентов с НКИ.
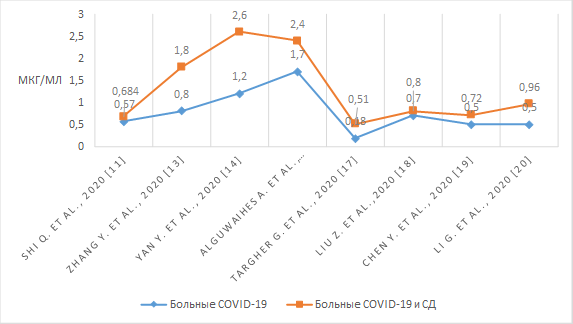
Рис. 4. Уровень Д-димера у пациентов с СД и НКИ и у пациентов только с НКИ
Было установлено, что высокий уровень Д-димера и количество лимфоцитов (<0,6×109/л) при поступлении были факторами риска госпитальной смерти [29]. Данные показатели могут быть вовлечены в изменение иммунной функции и функции легких у пациентов с СД и НКИ, что в дальнейшем приводит к неблагоприятным исходам.Этот механизм требует дальнейшего изучения.
У пациентов с НКИ гиперфибриногенемия приводит к гиперкоагуляции, таким образом, происходят полимеризация фибрина и его повышенное образование [30]. Д-димер может являться биомаркером тромбоэмболии и прогностическим маркером для пациентов, находящихся в тяжелом состоянии.НКИ считается прокоагулянтным состоянием, поэтому D-димер был изучен в качестве биомаркера для прогнозирования тяжести заболевания [20]. F. Zhou et al. (2020) показали, что концентрация D-димера выше 1 мкг/мл была связана с 18-кратным увеличением вероятности летального исхода[31]. Пациенты с СД имели тяжелую форму заболевания с более высоким уровнем Д-димера. Стойкая гипергликемия приводит к эндотелиальной дисфункции и воспалению, что, в свою очередь, способствует образованию тромбов. Тяжелая инфекция SARS-CoV-2 с СД может спровоцировать развитие коагулопатии и привести к неблагоприятному исходу [32]. Также не исключен тот факт, что гиперкоагуляционное состояние может быть дополнением к гипервоспалительному, следовательно, усугублять течение заболевания.
Заключение
СД – один из основных факторов рисков неблагоприятного исхода у пациентов с НКИ. Существует потенциальная связь между уровнем СРБ, ИЛ-6, лейкоцитов, тромбоцитов и Д-димера при СД и НКИ и степенью тяжести заболевания. Анализ данных лабораторных показателей может быть использован в прогностических целях и для определения методов терапии.
Высокие значения СРБ, ИЛ-6, лейкоцитов свидетельствуют о массивном воспалении и развитии полиорганной недостаточности. Следовательно, терапия должна быть направлена на купирование «цитокинового шторма».
Оценка уровня Д-димера и тромбоцитов важна для контроля свертывающей системы крови и прогнозирования тромботических осложнений, возникающих при тяжелом течении заболевания. В практической деятельности необходимо использование антикоагулянтной терапии.
Своевременный и тщательный мониторинг перечисленных маркеров играет ключевую роль при оценке состояния пациента и проведении эффективной терапии.



