Рак легкого в Российской Федерации занимает третье место по заболеваемости злокачественными новообразованиями среди всего населения (9,4%) и первое место среди мужчин (16,3%) [1], а также является самой частой причиной метастатического поражения головного мозга (40% случаев) [2, 3].
Лучевая терапия представляет собой наиболее эффективный нехирургический метод радикального лечения злокачественных опухолей. Приблизительно 50% всех больных раком на различных этапах лечения получают лучевую терапию – отдельно или в сочетании с хирургическим вмешательством и/или химиотерапией. Несмотря на то что в последние годы радиационная терапия была значительно технически усовершенствована, что позволило более точно доставлять дозу, у огромного числа пациентов все еще наблюдаются рецидивы заболевания [4].
Лучевая терапия является одним из основных методов терапии больных с метастатическим поражением головного мозга (МПГМ) [5]. Стереотаксическая радиохирургия (SRS) – это высокоточное локальное облучение, проводимое за одну фракцию с использованием комбинации жесткой иммобилизации и визуального контроля, что обеспечивает высокую точность облучения опухоли с низким риском повреждения окружающей ткани мозга.
Ионизирующее излучение (ИИ) повреждает клетки, высвобождая промежуточные ионы и свободные радикалы, которые вызывают одноцепочечные или двухцепочечные разрывы ДНК [6]. Индуцированные ионизирующим излучением повреждения ДНК запускают реакцию каскада белков, влияющих на репарацию ДНК и сигнализирующих об остановке клеточного цикла. Это позволяет клетке определить, способна ли она восстановить повреждение ДНК или, когда произошло слишком большое повреждение, погибнуть в результате апоптоза или отсроченной митотической гибели клетки [7].
Известно, что основной характеристикой опухоли, влияющей на исход после лучевой терапии, является врожденная радиорезистентность опухолевых клеток, на которую влияют внутренние генетические и эпигенетические факторы. В этом контексте нарушение регуляции ДНК и других клеточных сигнальных путей при раке играет основную роль в обеспечении устойчивости к ионизирующему излучению [8, 9]. Поэтому в последние годы активно ведется разработка ингибиторов ключевых компонентов этих путей с целью разработки стратегий лечения для преодоления резистентности к лучевой терапии.
МикроРНК представляют собой эндогенные малые некодирующие молекулы РНК, которые регулируют экспрессию различных генов [10–14]. Представление о том, что микроРНК играет одну из ведущих в развитии опухоли, вместе с представлением о способности одной микроРНК контролировать несколько генов-мишеней одновременно, привело к увеличению интереса к определению функциональной связи между экспрессией микроРНК и радиочувствительностью [15–17]. В этом аспекте в некоторых исследованиях было продемонстрировано, что микроРНК принимают участие в ответе на ионизирующее излучение, потому что многие из них непосредственно регулируют экспрессию генов, участвующих в клеточных путях, имеющих отношение к ответу на облучение [18]. Однако понимание причинной роли отдельных микроРНК в детерминации радиорезистентности опухоли все еще находится на начальной стадии.
В экспериментальных исследованиях было продемонстрировано влияние ионизирующего излучения на экспрессию микроРНК hsa-miR-16-5p, hsa-miR-21-5p и hsa-miR-663 при воздействии ионизирующего излучения высокой мощности [19]. С учетом имеющихся экспериментальных данных было решено оценить влияние терапии на паттерны экспрессии микроРНК у пациентов с метастатическим поражением головного мозга немелкоклеточным раком легкого.
Цель исследования: оценить влияние терапии на паттерны экспрессии микроРНК у пациентов с метастатическим поражением головного мозга немелкоклеточным раком легкого с определением возможных закономерностей.
Материалы и методы исследования
В исследование включены 90 пациентов с метастатическим поражением головного мозга немелкоклеточным раком легкого, которым была проведена лучевая терапия в отделении радиотерапии ФГБУ «НМИЦ онкологии» МЗ РФ в 2018–2021 гг. Пациенты были разделены на 3 группы по методике проводимой терапии: 1-я группа – облучение всего головного мозга (ОВГМ); 2-я группа – стереотаксическая радиохирургия; 3-я группа – стереотаксическая радиохирургия с однократной внутривенной инфузией бевацизумаба в дозе 5 мг/м2 за сутки до проведения сеанса стереотаксической лучевой терапии. Оценка эффективности лечения оценивалась по критериям RANO BM (Response Assessment in Neuro-Oncology Brain Metastases). В таблице 1 обобщены клинические характеристики непосредственно перед началом лечения для трех исследуемых групп.
Таблица 1
Клиническая характеристика пациентов
|
Группы пациентов
Параметры |
1-я группа (ОВГМ) |
2-я группа (SRS) |
3-я группа (SRS + бевацизумаб) |
|
|
Количество пациентов |
30 |
30 |
30 |
|
|
Кумулятивный объем образований, см3 |
Среднее |
8,03 |
3,14 |
4,06 |
|
Диапазон |
1,6–17,5 |
0,2–10,628 |
0,14–16,4 |
|
|
Количество очагов в головном мозге |
1 очаг |
0 |
16 |
10 |
|
2–4 очага |
4 |
10 |
9 |
|
|
5 и более |
26 |
4 |
11 |
|
|
Возраст пациентов |
Среднее |
60,1 |
58,6 |
60,9 |
|
Диапазон |
45–73 |
33–78 |
36–73 |
|
|
Старше 65 лет |
8 |
9 |
13 |
|
|
Пол |
Мужчины |
12 |
18 |
19 |
|
Женщины |
18 |
12 |
11 |
|
Пациентам всех групп производился забор венозной крови непосредственно перед сеансом лучевого лечения и через 1 месяц после завершения лечения. Из венозной крови путем центрифугирования выделялась плазма, в которой производилась оценка уровня экспрессии микро-РНК: hsa-miR-15a-5p, hsa- miR-16a-5p, hsa-miR-17-3p, hsa-miR-21-5p, hsa-miR-145-5p, hsa-miR-663.
Суммарную РНК из 0,2 мл плазмы экстрагировали с использованием реагента TRIzol® LS и набора для выделения miRNeasy Serum/Plasma Kit (Qiagen, Германия) с использованием автоматической станции выделения QIAcube Connect. Использовали syn-cel-miR-39 в качестве дополнительного контроля для некоторых технических вариаций экстракции РНК из плазмы. Рассчитывали медианное значение CT syn-cel-miR-39, полученное для всех образцов. Все образцы РНК хранили при –80°C. Для получения кДНК микроРНК подвергали полиаденелированию и обратной транскрипции с использованием E. coli polyA-полимеразы (NEB, США) и MMLV-ревертазы (Евроген, Россия), а также универсального праймера для обратной транскрипции, как описано в статье I. Balcells et al. [20]. ПЦР проводили с использованием набора HS Taq ДНК-полимераза (Евроген, Россия) в присутствии интеркалирующего красителя EvaGreen и специфичных праймеров для амплификации исследуемых микроРНК. Для непарных сравнений двух групп использовали критерий Вилкоксона. Различия экспрессии рассчитывали с помощью ANOVA. Значение p<0,05 указывает на статистическую значимость.
Результаты исследования и их обсуждение
Среди исследуемых микроРНК – hsa-miR-15a-5p, hsa- miR-16a-5p, hsa-miR-17-3p, hsa-miR-21-5p, hsa-miR-145-5p, hsa-miR-663 – относительная экспрессия во всех трех группах после проведенной лучевой терапии достоверно изменялась у четырех микроРНК: hsa-miR-15a-5p, hsa- miR-16a-5p, hsa-miR-21-5p, hsa-miR-663 (рис. 1–3). Достоверное изменение относительной экспрессии наблюдалось только в 1-й группе пациентов hsa-miR-15a-5p после проведенного облучения всего головного мозга (p=0,0079). МикроРНК miR-16a-5p демонстрирует изменения относительной экспрессии во всех трех исследуемых группах, однако только в 1-й группе пациентов, после проведенного облучения всего головного мозга, изменения оказались статистически достоверными (p=0,0076) и характеризовались увеличением экспрессии в среднем в 1,16 раза. Уровень Hsa-miR-21-5p снижается только у пациентов 2-й группы после проведенной стереотаксической радиохирургии в самостоятельном варианте (p=0,0096). Во всех 3 группах пациентов после терапии наблюдалось достоверное снижение содержания микроРНК hsa-miR-663 (p=0,0079; 0,0095; 0,0076 соответственно). Наглядно описанные изменения представлены на рисунках 1, 2 и 3 соответственно.
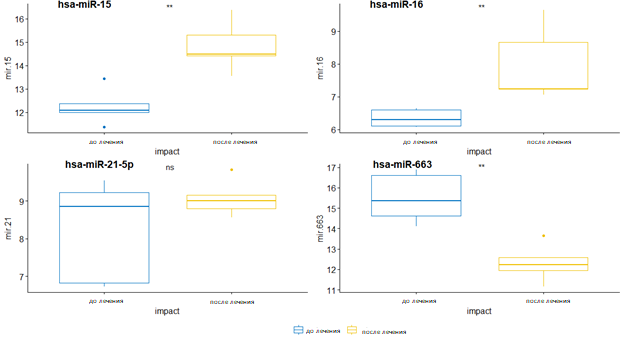
Рис. 1. Изменения уровней экспрессии микроРНК в плазме после лучевой терапии пациентов 1-й группы после ОВГМ. Уровни микроРНК в плазме крови определялись с помощью RT-PCR с использованием syn-cel-miR-39 в качестве контроля. Ось Y предоставляет уровень экспрессии (ΔCt). Критерий Вилкоксона: * значение p<0,05; ** значение p<0,01
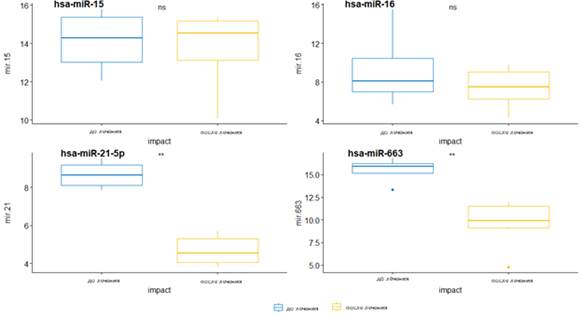
Рис. 2. Изменения уровней экспрессии микроРНК в плазме после лучевой терапии пациентов 2-й группы после SRS в самостоятельном варианте. Уровни микроРНК в плазме крови определялись с помощью RT-PCR с использованием syn-cel-miR-39 в качестве контроля.
Ось Y предоставляет уровень экспрессии (ΔCt).
Критерий Вилкоксона: * значение p<0,05; ** значение p<0,01
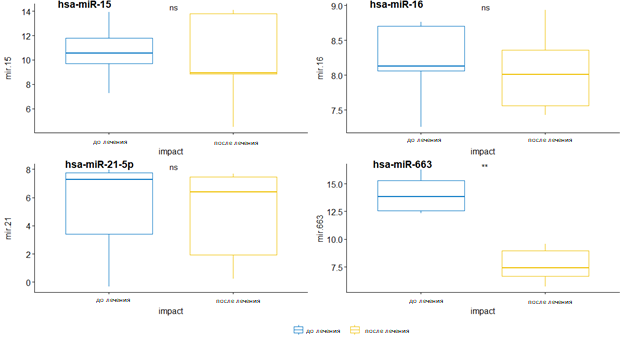
Рис. 3. Изменения уровней экспрессии микроРНК в плазме после лучевой терапии пациентов 3-й группы после SRS в комбинации с бевацизумабом. Уровни микроРНК в плазме крови определялись с помощью RT-PCR с использованием syn-cel-miR-39 в качестве контроля.
Ось Y предоставляет уровень экспрессии (ΔCt).
Критерий Вилкоксона: * значение p<0,05; ** значение p<0,01
Было проанализировано, связаны ли уровни экспрессии микроРНК в плазме крови с ответом на лучевую терапию. Для выявления микроРНК-кандидатов для прогностического классификатора были проведено сравнение уровней экспрессии исследуемых микроРНК в плазме крови пациентов до лечения внутри групп пациентов с положительным ответом (частичный ответ и стабилизация) на лечение и прогрессированием интракраниального процесса согласно критериям RANO, так как данные варианты ответа встречаются в исследовании в подавляющем большинстве.
В группе после проведенного ОВГМ при сравнении уровней экспрессии микроРНК у пациентов с положительным ответом (частичный ответ и стабилизация) на лечение и прогрессированием интракраниального процесса после проведенной лучевой терапии были выявлены отличия в уровнях экспрессии в плазме крови до лечения для микроРНК hsa-miR-15 (p=0,015) и hsa-miR-16 (p=0,013), также были отмечены статистически значимые изменения уровней микроРНК hsa-miR-21 и hsa-miR-663 (p=0,0103; 0,0097) после лечения. На основании этих данных можно предположить, что более низкие уровни микроРНК hsa-miR-15 (ΔCt ≤12,38) (p=0,015) и hsa-miR-16 (ΔCt ≤6,64) (p=0,016) могут быть связаны с положительным ответом на лечение в 1-й группе пациентов.
Для группы пациентов после стереотаксической радиохирургии в самостоятельном варианте производилось сравнение уровней экспрессии микроРНК у пациентов с положительным ответом (частичный ответ и стабилизация) на лечение и прогрессированием интракраниального процесса после проведенной стереотаксической радиохирургии. Была выявлена достоверная разница в уровне экспрессии для микроРНК hsa-miR-21 при исследовании до лечения (p=0,021) и для микроРНК hsa-miR-663 при исследовании как до лечения (p=0,027), так и после лечения (p=0,048). На основании этих данных можно предположить, что более высокий уровень микроРНК hsa-miR-21 (ΔCt ≥ 8,06) и низкий уровень hsa-miR-663 (ΔCt ≤16,06) перед лечением могут выступать прогностическими факторами частичного ответа на терапию.
При исследовании экспрессии у пациентов группы после стереотаксической радиохирургии с предварительным введением бевацизумаба производилось сравнение уровней экспрессии микроРНК у пациентов с положительным ответом (частичный ответ и стабилизация) на лечение и прогрессированием интракраниального процесса после проведенной комплексной терапии. Выявлено, что в случаях с положительным ответом до начала терапии отмечались достоверно более высокий уровень микроРНК hsa-miR-15 ΔCt ≥11,77 (p=0,0128), более высокий уровень hsa-miR-21 ΔCt ≥ 7,75 (p=0,013) и более низкий уровень микроРНК hsa-miR-663 ΔCt ≤13,82 (p=0,01). Данные микроРНК могут выступать потенциальными кандидатами для классификации пациентов 3-й группы лечения.
Заключение
Таким образом, в нашем исследовании выявлены характерные изменения экспрессии микроРНК hsa-miR-15a-5p, hsa- miR-16a-5p, hsa-miR-21-5p, hsa-miR-663, которые могут быть использованы в качестве биомаркеров прогноза ответа на различные варианты лучевой терапии метастатического поражения головного мозга немелкоклеточным раком легкого.



