Регенеративная способность печени была известна еще в Древней Греции. Проблема регенерации печени стала разрабатываться в научных исследованиях нашей страны в конце 1940-х – начале 1950-х гг. Изучению регенерации нормальной и патологически измененной печени уделялось внимание и в эксперименте, и в клинике. Эти исследования и их итоги обобщены в работах отечественных ученых [1-3]. Резекция печени как метод регенерационной терапии вошла в руководство для врачей [4] и широко используется в клинике [5]. Сегодня резекции печени применяются при коррекции у больных с опухолями, с метастазами, что позволяет достичь высокой выживаемости в отдаленном периоде [6-8].
При массивных резекциях печени наблюдаются летальные исходы, связанные с одномоментным удалением значительной части функционирующей печеночной паренхимы. Поэтому проводятся различные экспериментальные разработки по выявлению регенерационной возможности оставшейся части печени, особенно в ранние сроки после ее предельно допустимой резекции [9-11]. В то же время в экспериментах на животных было установлено, что печень быстро, примерно в течение 21 дня, восстанавливает свою массу (даже после резекции 3/4 части печени), однако не восстанавливает свою обычную форму [12].
Г.Г. Кармазановский и соавт. [13, 14], изучавшие регенерацию печени с помощью компьютерной томографии, обратили внимание на то, что изменения объема печени после ее резекции зависели не от характера очаговых поражений, а от объема резекции с учетом непораженной паренхимы и наличия в ней диффузных изменений. В раннем послеоперационном периоде (в течение 3 недель) наблюдали увеличение объема послеоперационного остатка печени независимо от заболевания печени и локализации патологического процесса. Затем в сроки от 1,5 до 6 месяцев, иногда и до 1 года, отмечалось уменьшение первоначально увеличивающего остатка печени. В последующих наблюдениях не отмечали изменений объема остатка печени. Авторы полагают, что увеличение резецированной печени с циррозом бывает через 1 год и меньше после резекции. Цирроз печени отрицательно влияет на процесс регенерации печени после ее резекции.
Цель исследования: описать особенности регенерационно-репарационной возможности оставшейся паренхимы печени в ответ на ее повреждение при использовании радиологического метода (сцинтиграфии).
Материалы и методы исследования
Проанализирован архивный материал, накопленный кафедрой в лабораториях радионуклидной диагностики областного онкологического диспансера и Иркутской городской клинической больницы № 1. Проанализированы радионуклидные исследования печени пациентов, получивших ее повреждения в результате травм, операций, лучевой терапии. При радионуклидных исследованиях применяли два радиофармпрепарата (РФП): бенгал-роз-I131 захватывается из крови полигональными клетками печени и экскретируется через протоки в кишечник (этим РФП исследуется поглотительно-экскреторная функция печени); коллоидный раствор золота-Аu198 после внутривенного введения захватывается ретикулоэндотелиальными клетками в течение 10–15 мин и остается в них, не распределяясь в течение нескольких дней (этим РФП можно определить поглотительную функцию РЭС и в дальнейшем получить гепатосканограмму).
Пациенты в момент проведения исследования давали добровольное информированное согласие на использование обезличенных данных радионуклидной диагностики для научного анализа.
Результаты исследования и их обсуждение. Проанализированы данные биохимических и радионуклидных исследований 80 пациентов с раком кардиального отдела желудка, подвергшихся предоперационному облучению на бетатроне 25 МэВ, и 19 пациентов, получавших дистанционную γ-терапию. У всех пациентов в зону облучения попадала часть левой доли печени с очаговой дозой от 10 до 60 Гр. Исследования проводились до, после и в отдаленные сроки после облучения. Большинство пациентов в последующем были прооперированы, что позволило судить о функции и морфологии печени. Данные гепатосканограмм сопоставлялись с гистологическими исследованиями тканей печени при биопсии на операции, аутопсии. Результаты были различны при структурно-функциональных исследованиях в зависимости от полученной дозы облучения части левой доли печени. При всех наблюдаемых величинах доз развивался радиационный гепатит. После облучения части печени в дозе от 20 до 30 Гр на гепатосканограммах отсутствовало ее изображение в проекции поля облучения (рис. 1а, 1б, 1в), поперечный размер сканографического изображения печени уменьшился (рис. 1б) за счет лучевого изменения под влиянием облучения.
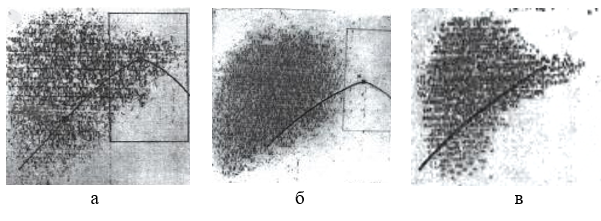
Рис. 1. Гепатосканограмма печени: а) до облучения, б) после облучения левой доли дозой 26 Гр., в) через год после лучевого воздействия
При операции отмечалось изменение внешнего вида облученного участка печени, имевшего более бледную окраску, чем необлученная часть печени. При пальпации левая доля была более плотной, чем остальные отделы печени. При гистологическом исследовании облученной части печени выявлялись выраженные дистрофические изменения паренхимы, являющиеся следствием очагового радиационного гепатита (термин Kurohara и Concannon): структуры тканей местами стерты, трабекулярное строение нарушено, сосуды полнокровные. Купферовские клетки – с выраженным ожирением и образованием крупных вакуолей. По ходу капсулы Глиссона – лимфоидные инфильтраты. В области центральных вен – бурый пигмент.
Изменения в печени при дозах менее 30 Гр носили обратимый характер и завершались репарацией. У пациента (рис. 1в) функция печени восстановилась через 1 год после облучения в дозе 26 Гр.
Изменения в печени при дозах выше 30 Гр завершались лучевым фиброзом, что показано на рисунке 2 – гепатосканограмме пациента с раком кардиального отдела желудка после облучения печени дозой в 50 Гр, которая входила в зону облучения: изображение левой доли отсутствует, изображение правой доли резко увеличено в размерах и имеет равномерную контрастность, что является следствием компенсаторного увеличения непораженной части печени.
Внешний вид печени после облучения (определялся в процессе операции или аутопсии) имел характерные изменения. Облученная часть левой доли была уплощена, истончена. Капсула сморщена, имела бледную окраску. При гистологическом исследовании: резкая атрофия клеток и долек, сморщивание капсулы за счет уменьшения паренхимы. Значительные кровоизлияния, поля некроза и некробиоза печеночных клеток. Отмечались разрастание соединительной ткани по ходу сосудов, разрастание элементов глиссоновой капсулы лимфоидной инфильтрацией, строма с явлениями белкового пропитывания, мелкокапельное ожирение паренхимы.
В необлученной части правой доли печени отмечались умеренное разрыхление и отек капсулы, стромы, трабекулы и наличие кровоизлияний, расширение перикапиллярных пространств.
По данным радионуклидных исследований размеры и интенсивность изображения необлученной части печени увеличились по сравнению с исходными данными, что может свидетельствовать о компенсаторном повышении функций за счет их потерь облученной части (рис. 2).

Рис. 2. Гепатосканограмма пациента с раком кардиального отдела желудка после облучения левой доли печени дозой 50 Гр
Можно сделать вывод о том, что облучение 1/8–1/10 части печени, приводящее к ее фиброзу, не должно рассматриваться как противопоказание при планировании облучения и операции.
У нас [12] имеются сведения о 9 пациентах, которым во время радикальной операции по поводу злокачественной опухоли в резецируемый препарат приходилось включать часть левой доли печени, преимущественно в области треугольной связки, вследствие ее прорастания опухолью. Выполнялась гастрэктомия с краевой резекцией левой доли печени. У всех 9 пациентов в отдаленные сроки (до 1 года) при гепатосканировании с коллоидным раствором золота-Аu198 имелись признаки восстановления изображения левой доли печени. Результаты, полученные при функциональных исследованиях печени, проведенных биохимическими и радионуклидными методами, статистически не отличались от исходных данных до операции, т.е. отмечались репаративно-регенеративные процессы печени после операции.
Проанализированы гепатосканограммы у 34 пациентов с первичными и метастатическими поражениями печени. На гепатосканограммах с первичными злокачественными опухолями без механической желтухи объем непораженной паренхимы оставался значительным с длительной функциональной компенсацией, что свидетельствовало о компенсаторной гипертрофии органа. На гепатосканограммах с метастатическим поражением до 30% всего объема (при метастазах рака молочной железы, колоректального рака и рака желудка) также не наблюдалось уменьшения объема непораженной паренхимы печени у этих больных. У всех наблюдаемых больных по гепатосканограммам отмечалась компенсаторная гипертрофия непораженной части печени с достаточной функциональной активностью, несмотря на поражение злокачественным процессом.
По данным морфологических исследований, проведенных у 12 из 34 обследованных, очаговые поражения сопровождались патологическими изменениями паренхимы, расценивались как следствие нарушения микроциркуляции и желчеоттока компрессионной печени. Отмечалось увеличение числа двуядерных клеток в окружающей паренхиме очага поражения, что расценивалось как свидетельство активности процесса регенерации.
Заслуживают внимания и изменения объема печени после ее частичной резекции по поводу кист печени. Характерными гепатосканографическими признаками кист печени являются наличие дефектов изображения, увеличение размеров и изменение формы печени. Дефекты изображения на гепатосканограмме представляются результатом крупных очагов деструкции и не зависят от их природы, определяются его размерами и глубиной расположения. Кисты печени чаще всего окружены слоем нормально функционирующей ткани, в которой поглощается РФП, поэтому может определяться не дефект изображения, а только уменьшение величины накопления РФП по сравнению с окружающей тканью. Степень контрастности изображения в области локализации кисты будет зависеть от ее размеров и толщины покрывающих ее нормальных тканей печени. При кистах печени изменяются нормальные соотношения между стандартными размерами печени (размеры по Курлову). У всех наблюдаемых пациентов при эхинококкозе отмечалась компенсаторная гипертрофия непораженной части печени, которая оставалась достаточной для поддержания ее функций на нормальном уровне (рис. 3).

Рис. 3. Пациент Т., 44 г., Инвазия печени, вызванная Echinococcus granulosus
На рисунке 3 гепатосканограмма опущена, деформирована. Нижний край печени выходит из-под подреберья на 5 см, из-под мечевидного отростка – на 13 см. В центре печени определяется дефект изображения округлой формы диаметром до 13 см. Функционирующая ткань левой доли оттеснена влево и вниз, увеличена в размере. Функционирующая ткань правой доли оттеснена вниз. В обеих долях – равномерное распределение РФП с его максимумом в центре обеих долей.
Опущение печени имеет место при больших кистах, локализующихся в области диафрагмальной поверхности печени (рис. 4а, 4б).

Рис. 4. Пациент О., 61 г., прооперированный по поводу двух эхинококковых кист в правой доли печени: а) до операции; б) через 21 день после операции
На исходной гепатосканограмме до операции изображение печени деформировано, опущено, смещено влево, размерами 15х15,5х7х21 см, выступает из-под мечевидного отростка на 13 см (рис. 4а). По наружному краю правой доли печени имеются два дефекта изображения округлой формы: верхний дефект на диафрагмальной поверхности диаметром до 6 см, нижний дефект изображения до 14 см в диаметре. Вокруг дефектов интенсивность накопления РФП значительно снижена. Максимум накопления смещен влево, тогда как в правой доле накопление РФП значительно меньше. Изображения селезенки нет.
На операции при ревизии обнаружена большая эхинококковая киста, полностью замещающая правую долю печени, размерами 24х18х18 см. На диафрагмальной поверхности правой доли вторая киста размерами 8х6х6 см погибающего паразита с кальцификацией. В кисте около 2,5 л жидкости с эхинококковыми пузырями в разной стадии своего развития. В области нижней полой вены – капсула кисты и кальцинированная стенка погибшего паразита, интимно связанного со стенкой вены.
На гепатосканограмме через 21 день после операции изображение печени опущено, имеет овальную форму без выраженного нижне-наружного контура, расположено почти срединно, размерами 13х12х6х23 см (рис. 4б). Из-под мечевидного отростка выступает на 8 см. Распределение РФП равномерное с максимумом накопления в центре изображения и снижением контрастности по периферии.
Нами прослежена динамика изменения объема печени после резекции (рис. 4а, 4б, 5, 6). При анализе результатов в послеоперационном периоде у больных, перенесших обширную резекцию печени, в первый месяц после резекции отмечались увеличение объема оставшейся части печени и снижение плотности ее паренхимы (по гепатосканографическим данным). В послеоперационном периоде увеличение остатка печени сопровождалось снижением плотности паренхимы, обусловленным воспалительным процессом с возросшим кровенаполнением и отеком органа. Затем наступает постепенное увеличение плотности печени за счет нормализации печеночного кровотока, процесс завершается к 10-му месяцу после операции. Это может быть связано с послеоперационным воспалением и возросшим кровенаполнением и отеком [15]. Затем к концу месяца отмечается увеличение плотности печеночной паренхимы, и к концу года завершается регенерация оставшейся ткани печени. При наблюдении до 3 лет изменений в объеме остатка печени не отмечено (рис. 5). На гепатосканограмме пациентки М., 42 г., выполненной через 26 дней после резекции травматической кисты размерами 12х15 см, расположенной по нижнему краю правой доли печени, печень имеет высокое расположение. Размеры печени 13х6х3,5х19 см. Распределение РФП довольно равномерное, интенсивное. По нижнему контуру изображенной печени (в проекции резекции) отмечается снижение интенсивности распределения РФП в виде вогнутой дуги. В селезенке отмечаются лишь единичные следы РФП.

Рис. 5. Гепатосканограмма пациентки М., 42 г., выполненная через 26 дней после резекции травматической кисты
Наблюдали несколько гепатосканограмм пациентов в отдаленные сроки после резекции (рис. 6) или травмы печени (рис. 7).

Рис. 6. Пациент С., 32 г. Гепатосканограмма произведена через 3 года после операции по поводу эхинококкоза правой доли печени. После операции оставалась только левая доля
Сканографическое изображение (рис. 6) печени деформировано, имеет овальную форму, смещено влево, низко расположено. Размеры печени 12,5х11х6х18 см. Распределение РФП неравномерное по всей поверхности печени. В проекции ложа желчного пузыря контрастность изображения снижена. В центральной части правой и левой доли имеется более интенсивное накопление РФП. Селезенка сканографически не определяется. Можно заключить, что произошла репарация травмированной правой доли печени.

Рис. 7. Гепатосканограмма пациентки К.,18 лет. Выполнена через 3 года после удаления левой доли печени после травмы, полученной при автомобильной катастрофе
Изображение печени (рис. 7) имеет низкое расположение, деформировано за счет увеличенной левой доли, которая выдвигается из-под реберной дуги на 9 см. Размеры печени 13,5х11х7х17 см. Распределение цвето-цифровой контрастности равномерное. В проекции левой доли печени интенсивность накопления РФП снижена. В правой доле по ее центру интенсивность накопления РФП повышена. Следовательно, произошли репарация травмированной левой доли и компенсированная функциональная регенерация правой доли печени.
Нами отмечено, что в отдаленные сроки после травмы печень приобретает размер, приближенный к нормальному, но остается деформированной.
Мы проследили за тем, что функциональный дефицит, обусловленный уменьшением ткани печени, вызывает пролиферативные процессы, которые приводят к восстановлению функций печени, а также отмечена способность печени регулировать свой размер при травмах, однако ее форма не сохраняется. Наши данные согласуются с данными литературных источников по изучению регенераторной способности печени.
Заключение. Полученные данные свидетельствуют о регенерационных возможностях печени после ее резекции по типу гипертрофии паренхимы. При травме печени, вызванной лучевым фиброзом, резекцией части печени при доброкачественных и злокачественных новообразованиях, происходят регенерационные процессы, проявляющиеся в форме компенсаторной гипертрофии непораженной паренхимы печени, и репарационные процессы в области оперативного вмешательства. Эти процессы обеспечивают функциональную компенсацию печени в целом.



