Меланома – злокачественная опухоль из меланоцитов, темпы роста заболеваемости которой среди лиц со светлым типом кожи неуклонно увеличиваются, продолжая сохраняться одними из самых высоких среди всех остальных видов злокачественных новообразований [1]. Причины повышения заболеваемости меланомой недостаточно понятны, однако известно, что ультрафиолетовое излучение является одним из ключевых факторов риска развития данной опухоли. Наряду с этим выделяют генетические факторы, в том числе связанные с развитием наследственных форм заболевания [2; 3]. Безусловно, внедрение современных методов таргетной и иммунотерапии вызвало увеличение показателей общей выживаемости у больных меланомой [4]. Вместе с тем диссеминация новообразования является критичным фактором для исхода заболевания и эффективности терапии, поэтому исследование механизмов развития метастазирования меланомы требует дальнейшего разъяснения.
Метастазирование является системным процессом, в ходе которого наблюдаются множественные генетические и эпигенетические изменения, коммуникация клеток опухоли и микроокружения, а также дистантная коммуникация посредством экстраклеточных везикул, высвобождаемых опухолевыми клетками [5; 6]. Экстраклеточные везикулы содержат различные белковые молекулы, а также некодирующие РНК, которые, в свою очередь, могут вызывать и регулировать процессы ремоделирования не только микроокружения первичной опухоли, но также и дистантных органов-мишеней метастазирования [7].
МикроРНК относят к классу коротких некодирующих РНК, которые регулируют экспрессию генов на посттранскрипционном уровне, данные молекулы обладают высокой стабильностью и тканеспецифичностью [8]. При меланоме кожи одной из наиболее низкоэкспрессируемых микроРНК является miR-204-5p [9]. Выявлено, что модуляция уровней данной микроРНК in vitro посредством трансфекции специфических ингибиторов/имитаторов связана со снижением пролиферации опухолевых клеток меланомы кожи, а ингибирование miR-204-5p вызывает повышение их миграции [10]. Помимо этого, было показано, что микроРНК miR-204-5p участвует в приобретении резистентности клеток меланомы к V600E-ингибитору вемурафенибу [11].
Наличие связи между характером миграции, пролиферации клеток меланомы и miR-204-5p послужило предпосылкой для выполнения данного исследования с целью определения влияния ингибитора данной микроРНК на развитие и метастазирование опухоли.
Цель исследования: определить влияние ингибитора микроРНК miR-204-5p на пролиферацию, миграцию клеток меланомы, профиль транскриптома в легочной ткани (орган-мишень метастазирования меланомы) на модели меланомы В16 in vivo.
Материал и методы исследования
Культура клеток
Клеточная линия меланомы В16 была получена в Научно-исследовательском институте фундаментальной и клинической иммунологии (Новосибирск, Россия). Клетки культивировали в среде RPMI-1640 с L-глютамином (Gibco, Life Technologies, Великобритания) с добавлением 10% фетальной бычьей сыворотки (Gibco, Life Technologies, Великобритания) и раствора антибиотика/антимикотика (Gibco, Life Technologies, Великобритания). Культивирование осуществляли в CO2-инкубаторе (Sanyo, Япония) при 37°C и концентрации CO2 5%. Питательную среду заменяли каждые 2-3 дня, клетки пересаживали при отсутствии признаков контаминации культуры и при достижении плотности покрытия дна культуральной емкости около 80%. Эксперименты проводили после проведения 2-3 пассажей.
Мыши
Четырнадцать самок мышей линии C57Bl6 в возрасте 8 недель массой 16,83-21,13 г были получены из вивария Института цитологии и генетики Сибирского отделения Российской академии наук (Новосибирск, Россия). Животных содержали в условиях естественного освещения без каких-либо ограничений в воде и корме. Исследование было одобрено локальным этическим комитетом Красноярского государственного медицинского университета (протокол № 70/2016 от 6 июня 2016 г.). Все процедуры с мышами были выполнены в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации и этическими рекомендациями по исследованиям на животных.
Ингибирование miR-204-5p in vivo
Для формирования экспериментальной модели перевиваемой меланомы кожи суспензию клеток меланомы В16 в растворе Хэнкса (HBSS) (Gibco, Life Technologies, Великобритания) в концентрации 1×106 кл/мл в объеме 0,5 мл вводили мышам подкожно в боковую поверхность живота в соответствии с описанным в литературе методом сингенной трансплантации [12]. Через 7 дней, когда меланома сформировала пальпируемую округлую солидную опухоль в виде узла, приступали к трансфекции в клетки опухоли специфического ингибитора микроРНК miR-204-5p, а также контролей, путем внутрикожного введения растворов животным. С этой целью подопытных мышей рандомно разделили на три группы: контрольная группа Control (n=3), животным которой вводили по 100 мкл стерильного фосфатного буфера в концентрации 0,01 моль/л, группа отрицательного контроля Negative control (n=6), животным которой вводили по 100 мкл раствора, содержащего отрицательный контроль ингибитора LNA miRCURY LNA ™ miRNA (Exiqon, Дания) в концентрации 25 мг/кг веса животного в фосфатном буфере, а также экспериментальная группа LNA anti-204-5p (n=5), животные которой получали инъекции по 100 мкл раствора, содержащего непосредственно специфический ингибитор молекулы miR-204-5p – mmu-miR-204-5p miRCURY LNA ™ (Exiqon, Дания) в фосфатном буфере в концентрации 25 мг/кг. Растворы вводили дважды – на 7-й и на 14-й день после трансплантации опухолевых клеток. Эксперимент был завершен на 15-й день после формирования модели меланомы кожи путем эвтаназии животных методом декапитации, осуществляемой под хлороформным наркозом. При вскрытии производили выделение опухолевого узла и легких. Одну часть выделенных тканей фиксировали в забуференном нейтральном растворе формалина с последующим заключением в парафин для изготовления гистологических срезов, другую часть подвергали криоконсервации при температуре -80°С для дальнейшего исследования.
Иммуногистохимическое исследование
Из парафиновых блоков, содержащих ткань опухолевых узлов меланомы, изготавливали гистологические срезы толщиной 3-4 мкм, которые помещали на предметные стекла и высушивали при комнатной температуре. Далее ткань депарафинизировали ксилолом с последующей двукратной промывкой этанолом. Активность эндогенной пероксидазы блокировали 3%-ной перекисью водорода в течение 10 минут при комнатной температуре. Срезы инкубировали в течение ночи при 4°C с первичными антителами против Ki-67 (Monoclonal antibodies SP6, SpringBio, США) в разведении 1:100, затем промывали фосфатным буфером и инкубировали со вторичными антителами, конъюгированными с пероксидазой хрена, в течение 30 минут при 37°C. Окрашивание тканей проводили хромогеном AEC (3-амино-9-этилкарбазол) из набора детекции REVEAL Biotin-Free Polyvalent AEC (Spring, США) и гематоксилином с последующей дегидратацией и установкой на них покровного стекла. В качестве негативного контроля использовали окрашивание срезов с нанесением фосфатно-солевого раствора вместо первичных антител. Подсчет окрашенных клеток проводили на микроскопе Olympus BX-41 (Olympus Corporation, Япония) с использованием видеонасадки Infinity 2 Lumenera camera (Lumenera Corporation, Канада) и соответствующего программного обеспечения. Подсчёт среднего количества позитивно окрашенных клеток не менее чем в 10 случайных полях зрения производили при увеличении ×400 и ×600 с дальнейшим определением их доли в процентном соотношении.
Ингибирование miR-204-5p in vitro
Для оценки влияния микроРНК miR-204-5p на миграцию клеток меланомы B16 in vitro предварительно осуществляли трансфекцию специфического ингибитора микроРНК miR-204-5p Anti-miR™ miRNA Inhibitor, его негативного контроля – Anti-miR™ miRNA Inhibitor Negative Control #1 и позитивного контроля – Anti-miR™ hsa-let-7c miRNA Inhibitor Positive Control (Thermo Fisher Scientific, США) в 24-луночных планшетах при достижении плотности покрытия клеточным монослоем около 80% дна лунки по протоколу производителя, используя в качестве трансфектанта Lipofectamine 3000 Reagent (Invitrogen, Life Technologies, США). Трансфекцию осуществляли в течение 24 ч в бессывороточной питательной среде в условиях CO2-инкубатора. Эффективность трансфекции подтверждали стандартным методом по экспрессионному уровню мРНК белка HMGA2 (хроматинсвязанный негистоновый белок) (Applied Biosystems, США), поскольку данный белок является мишенью для положительного контроля – miR-let-7c.
Анализ миграционной активности (Scratch-test, анализ на зарастание «царапины»)
Через 24 ч после осуществления трансфекции ингибитора микроРНК miR-204-5p в лунках 24-луночного планшета производили смену питательной среды, содержащей агенты трансфекции, на свежую, содержащую 1% FBS. Затем пластиковым наконечником наносили однократные продольные повреждения монослоя – «царапины» по проекции диаметра дна лунок с последующей визуализацией их на инвертированном микроскопе («ЛОМО», Россия) с использованием камеры INFINITY 1.0 (Lumenera Corporation, Канада) и регистрацией и расчетом площади «царапины» сразу после нанесения, через 12 ч и через 24 часа после нанесения «царапины» в одних и тех же участках с помощью программного обеспечения INFINITY ANALYZE Release 6.5 (Lumenera Corporation, Канада). Скорость миграции клеток оценивали по изменению относительной площади нанесенных дефектов клеточного монослоя.
Микрочипирование
Анализ полного транскриптома выполняли с использованием системы микрочипов Gene Atlas (Affymetrix, США). Выделение тотальной РНК из ткани легких мышей выполняли с использованием набора PureLink RNA Purification Kit (Thermo Fisher Scientific, США) в соответствии с инструкциями производителя. Концентрацию полученной РНК и степень чистоты образцов определяли на флуориметре Qubit® 2.0 (Invitrogen, Thermo Fisher Scientific, Сингапур). Для анализа каждого образца использовали 5 нг тотальной РНК. Синтез одноцепочечной ДНК проводили в два этапа, после чего исследуемые образцы очищали от ферментов, солей и избыточных нуклеотидов с помощью Purification Beards (Module3, WT Pico Amplification kit, Affymetrix, США). Гибридизацию на генном чипе Gene Chip HuGene 2.1 ST Array Strip (Thermo Fissher Scientific, США) выполняли с использованием набора реагентов Gene Chip Gene Atlas Hybridization, Wash and Stain Module для набора реагентов WT Array Strips при 48°C в течение 20 часов, затем чипы промывали и осуществляли детекцию флуоресцентных сигналов на станциях Gene Atlas Fluidic Station и Gene Atlas Imaging Station (Affymetrix, США). Обработку результатов с преобразованием значений флуоресцентных сигналов в экспрессионные уровни проводили с помощью программы Transcriptome Analysis Console 4.0.1 (Thermo Fisher Scientific, США). Гены, имеющие различия экспрессии в 2 и более раза по сравнению с контролем, были отобраны с использованием поправки на коэффициент ложного обнаружения FDR на основе значений уровня значимости p<0,05 и сгруппированы в соответствии с категориями функций, выполняемых в клетках, представленных в биоинформатическом модуле программы Transcriptome Analysis Console 4.0.1 (Thermo Fissher Scientific, США).
Статистический анализ
Для обработки данных использовали пакет статистического анализа Statistica 7.0 (StatSoft, Россия). Статистический анализ данных полнотранскриптомного исследования был выполнен с использованием теста ANOVA. Различия в уровнях транскрипта между экспериментальной и контрольной группами считались значимыми при p<0,05 с поправкой на FDR.
Результаты, полученные при остальных исследованиях при попарном сравнении групп, обрабатывали с использованием U-критерия Манна-Уитни, результаты считали значимыми при p<0,05.
Результаты исследования и их обсуждение
При проведении иммуногистохимического исследования определено, что при воздействии ингибитора микроРНК miR-204-5p происходит увеличение доли KI-67-позитивных клеток меланомы в опухоли, что свидетельствует о возрастании интенсивности пролиферации (рис. 1).
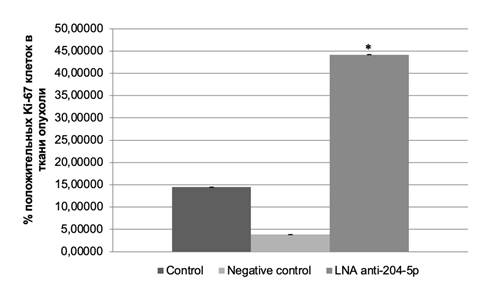
Рис. 1. Уровни Ki-67-положительных клеток в меланоме B16 после воздействия ингибитором микроРНК miR-204-5p (* – P<0,05)
Анализ миграционной активности опухолевых клеток меланомы выявил отсутствие изменений данного параметра при ингибировании микроРНК miR-204-5p in vitro (рис. 2).
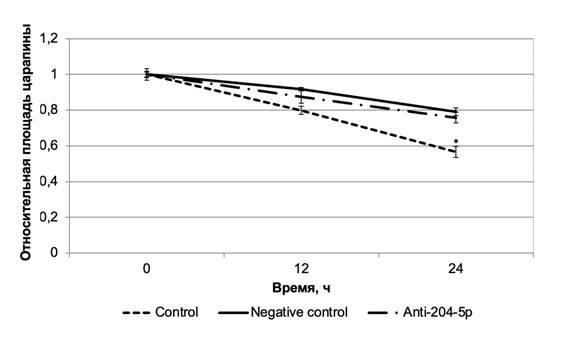
Рис. 2. Уровни миграции клеток меланомы после воздействия ингибитором микроРНК miR-204-5p (* – P<0,05)
Таким образом, ингибирование микроРНК miR-204-5p может быть сопряжено с более быстрой прогрессией заболевания. В этой связи на следующем этапе работы было осуществлено профилирование экспрессии генов в ткани легких как органе, подвергающемся возможному ремоделированию в рамках диссеминации новообразования.
По результатам микрочипирования определено, что после воздействия ингибитором miR-204-5p, по сравнению с отрицательным контролем (Negative control), регистрировались изменения уровней экспрессии 3262 генов, из них уровень мРНК был снижен по сравнению с контролем 1891 генов (рис. 3).
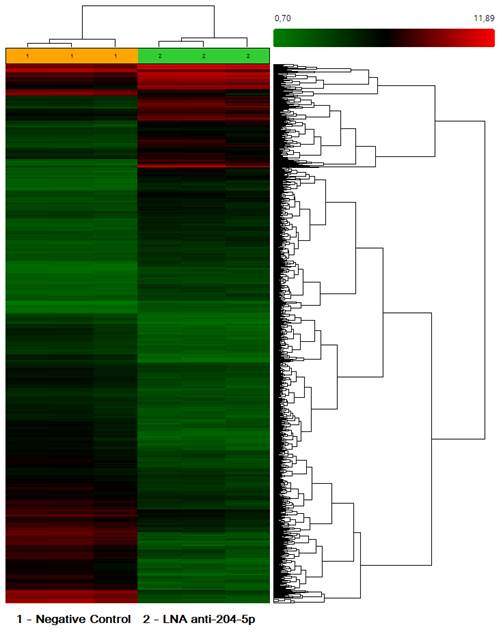
Рис. 3. Иерархическая кластеризация мРНК в легочной ткани мышей с перевиваемой меланомой В16 после воздействия ингибитором микроРНК miR-204-5p
Одними из низкоэкспрессируемых генов были CDH1, TGFb1, ITGA, Scgb1a1, Sftpc, Sftpb, Cyp2f2, Chil3, Cbr2, Sftpa1, Slc34a2, Inmt, Cxcl15. Повышение экспрессии после воздействия ингибитором miR-204-5p определялось у 1371 гена. К наиболее высокоэкспресируемым можно отнести гены FGFs (Fgf12, Fgf13, Fgf14), Snap25, Slc6a11, Cdr1, Nefl, Plp1, Gria2, Tmem130, AF357355, Sst, AF357355. Биоинформатический анализ показал, что гены с измененной экспрессией являлись компонентами сигнальных путей «MAPK signaling pathway», «Focal Adhesion-PI3K-Akt-mTOR-signaling pathway», «EGFR1 Signaling Pathway», «TGF-beta Receptor Signaling Pathway», «Focal Adhesion», «B Cell Receptor Signaling Pathway», «T Cell «Receptor Signaling Pathway», «XPodNet - protein-protein interactions in the podocyte expanded by STRING».
Необходимо отметить, что микроРНК miR-204-5p рассматривается как онкосупрессорная в контексте развития меланомы. В этой связи повышение интенсивности пролиферации клеток меланомы при ее ингибировании представляется закономерным. Можно предположить несколько механизмов, благодаря которым данная микроРНК может регулировать пролиферацию. В частности, ранее нами было показано, что мишенью микроРНК miR-204-5p является транскрипционный фактор FOXC1, который осуществляет регуляцию пролиферации клеток меланомы посредством активации сигнального каскада PI3K-Akt-mTOR, изменения экспрессии генов-компонентов которого регистрировались и в данном исследовании [13].
Безусловно, с нашей точки зрения важно выявление изменений в ткани легких у животных при введении ингибитора miR-204-5p на фоне развития меланомы В16. Характер дифференциально изменяемых генов и соответствующих им сигнальных путей указывает, что часть из них относится к регуляции процессов в нейрональных клетках. С другой стороны, среди генов с повышенной экспрессией отмечаются гены, кодирующие члены семейства факторов роста фибробластов – Fgf12, Fgf13, Fgf14. Факторы роста фибробластов регулируют процессы дифференцировки и миграции клеток, а их аберрантная экспрессия наблюдается при широком спектре злокачественных новообразований. В частности, установлено, что повышение уровня Fgf13 (фактор роста фибробластов 13) связано с неблагоприятным течением рака поджелудочной железы, рака шейки матки [14].
Manfredi J.J. высказано предположение, что, помимо «драйверов» опухолевого роста, есть «активаторы», которые стимулируют пролиферацию опухолевых клеток, особенно в условиях воздействия каких-либо стрессовых факторов. К таким «активаторам» отнесен фактор роста фибробластов Fgf13, экспрессия которого транскрипционно репрессируется онкосупрессором р53 [15].
Помимо этого, другой ген, экспрессия которого была повышена после ингибирования miR-204-5p – Sst (соматостатин). Показано участие соматостатина в регуляции эпителиально-мезенхимального перехода при раке желудка, миграции опухолевых клеток [16].
Помимо этого, механизмы внутриклеточной сигнализации, компонентами которых являются дифференциально экспрессируемые гены, также могут участвовать в изменениях легких, в том числе быть связаны с активацией компонентов иммунной системы [17].
Выводы
Таким образом, при снижении уровня экспрессии микроРНК miR-204-5p наблюдаются повышение пролиферации клеток меланомы, а также изменение в легких, характерные для активации иммунной системы и фибробластов.



