Изучение патогенеза повреждения ткани головного мозга в результате возникшей в перинатальном периоде гипоксии/ишемии и возможные методы ранней диагностики данного состояния – предмет научного поиска на современном этапе. Эксайтотоксичность – основной механизм повреждения пре- и олигодендроцитов в развивающемся мозге, который опосредуется через популяцию глутаматергических ионотропных рецепторов: N-метил-d-аспартата (NMDA), α-амино-3-гидрокси-5-метил-4-изоксазолпропионата (AMPA) [1].
Активность NMDA рецепторов головного мозга высока в антенатальном и постнатальном периодах, в то время как активность AMPA рецепторов в развивающихся олигодендроцитах высока у плода в период с 23-й по 32-ю недели внутриутробного развития и уменьшается к моменту рождения [2]. Таким образом, мозг новорожденного ребенка более восприимчив к NMDA-, а мозг плода – к AMPA-опосредованному повреждению. NMDA рецепторы широко распространены в ЦНС и являются важными медиаторами синаптической передачи, пластичности и играют основную роль в нейрогенезе [3]. Данные рецепторы существуют в виде подтипов, различающихся по своему молекулярному составу: GluNR1, GluNR2 и GluNR3. Cубъединица GluNR2 определяет сродство и чувствительность NMDA рецептора к агонистам и антагонистам, таким как глутамат, глицин и магний [4].
После воздействия гипоксии/ишемии запускается каскад событий, характеризующийся увеличением внеклеточного глутамата. Происходит активация NMDA рецепторов, как следствие – повышение уровня внутриклеточного кальция и увеличение митохондриальной проницаемости. Митохондрии набухают и погибают, выделяя в цитоплазму ряд факторов нейронального апоптоза: цитохром С, прокаспазу, эндонуклеазу, апоптоз-индуцирующий фактор [5]. Также в результате митохондриальной дисфункции повышается производство активных форм кислорода, что усугубляет нейрональный апоптоз [6]. В перинатальном периоде апоптотическая NMDA опосредованная гибель нейронов максимальна в стволе мозга, сразу после рождения – в таламусе и других подкорковых областях, а в первые 2 недели постнатальной жизни – в области коры головного мозга [7].
Таким образом, чрезмерная стимуляция рецепторов из-за массового высвобождения возбуждающих нейротрансмиттеров приводит к посттравматическому окислительному стрессу и гибели клеток в течение длительного периода, что ухудшает неврологический исход у новорожденного в будущем.
В настоящее время на основе проведенных исследований было предложено использовать пептид и антитела к фрагментам глутаматных рецепторов NR2 в качестве маркеров инсульта и транзиторной ишемической атаки во взрослой когорте больных. Определение данных маркеров базируется на механизме повреждения ЦНС. На начальных этапах развития гипоксии/ишемии в мелких мозговых сосудах активируются сериновые протеазы, которые «режут» мембранные «петли» NMDА-рецепторов, расположенные на поверхности синаптической мембраны. Образовавшиеся пептидные фрагменты рецептора (NR2-пептид) попадают в кровоток через поврежденный гематоэнцефалический барьер и вызывают реакцию иммунной системы с образованием специфических NR2-антител. В педиатрии проведены исследования по выявлению зависимости поражения головного мозга гипоксического характера у доношенных новорожденных от уровня NR2-антител к NMDА-рецепторам. Учитывая высокую прогностическую значимость данного метода диагностики тяжести гипоксического повреждения ЦНС у доношенных новорожденных, можно говорить о перспективности данных биомаркеров в прогнозе поражения ЦНС у недоношенных новорожденных [8].
Цель исследования – установить диагностическую значимость биомаркеров эксайтотоксического повреждения головного мозга (пептид NR2 субъединицы NMDA рецептора и антитела к NR2 субъединице NMDA рецептора и GluR1 субъединице AMPA-рецептора глутамата) как ранних предикторов поражения ЦНС у недоношенных детей с целью ранней диагностики, лечения и прогнозирования исходов поражения ЦНС.
Материал и методы исследования. Работа одобрена локальным этическим комитетом (протокол № 118 от 12.03.2020 г.) и выполнена в дизайне проспективного когортного сравнительного исследования. Обследованы 48 новорожденных детей, родившихся и получивших лечение в условиях БУЗОО Городской клинический перинатальный центр (г. Омск). Процедура забора образцов сыворотки крови для проведения теста ИФА проводилась согласно протоколу, разработанному ООО «ДРД» (Москва, Сколково). Забор венозной крови в количестве 1 мл проводился одновременно с взятием крови для биохимических анализов, без дополнительных инвазивных вмешательств, с последующим центрифугированием, замораживанием сыворотки и лабораторной обработкой всего массива. Концентрация антител к GluNR2 в крови у здоровых доношенных новорожденных детей в норме составляет <2,0 нг/мл, нормативные значения NR2 пептида NMDA рецептора не определены.
Исследуемые новорожденные были распределены по группам: основная группа – новорожденные с ГВ 28–34 недель, массой тела 1000–2000 г (n=24), контрольная группа – новорожденные с ГВ 38–40 недель (n=24). 1-я контрольная точка исследования: определение уровня пептида NR2 субъединицы NMDA рецептора в пуповинной крови новорожденных исследуемых групп.
В дальнейшем основная группа новорожденных была разделена на подгруппы: 1-я подгруппа – недоношенные новорожденные с задержкой внутриутробного развития плода (ЗВУР), 2-я подгруппа – недоношенные новорожденные без ЗВУР.
На этапе 2-й контрольной точки (21-е сутки жизни) проведено определение антител к NR2 субъединице NMDA рецептора и антител к GluR1 субъединице AMPA рецептора глутамата в основной группе исследуемых новорожденных с сопоставлением степени поражения ЦНС по НСГ-исследованию в группе исследуемых новорожденных.
На начальном этапе статистической обработки полученной информации проводилось формирование базы данных с использованием программы Microsoft Office Exсel – 2003 для работы с электронными таблицами (лицензионное соглашение 74017-640-0000106-57177), включающей характеристику групп (клиническую, лабораторную, морфофункциональную). На основании сформированной базы данных проводились проверка, сортировка и кодирование (шифровка) полученной информации. Для статистического анализа использовался пакет прикладных программ Statistica (версия 6.1., лицензионное соглашение BXXR006B092218FAN11).
Проверка статистических гипотез осуществлялась путем выявления различий между сравниваемыми группами с применением теста Вальда–Вольфовица, U-критерия Манна–Уитни (сравнение двух независимых переменных). При всех статистических расчетах критический уровень ошибки р принимался равным 0,05. Сравнение групп по бинарному признаку или сравнение относительных частот внутри одной группы или в двух независимых группах проводились при помощи построения четырехпольных таблиц абсолютных частот, согласно проверке нулевой статистической гипотезы о равенстве относительных частот в двух популяциях с использованием точного двустороннего критерия Фишера, критерия χ2. Если абсолютные частоты в четырехпольных таблицах сопряженности составляли биомаркеров менее 10, то использовался критерий χ2 с поправкой Йетса на непрерывность.
Результаты исследования и их обсуждение. Гестационный возраст детей основной группы составил 32 [29; 33] недель, а масса тела при рождении – 1420 [1270; 1650] г. Гестационный возраст новорожденных контрольной группы – 39 [39; 40], а масса тела при рождении – 3420 [3270; 3920] г. Дети в сравниваемых группах были сопоставимы по полу: в 1-й и 2-й группах 17 [47,2%] и 15 девочек [41,7%] соответственно. Недоношенным новорожденным на этапе родильного зала оказание помощи проводилось согласно клиническим рекомендациям «Ведение новорожденных с респираторным дистресс-синдромом» (2016 г.).
На первом этапе исследования биомаркера в пуповинной крови установлено, что уровень NR2 пептида NMDA рецептора у новорожденных основной группы был статистически ниже, чем у новорожденных контрольной группы (U=278,0; р= 0,012). В основной группе уровень NR2 пептид NMDA рецептора составил Ме 0,043 нг/мл [0,016; 0,057], а в контрольной группе – Ме 0,083 нг/мл [0,059; 0,186] (рис. 1).
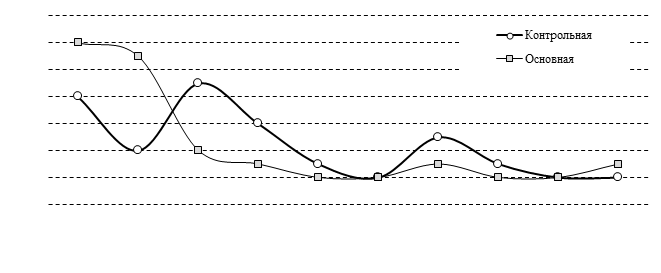
Рис. 1. Распределение значений уровня NR2 пептида NMDA рецептора в пуповинной крови у новорожденных основной и контрольной групп, нг/мл
Ось ординат – число детей, ось абсцисс – значения NR2 пептида NMDA рецептора, нг/мл.
На следующем этапе исследования новорожденных 1-й подгруппы – недоношенные новорожденные с задержкой внутриутробного развития плода (ЗВУР) – и 2-й подгруппы – недоношенные новорожденные без ЗВУР основной группы – не получено статистически значимых различий уровня NR2 пептида NMDA рецептора в пуповинной крови (U=53,0; р=0,403), однако установлено, что уровень NR2 пептида NMDA рецептора у детей со ЗВУР выше, чем у новорожденных без ЗВУР (0,041 нг/мл [0,014; 0,113] и 0,030 нг/мл [0,008; 0,048] соответственно). Полученный результат дает основание предположить, что гипоксическое-ишемическое повреждение ЦНС у недоношенных новорожденных с ЗВУР происходит на этапе внутриутробного развития.
Данный факт подтверждается оценкой степени метаболических нарушений у новорожденных со ЗВУР, которая проведена по уровню значения лактата в пуповинной крови. У недоношенных новорожденных 1-й подгруппы получен статистически значимо более высокий уровень лактата, чем в подгруппе 2 (U=22,0; р = 0,013): в подгруппе 1 – Ме 4 ммоль/л [3,0; 7,8], во 2-й подгруппе – Ме 2,8 ммоль/л [2,2; 3,0].
В дальнейшем нами был проведен эксперимент поискового характера по установлению связей между показателями. Сравнение показателей проводилось по медиане значений. В результате была получена связь значений лактата пуповинной крови с индексом резистентности (ИР) сосудов головного мозга по УЗДГ НСГ исследованию, проведенному к концу первых суток жизни (U=2,309; р= 0,028) и уровнем антител к NR2 субъединице NMDA рецептора на 14–21-й день жизни (U=2,409; р= 0,027). Новорожденные со значением лактата в интервале 2,95–7,8 ммоль/л имели пограничные, но укладывающиеся в референтные значения показатель ИР сосудов головного мозга – 0,795 (СКО=0,084) и высокие значения уровня антител к NR2 субъединице NMDA рецептора на 14–21-й день жизни – 0,987 нг/мл (СКО=0,360). Новорожденные с уровнем лактата 1,3–2,95 ммоль/л имели более низкие значения ИР сосудов головного мозга – 0,720 (СКО=0,083) и значение уровня антител к NR2 субъединице NMDA рецептора в 14–21-й день жизни – 0,218 нг/мл (СКО=0,653).
В ходе исследования установлено, что уровень лактата пуповинной крови в диапазоне 2,95–7,8 ммоль/л при высокой резистентности сосудов головного мозга в 1-е сутки жизни по результату УЗДГ НСГ исследования является предиктором эксайтотоксического повреждения ЦНС у недоношенного новорожденного.
Далее проанализирован уровень антител к NR2 субъединице NMDA рецептора и к GluR1 субъединице AMPA рецептора на 14–21-е сутки жизни у недоношенных новорожденных с различными исходами по поражению ЦНС (перивентрикулярная лейкомаляция (ПВЛ) и внутрижелудочковое кровоизлияние (ВЖК), без патологии со стороны ЦНС). Получены статистически значимые высокие показатели уровня антител к NR2 субъединице NMDA рецептора и субъединице GluR1 AMPA рецептора в крови новорожденных с тяжелым органическим поражением ЦНС (таблица).
Значения биохимических параметров у недоношенных новорожденных детей с различными исходами по поражению ЦНС, Ме [QL; QU]
|
Параметры |
Поражение ЦНС (ПВЛ+ВЖК) n=9 |
Без поражения ЦНС n=15 |
U |
р* |
|
Антитела к NR2 субъединице NMDA рецептора (нг/мл) |
1,24 [0,98; 1,36] |
0,29[0,19; 0,50] |
6 |
0,006* |
|
Антитела к GluR1 субъединице AMPA рецептора (нг/мл) |
0,53 [0,48;0,64] |
0,22 [0,198; 0,27] |
1 |
0,001* |
Примечание * – сравнение двух групп переменных по критерию Манна–Уитни.
Заключение. На современном этапе перинатальное поражение ЦНС у недоношенных новорожденных – заболевание с неоднозначным вариабельным прогнозом. Когнитивные и поведенческие нарушения у недоношенных новорожденных, даже без явного повреждения головного мозга, при оценке путем нейровизуализации подчеркивают критическую необходимость поиска микроструктурных и биохимических биомаркеров повреждения.
Глутаматные рецепторы в антенатальном и постнатальном периодах обеспечивают высокую нейропластичность. Они играют решающую роль в миграции нейронов, их дифференцировке, формировании дендритов и синапсов.
Высокая рецепторная активность нейронов у плода и новорожденного, с одной стороны, и уязвимость для эксайтотоксичности – с другой создают парадоксальную ситуацию: незрелый мозг может долго выдерживать возникший вследствие гипоксии/ишемии энергодефицит за счет возбудимости глутаматных рецепторов, однако при его определенном критическом пороге развивается апоптотическая гибель нейронов за счет механизма эксайтотоксичности.
С учетом знаний о восстановительном потенциале мозга в виде постнатального нейрогенеза огромное значение имеют раннее установление групп риска недоношенных новорожденных по поражению ЦНС и начало медикаментозной коррекции.
В настоящее время перспективным методом ранней диагностики эксайтотоксической гибели олигодендроцитов является определение компонентов глутаматергической нейромедиаторной системы головного мозга – пептида и антител к фрагментам глутаматных рецепторов NR2.
В ходе проведенного исследования установлены более низкие значения контрольных цифр NR2 пептида NMDA рецептора в пуповинной крови у недоношенных детей, чем у доношенных новорожденных. На основании полученного результата ошибочно делать заключение о степени эксайтотоксического повреждения головного мозга в данных группах новорожденных с учетом восприимчивости мозга недоношенного ребенка к AMPA- опосредованному повреждению, а доношенного – к NMDA- опосредованному повреждению. С учетом данных особенностей активности глутаматергических ионотропных рецепторов требуется дальнейшее исследование NR2 пептида NMDA рецептора у недоношенных детей с установлением контрольных цифр данного биомаркера для ранней диагностики повреждения ЦНС.
Однако у недоношенных новорожденных, имеющих задержку внутриутробного развития, установлены более высокие цифры NR2 пептида NMDA рецептора в совокупности с высоким уровнем лактата пуповинной крови. Это дает основание предполагать, что в данной когорте детей запуск механизма эксайтотоксического поражения ЦНС инициируется на антенатальном этапе развития. Также установлено, что уровень антител к NR2 субъединице NMDA рецептора (0,987 нг/мл (СКО=0,360)) на 14–21-й день жизни в совокупности с уровнем лактата пуповинной крови (в диапазоне 2,95–7,8 ммоль/л) и резистентностью сосудов головного мозга (0,795 (СКО=0,084)) в 1-е сутки жизни могут выступать предикторами поражения ЦНС у недоношенного ребенка старше 21 дня жизни.
По результатам нашего исследования у недоношенных детей с поражением ЦНС (перивентрикулярная лейкомаляция и внутрижелудочковое кровоизлияние) уровень антител к NR2 субъединицы NMDA рецептора и к GluR1 субъединице AMPA рецептора на 14–21-й сутки жизни выше, чем у здоровых недоношенных новорожденных, что указывает на механизм эксайтотоксического повреждения в генезе поражения ЦНС и необходимость проведения длительной антиоксидантной терапии у данной категории детей. Мы видим перспективу в использовании биомаркеров эксайтотоксического поражения ЦНС-пептида NR2 субъединицы NMDA рецептора и антитела к NR2 субъединице NMDA рецептора и GluR1 субъединице AMPA-рецептора глутамата в когорте недоношенных детей с целью диагностики, разработки путей персонализированной медикаментозной терапии и прогнозирования исходов поражения ЦНС.



