Задача нейрохирурга состоит не только в стремлении к тотальности удаления новообразования, но и в сохранении исходного уровня качества жизни пациента. Одним из факторов, влияющих на отдаленный послеоперационный период у нейроонкологических больных, является возникновение в зоне кортикотомии оболочечно-мозговых рубцов, которые могут вызывать эпилепсию. Кроме этого, с субдуральными сращениями тканей нейрохирурги сталкиваются при повторных оперативных вмешательствах по поводу продолженного роста опухолей головного мозга. Наличие спаек мозгового вещества с подлежащими к нему оболочками приводит к усложнению процесса диссекции, повышая вероятность повреждения корковых представительств функциональных зон.
Цели исследования – определение эффективности использования синтетической мембраны в профилактике рубцово-спаечного процесса в субдуральном пространстве, а также оценка влияния применения этого импланта на развитие эпилепсии в послеоперационном периоде.
Материал и методы исследования
Характеристика пациентов
Основная группа включает 28 пациентов, которым была установлена субдуральная мембрана после удаления опухоли (группа М). Новообразование локализовалось в лобной доле в 6 наблюдениях (21,4%), височной ‑ в 4 (14,3%), теменной ‑ в 5 (17,8%), затылочной ‑ в 1 (3,6%) и в мозжечке ‑ в 1 (3,6%) случае. У 11 больных (39,3%) объемное образование прорастало 2 доли головного мозга и более. Тотальной, субтотальной и частичной резекции удалось достигнуть в 19 (67,9%), 5 (17,8%) и 4 (14,3%) случаях соответственно. 5 пациентов (17,9%) оперированы повторно по поводу продолженного роста.
В контрольную группу были включены 25 пациентов, которым не устанавливалась субдуральная мембрана (группа К). В 7 (28,0%) случаях опухоль располагалась в лобной доле, в височной ‑ в 2 (8,0%), в теменной ‑ в 5 (20,0%) и в 2 случаях (8,0%) ‑ в затылочной доле. 9 (36,0%) пациентов контрольной группы имели объемные образования, захватывающие 2 доли головного мозга и более. Тотальная, субтотальная и частичная резекция достигнута в 14 (56,0%), 5 (20,0%) и 6 (24,0%) случаях соответственно. 7 пациентов (28,0%) оперированы по поводу продолженного роста новообразования.
Градация опухолей по степени злокачественности представлена в таблице 1. Всем пациентам основной и контрольной групп было выполнено герметичное ушивание твердой мозговой оболочки (ТМО).
Таблица 1
Градация степени злокачественности опухолей
|
Степень злокачественности |
Группа М (n=28) |
Группа К (n=25) |
|
Grade I |
2 (7,1%) |
‑ |
|
Grade II |
7 (25,0%) |
9 (36,0%) |
|
Grade III |
8 (28,6%) |
5 (20,0%) |
|
Grade IV |
11 (39,3%) |
11 (44,0%) |
Синтетическая мембрана
Имплант состоит из безусадочного пространственно-сшитого полимера, для синтеза которого используются олигомеры метакрилового ряда. Материал характеризуется отсутствием микропор. Толщина импланта составляет 200 мкм. Эластичная структура позволяет выполнять его укладку через небольшие разрезы ТМО. В нашей клинике мы используем субдуральную мембрану «Реперен».
Техника установки мембраны
Нами разработан метод профилактики образования оболочечно-мозговых рубцов (Патент RU2543855C1). Схема установки синтетической мембраны представлена на рисунке 1.
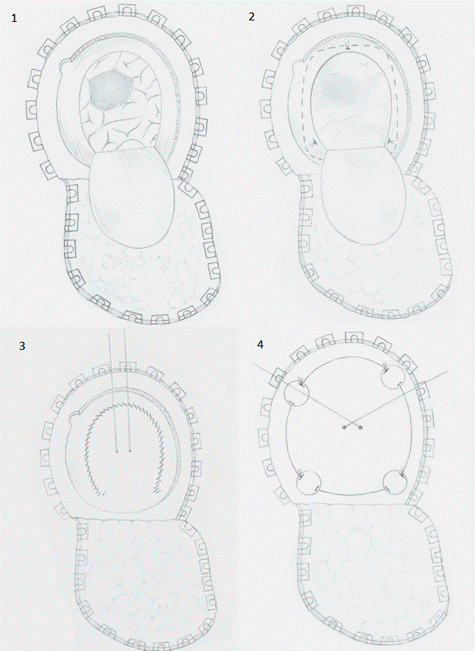
Рис. 1. Схема установки субдуральной мембраны
После удаления опухоли головного мозга или другого патологического очага осуществляется гемостаз. Визуально определяются участки субарахноидального кровоизлияния, повреждения коры и арахноидальной оболочки. Субдурально устанавливается синтетический имплант. Путем смещения его по поверхности мозга перекрываются все участки повреждения коры. Снаружи, в центре лоскута ТМО, проводят нить, прошивая мембрану. Концы нити не завязывают, выводя на наружную поверхность оболочки. Выполняются фиксация импланта по периметру разреза ТМО и ее герметичное ушивание. Нити, проведенные через центр оболочки и подшитые к импланту, выводятся по двум заранее сформированным отверстиям в костном лоскуте. После фиксации кости концы нити завязывают, подтягивая ТМО с имплантом к внутренней пластинке костного лоскута, что обеспечивает формирование сферичной формы мембраны.
Характеристика исследуемых факторов
Были проанализированы клинические данные, данные магнитно-резонансных, компьютерных томографий в до- и послеоперационном периодах. Собран катамнез пациентов посредством телефонных звонков. Оценивалась частота развития эпилепсии в послеоперационном периоде. Производилось сравнение степени выраженности оболочечно-мозговых рубцов в основной и контрольной группах при повторной операции. Статистическая обработка результатов проведена с использованием теста Манна‑Уитни для непарных данных, применялись точный критерий Фишера, критерий χ2, критерий χ2 Пирсона с поправкой Йетса.
Результаты исследования и их обсуждение
Эпилепсия в послеоперационном периоде
В таблице 2 представлены характеристика групп, сравниваемые параметры и критерии статистической оценки.
Таблица 2
Характеристика групп пациентов, оперированных с применением субдуральной мембраны и без нее
|
Сравниваемые параметры |
Группа М (n=28) Основная группа Me [Q1;Q2]1 |
Группа К (n=25) Контрольная группа Me [Q1;Q2] |
Уровень значимости, p |
|
Пол (мужской/женский)2 |
15/13 |
11/14 |
0,33; 0,68 |
|
Возраст, лет3 |
44,8 [40; 54] |
40,1 [29,8; 52,2] |
0,17 |
|
Гистологическое заключение (Grade I/Grade II/Grade III/Grade IV)4 |
2/7/8/11 |
0/9/5/11 |
0,43 |
|
Эпилепсия в послеоперационном периоде (нет/есть)2 |
26/2 |
21/4 |
0,28; 0,56 |
Me ‑ медиана ‑ центральное значение признака в выборке, справа и слева от которого расположены равные количества объектов исследования; [Q1;Q2] ‑ значения 25-го и 75-го процентилей распределения, между которыми расположены 50% значений признака в выборке; 2точный критерий Фишера и критерий χ2 с поправкой Йетса. 3U-критерий Манна‑Уитни; 4критерий χ2 Пирсона.
У 15 (53,6%) из 28 пациентов группы М до проведения операции в клинической картине присутствовала эпилепсия. Эти больные получали симптоматическую противоэпилептическую терапию на амбулаторном этапе. Отмечалась конвекситальная локализация опухоли во всех 15 случаях, из них в 12 новообразование прорастало кору головного мозга, а в 3 ‑ располагалось субкортикально с максимальной глубиной энцефалотомии до 1 см. У двоих больных в послеоперационном периоде произошло нарастание частоты эпилептических приступов. В первом случае ухудшение произошло через 2 месяца после операции, а во втором ‑ через 40 месяцев, и нарастание симптоматики у этого пациента было ассоциировано с продолженным ростом опухоли.
Пациенты, у которых на дооперационном этапе отсутствовали эпилептические приступы, не сообщали о появлении данных симптомов в послеоперационном периоде.
В группе К эпилепсия в дооперационном периоде имелась у 8 (32,0%) больных из 25. 7 пациентов получали противоэпилептические препараты. В 7 случаях опухоль прорастала кору головного мозга, в 1 ‑ новообразование локализовалось субкортикально. При сборе катамнеза 1 пациент сообщил об учащении эпилептических приступов через 1,5 месяца после операции.
Среди 17 больных, которые до проведения оперативного лечения не сообщали об эпиприступах, у 3 появилась симптоматическая эпилепсия. Эти случаи были связаны с продолженным ростом опухоли по данным контрольной магнитно-резонансной томографии.
Статистический анализ не показал достоверной связи между факторами установки субдуральной мембраны и наличием эпилепсии в послеоперационном периоде (p=0,56).
Выраженность рубцово-спаечного процесса в субдуральном пространстве
Повторная операция выполнена 5 пациентам из группы М. Всем 5 больным проводилась лучевая терапия после первичного хирургического вмешательства по поводу опухоли головного мозга. Медиана времени между операциями составила 14,6 месяца. В наблюдаемых нами случаях не было обнаружено оболочечно-мозговых рубцов в зоне установки субдурального импланта (рис. 2). Его удаление не сопровождалось травматизацией окружающих тканей.
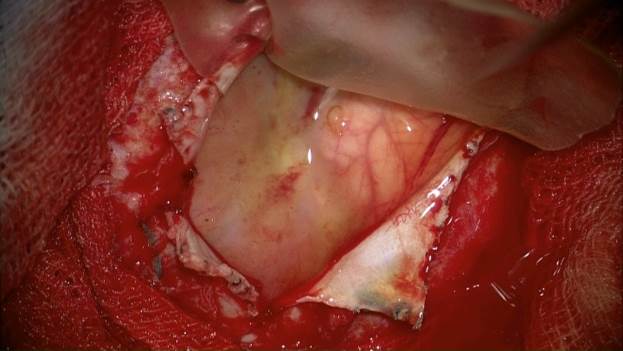
Рис. 2. Удаление субдуральной мембраны из области первичного оперативного вмешательства
У 7 больных из контрольной группы, которые были оперированы по поводу продолженного роста, отмечены сращения ТМО с подлежащими тканями. В 2 случаях наблюдались спайки с краями дефекта арахноидальной оболочки. Их разделение не приводило к значимым повреждениям коры головного мозга (рис. 3).
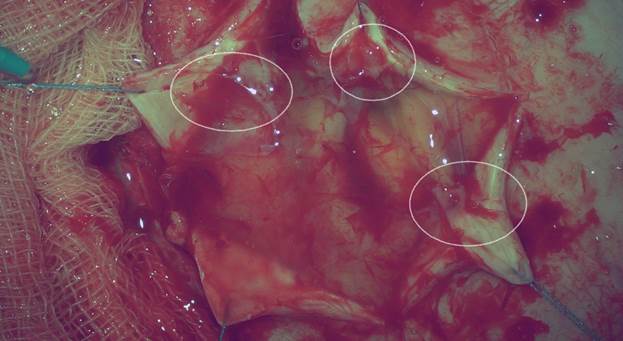
Рис. 3. Спайки арахноидальной и твердой мозговой оболочек
У 5 пациентов возникли грубые оболочечно-мозговые рубцы, представленные плотными тяжами, спаянными с прилегающей корой головного мозга, опухолью и ТМО (рис. 4).
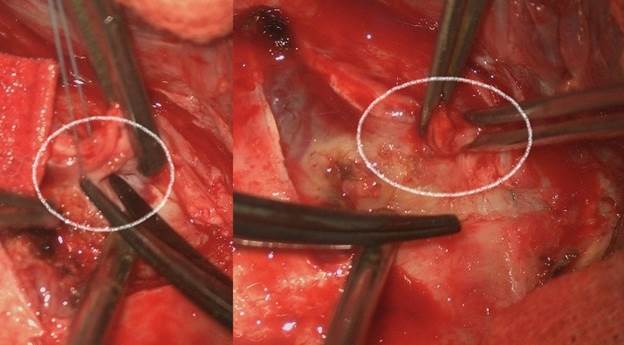
Рис. 4. Грубые оболочечно-мозговые рубцы
Их диссекция сопровождалась кровотечением из образованных сращений и тракцией приращенного к ним мозгового вещества. 6 из 7 пациентов после первой операции по поводу основного заболевания получали лучевую терапию. Медиана времени между операциями составила 9,9 месяца. В таблице 3 представлены сравниваемые параметры и критерии статистической оценки.
Таблица 3
Выраженность срастания тканей в субдуральном пространстве при повторной операции
|
Сравниваемые параметры |
Группа М (n=5) |
Группа К (n=7) |
Уровень значимости, p |
|
Срастания тканей при повторной операции (нет/спайки/рубцы)1 |
5/0/0 |
0/2/5 |
0,003 |
1Критерий χ2 Пирсона.
В результате анализа данных было установлено достоверное влияние установки субдуральной мембраны на предотвращение образования сращений в проекции оперативного вмешательства (p=0,003).
Хирургическое лечение опухолей головного мозга связано с неизбежной травматизацией здоровых тканей в ходе оперативного доступа. Образование рубцов в местах рассечения оболочек и энцефалотомии является нормальным физиологическим процессом. Возникновение сращений в указанных локализациях может привести к метеопатизации личности, цефалгическому и эпилептическому синдромам [1].
Известны попытки профилактики образования спаек мозгового вещества с прилегающими оболочками. P. Gonzalez-Lopez et al. (2015) в своей работе провели сравнение в группах пациентов, которых оперировали с субдуральной укладкой тонкого слоя желатиновой губки и без нее. 29 больных были повторно оперированы. 14 пациентов контрольной группы имели субдуральные спайки тканей различной степени выраженности. У всех 15 пациентов из группы с установкой желатиновой композиции были зафиксированы отсутствие или минимальная выраженность сращений при повторной операции [2]. Схожие результаты получены и в нашей работе. Полное отсутствие сращений может быть связано с большей интактностью синтетического материала в отношении прилежащих тканей. Экспериментальное исследование Д.Е. Алексеева с соавт. (2017), выполненное на 60 лабораторных животных, выявило целесообразность применения различных коллагеновых матриксов, таких как Duraform, Lyostypt, прототипа отечественного матрикса, в пластике ТМО и снижении степени формирования оболочечно-мозгового рубца. Авторы отдельно подчеркивают отсутствие значимой разницы при использовании тех или иных композиций [3]. Данная выборка представляет существенный интерес с точки зрения сравнения различных препаратов, однако ограничивается наблюдением за лабораторными животными. Существуют и другие работы, подтверждающие безопасность и уместность применения коллагеновых препаратов для предотвращения сращения тканей в области оперативного доступа [4‑7].
Ю.В. Зотов с соавт. (2003) предлагают иной подход к профилактике возникновения спаивания с оболочками головного мозга. После трепанации черепа между ТМО и мягкими тканями головы на место удаленной кости черепа помещают рассасывающуюся коллагеновую пленку, в состав которой входят дексаметазон в количестве 1‑5 мг/см2 и лидаза в количестве 16‑64 ед./см2. Способ направлен на предупреждение созревания рубцовой ткани [8].
В экспериментальном исследовании на кроликах C. Ozdol et al. (2015) показали возможность гемостатического материала Спонгостан предотвращать спаечный процесс в послеоперационном периоде. В 11,1% случаев был зафиксирован легкий фиброз [9]. Эти результаты могут рассматриваться в пользу выбора синтетических имплантов.
Стоит подчеркнуть, что, помимо положительных качеств, существует риск индивидуальной непереносимости белковых компонентов коллагеновых мембран. Опубликован ряд работ, в которых сообщается об аллергических реакциях на применение данных композиций [10‑12]. Синтетический имплант ввиду своей интактности к окружающим тканям лишен данного недостатка. Тем не менее, его установка повышает вероятность развития гнойно-воспалительных процессов. В случае их возникновения пациенту потребуется экстренная операция по удалению импланта [13].
Помимо представленной в исследовании синтетической мембраны, существует и ряд других материалов для пластики ТМО, которые также разграничивают ткани в области оперативного доступа, например ксенотрансплантат «Lyoplant», микропористый нетканый полиэстер «Neuro-Patch» [14, 15]. Все эти материалы могут применяться для профилактики рубцовых процессов не только при хирургическом лечении опухолей головного мозга, но и, например, при операциях по поводу черепно-мозговой травмы (ЧМТ). Тем не менее, при открытой проникающей ЧМТ оптимальнее использовать аутотрансплантаты для пластики ТМО, что позволяет снизить вероятность инфекционных осложнений [13].
Заключение
В данном исследовании нами не выявлено значимого влияния установки субдуральной мембраны на частоту возникновения эпилепсии в послеоперационном периоде у нейроонкологических больных. В то же время применение синтетического импланта показало высокую эффективность в профилактике образования оболочечно-мозговых рубцов, что, в свою очередь, сокращает время операции и вероятность дополнительного повреждения коры головного мозга в зоне первичного доступа. Описанная методика может быть рекомендована к применению не только в нейроонкологии, но и при других нейрохирургических патологиях, которые не исключают проведения повторных оперативных вмешательств, например при невралгии черепных нервов, ЧМТ. Полученные результаты лимитированы небольшой выборкой, отсутствием электроэнцефалографии в до- и послеоперационном периодах и требуют дальнейшего изучения с учетом этой информации.



