Основными причинами непреднамеренного отравления СО являются недостаточно вентилируемые продукты сгорания от отопительных приборов, пожары и автомобильные выхлопные газы. Сообщалось об увеличении числа интоксикации угарным газом из-за возрастания использования в мире потребления древесного угля для отопления жилых помещений, а также преднамеренных случаев отравления. CO не имеет запаха, но контакт с ним является фатальным для организма, что считается идеальным инструментом для самоубийства, причем не менее трети таких попыток суицида осуществляется в состоянии алкогольного опьянения [1]. Наиболее распространенными жалобами пострадавших после контакта с угарным газом являются недуги, связанные с неврологическими осложнениями, потому что мозг является одним из наиболее уязвимых органов к гипоксии.В дополнение к гипоксии, отравление СО может вызывать иммунологические и воспалительные реакции во всех органах человеческого тела путем продуцирования активных форм кислорода, которые наиболее стабильны и не зависят от уровня гипоксии [2, 3]. Отдельный интерес представляет патоморфология отравления угарным газом на фоне алкогольного опьянения, так как в литературе отсутствуют описания морфологических проявлений конкретно для этой комбинации, возникающих в ответ на действие данных токсических веществ в эксперименте. При этом, как уже указывалось ранее, наличие воздействия сопутствующих отравлению сложно контролируемых внешних и внутренних факторов приводит к тому, что одно лишь определение в биологических субстратах отравляющего вещества, находящегося в свободном или связанном состоянии, в том числе алкоголя и карбоксигемоглобина, в целом ряде случаев тоже не может служить безусловной гарантией диагностики смерти от отравления [4, 5]. Несмотря на то, что ряд авторов упоминали в своих работах сочетанную интоксикацию алкоголем и угарным газом, предметом их исследований являлся трупный материал людей, погибших при пожарах, а также медицинские карты пациентов токсикологических отделений. Полноценных экспериментальных исследований данной патологии на лабораторных животных в доступной литературе нами не обнаружено [6].
Цель исследования – изучить морфофункциональные изменения внутренних органов крыс (головной мозг, сердце, легкие) при остром отравлении угарным газом на фоне тяжелой алкогольной интоксикации.
Материалы и методы исследования
Эксперименты проведены с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18 марта 1986 г.). Исследование выполнено на 40 беспородных белых крысах-самцах возрастом 10–12 месяцев весом 235–271 г. В ходе эксперимента животные рандомным образом были разделены на 4 группы по 10 особей. Первая группа (контроль) получала внутрижелудочно водопроводную воду (20 мл/кг), через 30 мин после этого животные помещались в герметичную камеру объемом 3000 мл с атмосферным воздухом на 3 мин. Второй группе интрагастрально вводили 40 % этиловый спирт (20 мл/кг), спустя аналогичный промежуток времени после введения крысы также помещались в камеру с атмосферным воздухом на 3 мин. Третья группа получала водопроводную воду аналогичным образом и спустя полчаса помещалась в герметичную камеру с угарным газом, концентрация которого составляла 0,5 %, на 3 мин. Четвертой группе интрагастрально вводили 40 % этиловый спирт (20 мл/кг), спустя аналогичный промежуток времени все животные четвертой группы помещались в камеру с СО (0,5 %) на 3 мин [7].
После чего у всех крыс производилось взятие 1 мл крови из хвостовой вены для определения концентрации карбоксигемоглобина на приборе ПолиГЕМ ЭКСПРЕССПРО концентрации этанола (на газовом хроматографе Кристалл 2000М). Животных выводили из опыта тотчас после извлечения из камеры с угарным газом, путем декапитации под хлоралгидратным наркозом (250 мг/кг веса). Вскрытие проводили по общепринятой методике с взятием материала для гистологического исследования (кусочки головного мозга, легких, сердца). Полученный материал подвергали стандартной гистологической обработке и получали парафиновые срезы толщиной 7–10 мкм с последующей окраской гематоксилином и эозином, а также пикрофуксином по методу Ван Гизона. Микроскопическое исследование проведено на тринокулярном микроскопе Микромед 3 вар. 3-20М. Статистическую обработку данных проводили при помощи программы «Statistica for Windows 6,0». Количественные показатели сравнивали с помощью метода Манна, равенство выборочных средних проверяли по t-критерию Стъюдента. Критерием статистической значимости было значение p < 0,05.
Результаты исследования и их обсуждение
У животных из первой группы (контроль), получавших внутрижелудочно воду и находившихся в камере с атмосферным воздухом, концентрация этанола крови составляла не более 0,02 ‰, а уровень карбоксигемоглобина крови составлял менее 3 % (в пределах нормы), на гистологических препаратах статистически значимых изменений отмечено не было (рис. 1, А1, рис. 2, В1, рис. 3, С1).
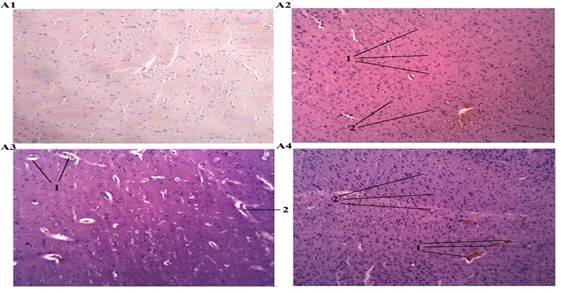
Рис. 1. Патология головного мозга крысы.
А1. Головной мозг крысы (Контроль). Окраска: гематоксилин и эозин. Ув. 100.
А2. Головной мозг крысы (Воздействие алкоголя): 1 – слабовыраженный диффузный отек, 2 – набухание отдельных нервных клеток. Окраска: гематоксилин и эозин. Ув. 100.
А3. Головной мозг крысы (Воздействие СО): 1 – массивный периваскулярный, 2 – перицеллюлярный отек. Окраска: гематоксилин и эозин. Ув. 100.
А4. Головной мозг крысы (Воздействие алкоголя и СО): 1 – полнокровие сосуда, 2 – умеренная глиальная реакция. Окраска: гематоксилин и эозин. Ув. 100
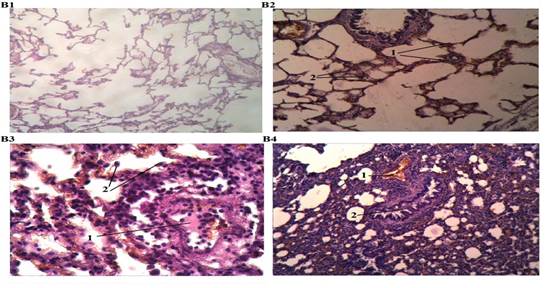
Рис. 2. Патология легких крысы.
В1. Легкое крысы (Контроль). Окраска: гематоксилин и эозин. Ув. 100.
В2. Легкое крысы (Воздействие алкоголя): 1 – неравномерное полнокровие межальвеолярных перегородок, 2 – слабый интерстициальный отек. Окраска: гематоксилин и эозин. Ув. 100.
В3. Легкое крысы (Воздействие СО): 1 – сосуд с гиалиновым тромбом и лейкостазом, 2 – десквамативный альвеолит. Окраска: гематоксилин и эозин. Ув. 400.
В4. Легкое крысы (Воздействие алкоголя и СО): 1 – полнокровие и отек межальвеолярных перегородок, 2 – спазм и деформация мелких бронхов, 3 – реактивная мононуклеарная инфильтрация. Окраска: гематоксилин и эозин. Ув. х100.
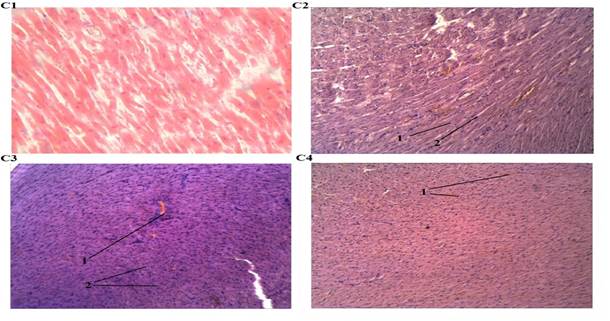
Рис. 3. Патология миокарда крысы.
С1. Миокард крысы (Контроль). Окраска: гематоксилин и эозин. Ув. 100.
С2. Миокард крысы (Воздействие алкоголя): 1 – дистрофия кардиомиоцитов, 2 – слабый межуточный отек. Окраска: гематоксилин и эозин. Ув. 100.
С3. Миокард крысы (Воздействие СО): 1 – полнокровие интрамуральных сосудов, 2 – набухание кардиомиоцитов. Окраска: гематоксилин и эозин. Ув. 100.
С4. Миокард крысы (Воздействие алкоголя и СО): 1 – полнокровие сосудов субэпикардиальных слоев. Окраска: гематоксилин и эозин. Ув. 100.
Крысы второй группы получали внутрижелудочно 40 % этиловый спирт, но не контактировали с СО. У них уровень HbCO крови не превышал 3 %, однако наблюдалось статистически значимое (p < 0,05) повышение этанола крови (до 1,4 – 2,0 ‰). Во внутренних органах крыс, подвергшихся токсическому воздействию этанола, можно было наблюдать расстройства преимущественно дисциркуляторного характера в виде неравномерного полнокровия, большей частью венозного, от слабой до умеренной степени выраженности. Микроциркуляторные расстройства вели к развитию межуточного отека и слабовыраженным альтеративным изменениям паренхиматозных элементов в виде острого набухания и белковой дистрофии, преимущественно зернистого характера. Так, со стороны головного мозга наблюдалось неравномерное полнокровие сосудов со стазом в отдельных капиллярах, диффузный слабовыраженный периваскулярный и перицеллюлярный отек с набуханием и зернистыми изменениями части нейронов (рис. 1, А2). В легких определялось неравномерное полнокровие сосудов межальвеолярных перегородок, слабый интерстициальный отек. Альвеолярный эпителий местами выглядел набухшим, зернистым. Мелкие бронхи незначительно расширены, в строме обнаруживали скудные мононуклеарные инфильтраты (рис. 2, В2). В миокарде картина диффузного венозного полнокровия с признаками стаза в капиллярной сети и единичными точечными кровоизлияниями, небольшой межуточный отек и дистрофические изменения отдельных кардиомиоцитов (рис. 3, С2).
Третья группа крыс подвергалась изолированному воздействию СО. Алкоголь в крови у них не превышал допустимого уровня, но определялось статистически значимое повышение концентрации карбоксигемоглобина крови, которая варьировала от 34 до 50 %. Острое отравление угарным газом уже в ранние сроки наблюдения вызывало выраженные морфологические изменения в различных органах и тканях экспериментальных животных. В первую очередь они характеризовались стойкой перестройкой кровотока с развитием выраженного и диффузно распространенного полнокровия, затрагивающего все отделы сосудистой сети. Полнокровие сопровождалось резкими расстройствами сосудисто-тканевой проницаемости, что проявлялось явлениями плазморрагии, плазматического пропитывания сосудистых стенок и эритродиапедеза. Кроме того, присоединялись признаки геморрагического синдрома в виде кровоизлияний различного масштаба – от точечных до более крупных очагов геморрагической инфильтрации поврежденной ткани, особенно выраженные в миокарде и легких. Признаки повреждения паренхимы органов в условиях нарушенного кровообращения регистрировались в виде острого набухания, зернистых изменений элементов паренхимы, а в ряде случаев они носили заметный деструктивный и десквамативный характер. В частности, в головном мозге наблюдалось резко выраженное полнокровие микрососудов с явлениями распространенного стаза и гиалинового микротромбоза, очаговые плазматические пропитывания сосудистых стенок с массивным периваскулярным и перицеллюлярным отеком (рис., 1, А3), а также мелкоточечные кровоизлияния диапедезного характера в отдельных участках. Отмечалось набухание и зернистые изменения отдельных нейронов, а также слабовыраженная глиальная реакция. В легких межальвеолярные перегородки выглядели утолщенными за счет сосудистого полнокровия, интерстициального отека и реактивной клеточной инфильтрации. В более крупных сосудах резкое полнокровие сочеталось с плазматическим пропитыванием стенки и очаговым диапедезом эритроцитов и гиалиновым тромбозом отдельных сосудов. В отдельных участках легочной ткани регистрировались более массивные кровоизлияния как внутриальвеолярной, так и стромальной локализации. Альвеолярный эпителий выглядел набухшим, цитоплазма зернистой, наблюдалась его очаговая десквамация (рис. 2, В3). Со стороны паренхимы – очаговые изменения по типу дистелектазов. Мелкие бронхи были спазмированы, просвет их деформирован, содержал слизисто-лейкоцитарные массы, стенка отечна. В миокарде диффузное резкое полнокровие интрамуральных сосудов захватывало как артериолярное, так и венулярное звено (рис. 3, С3), множественные диапедезные кровоизлияния имели преимущественно субэпикардиальную локализацию. Капилляры, напротив, выглядели спавшимися, запустевшими. Межуточный отек носил слабовыраженный характер, отдельные группы кардиомиоцитов были диссоциированы, часть из них имела извитой ход.
Четвертая группа животных подвергалась сочетанному воздействию 40 % этанола и угарного газа. У данной группы крыс отмечалось статистически значимое повышение этанола в крови до 1,4–1,9 ‰ и уровня карбоксигемоглобина до 36–55 %. Сочетанное воздействие алкоголя и угарного газа характеризовалось развитием мозаичных микроциркуляторных расстройств. Участки выраженной гиперемии, как артериального, так и венозного характера, чередовались с зонами малокровия и запустевания сосудов, преимущественно приносящего звена.
В головном мозге у животных четвертой группы отмечалось резкое полнокровие сосудов мозговых оболочек, сосудистых сплетений и вещества мозга. Мозговые капилляры выглядели частично спавшимися, запустевшими, другие, напротив, были расширены, с признаками стаза. Отмечался умеренный периваскулярный и перицеллюлярный отек, явления диапедеза и геморрагий носили единичный характер. Регистрировалась умеренная глиальная реакция, что может рассматриваться как признак повреждения нервной ткани (рис. 1, А4).
В легких выраженное полнокровие сосудов различного калибра в межальвеолярных перегородках сочеталось с явлениями интерстициального отека с переходом в альвеолярный геморрагического характера. Внутриальвеолярные и стромальные кровоизлияния диффузно распространялись по легочной ткани. Мелкие бронхи выглядели спазмированными, деформированными, в их просвете в отдельных участках обнаруживались слизистые пробки и слущенный эпителий (рис. 2, В4). Со стороны паренхимы – реактивная мононуклеарная инфильтрация, явления десквамативного альвеолита, диффузные мелкоочаговые дистелектазы. В миокарде неравномерное кровенаполнение сосудов проявлялось очагами выраженного полнокровия, преимущественно в субэпикардиальной зоне (рис. 3, С4), в сочетании с мелкоточечными кровоизлияниями диапедезного характера, явлениями лейкостаза, а в более глубоких отделах миокарда, напротив – значительная часть сосудов оставалась спавшейся, запустевшей. Выраженный межуточный отек сопровождался диссоциацией кардиомиоцитов, часть которых имела извитой ход. В цитоплазме кардиомиоцитов обнаруживались диффузные зернистые изменения, поперечная исчерченность прослеживалась плохо.
Как видно, распространенность указанных изменений по органам у животных четвертой группы носила неравномерный характер: если в легких, печени гиперемия была значительно выражена, то в сосудах головного мозга и сердца (особенно в глубоких слоях миокарда) интенсивность кровенаполнения снижалась, а капилляры зачастую выглядели запустевшими. Проницаемость сосудистой стенки тоже менялась неравномерно: если в легких геморрагические проявления были резко выраженными, то со стороны головного мозга и сердца они были менее заметны, по сравнению с предыдущей серией. Признаки повреждения паренхиматозных элементов органов во всех случаях носили ярко выраженный и распространенный характер, что проявлялось развитием набухания клеток, дистрофических изменений цитоплазмы, а в отдельных участках – деструкции.
Заключение
Таким образом, при отравлении алкоголем морфологические изменения в исследуемых тканях имели в массе своей неспецифический характер. Отравления угарным газом вызывали достаточно характерные для данного вида интоксикации поражения, максимально выраженные в наиболее чувствительных к гипоксии органах. При сочетанном воздействии угарного газа и алкоголя морфологическая картина в большей степени соответствовала отравлению СО, однако альтернативные изменения носили достоверно выраженный характер, как по части дисциркуляторных расстройств, так и в отношении патоморфологических изменений паренхимы. Это может указывать на взаимное отягощение патогенного влияния этих двух видов интоксикации.



