Терапия антимикробными препаратами – одна из немногих этиотропных терапий, устраняющих патогенные микроорганизмы. Открытие и разработка противомикробных препаратов для клинического применения – это самый успешный момент в медицине [1]. Механизм действия противомикробных препаратов включает активность в отношении важных компонентов микробного обмена, таких как синтез клеточной стенки, синтез белка, синтез рибонуклеиновой кислоты (РНК), синтез дезоксирибонуклеиновой кислоты (ДНК) [2, 3].
При терапии и сдерживании инфекционных заболеваний успешное использование противомикробных средств сталкивается с определенными трудностями – микроорганизмы способны развивать различные формы резистентности к антимикробным препаратам. Чем шире применение антимикробных препаратов, тем, соответственно, выше уровень и сложность возникающей резистентности. Возникновение мультирезистентности (множественной) к нескольким противомикробным препаратам стало ведущей проблемой современного здравоохранения, так как существенно снижается количество доступных и эффективных противомикробных средств терапии инфекций, вызванных резистентными микроорганизмами [4, 5].
В настоящее время микроорганизмы развивают устойчивость к широкому спектру используемых противомикробных препаратов. Преодоление устойчивости микроорганизмов и ранее достигалось путем обнаружения и разработки новых противомикробных соединений или разработкой производных, полученных полусинтетическим путем. Поэтому способы решения этой проблемы, такие как поиск новых соединений, понимание механизма действия новых соединений и того, как работают механизмы сопротивления микроорганизмов, не теряют актуальности и в XXI в. [6, 7].
Все ускоряющееся развитие фундаментальных наук создает условия для поиска и синтеза новых фармакологически активных молекул, способных выступать в роли лекарственных препаратов. Альтернативные источники создания потенциальных лекарственных форм значительно раздвигают рамки возможностей фармакотерапии основных заболеваний человека, как инфекционного генеза, так и неинфекционного. Вместе с этим внедрение лекарственных препаратов на основе новых химических субстанций в клиническую практику возможно лишь при условии тщательного доклинического изучения их фармакологической активности и безопасности [8]. В целях научно-практического обоснования безопасного применения данных об активности соединений нового класса – фторсодержащих производных замещенных 1Н-индол-4-,6-,7-иламинов [9] – возникла необходимость изучить токсические эффекты этих соединений.
Для оценки выживаемости клеток, цитотоксического эффекта (потери живых клеток) и пролиферации (изменения пролиферации в состоянии покоя) традиционно используется метилтетразолиевый тест (МТТ-тест). Токсикометрическая характеристика нового соединения (кандидата в лекарственное средство) – острая токсичность – определяется как его способность вызывать смерть экспериментальных животных после однократного введения или при введении через короткие интервалы времени в течение дня. Анализ острой токсичности необходим для подсчета летальных, токсических и переносимых доз исследуемого вещества и определения причин гибели экспериментальных животных [8].
Цель исследования: обоснование безопасного применения тестируемых соединений нового класса – трифторметилированных производных замещенных 1Н-индол-4-, 6-, 7-иламинов с противомикробной активностью.
Материалы и методы исследования. Исследуемые соединения. В работе исследовались трифторметилированные производные замещенных 1Н-индол-4-, 6-, 7-иламинов (рис. 1). Тестерные соединения использовали в растворах, растворитель – «Димексид» (основной действующий компонент – диметилсульфоксид (ДМСО), в работе использовали коммерческий концентрат для приготовления растворов для наружного применения (ООО «Биофармакс», Россия).
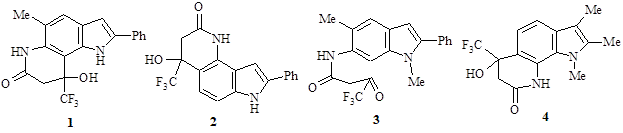
Исследуемые соединения: трифторметилпирроло[2,3-f]хинолинон (1), трифторметилпирроло[2,3-h]-хинолинон (2), трифторметил-1Н-индол-6-илоксобутанамид (3), трифторметилпирроло[3,2-h]хинолинон (4)
Тестерная культура клеток. Культура клеток HeLa ATCC ® CCL-2TM – эпителиальные клетки аценокарциномы шейки матки человека (ГУ «НИИВ им. Д.И. Ивановского» РАМН).
Тестерные животные. В эксперименте использованы мыши (масса 18–20 г, n=170), крысы (масса 180–200 г, n=210) – белые аутбредные (нелинейные), обоего пола, возраст 2,5 месяца.
Исследование одобрено этическим комитетом Медицинского института Федерального государственного бюджетного образовательного учреждения высшего образования «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва».
Цитотоксическое действие исследуемых соединений оценивали in vitro в МТТ-тесте. Анализировали выживаемость культуры опухолевых клеток HeLa ATCC ® CCL-2TM. Исследуемые соединения оказывают цитотоксическое действие, если процентный показатель оптической плотности полученного раствора меньше 70%. Исследуемые соединения тестировались в концентрациях 50,0 мкг/мл, 500,0 мкг/мл, 1000,0 мкг/мл. Выживаемость культуры клеток в контроле составляла 100%. В процентах к контролю выражали долю метаболически активных/жизнеспособных клеток [8, 10, 11, 12].
Острую токсичность исследуемых соединений анализировали по способности вызывать гибель экспериментальных животных после однократного введения. Тестерные соединения вводили лабораторным крысам и мышам различными путями – внутрибрюшинно, внутрижелудочно и накожно [8]. Среднелетальные дозы LD50, LD16, LD84 как основные параметры острой токсичности вводимых соединений определяли методом Литчфильда и Уилкоксона [8, 13]. Концентрация исследуемых соединений: перорально через желудочный зонд – от 100,0 до 2000,0 мкг/мл, внутрибрюшинно инъекционно – от 100,0 до 2000,0 мкг/мл, накожно на участок кожи размером 5х5 см – от 2000,0 до 5000,0 мкг/мл. В качестве контроля использовали растворитель ДМСО и раствор хлорида натрия 0,9%-ный (изотонический) в аналогичных дозах. Всех лабораторных животных, погибших в результате исследования, вскрывали. Животных, выживших по окончании эксперимента, подвергали эвтаназии и проводили их патологоанатомическое вскрытие.
Анализ выполненных экспериментов осуществлялся в четырех последовательностях.
Статистическая обработка результатов. Для проведения статистического анализа полученных данных использовались методы вариационной статистики, достоверность определяли с использованием t-критерия Стьюдента, статистически достоверными считались результаты, отличающиеся от контроля при р≤0,05. Для вычисления основных параметров острой токсичности использовали метод Литчфильда и Уилкоксона [8, 13]. Данные обрабатывали статистически с использованием программы Stat 7.0.
Результаты исследования и их обсуждение. МТТ-тест показал, что в исследуемом интервале концентраций тестерные соединения не обладали способностью оказывать цитотоксическое действие на эукариотические клетки тестерной культуры клеток – линии опухолевых клеток HeLa (ATCC ® CCL-2TM).
Показатели жизнеспособности тестерных клеток аденокарциномы шейки матки человека в присутствии трифторметилпирроло[2,3-h]-хинолинона (2), трифторметил-1Н-индол-6-илоксобутанамид (3), трифторметилпирроло[3,2-h]хинолинона (4) оказались более 70% (табл. 1). Статистически значимого отличия от контроля не наблюдалось.
Показатель выживаемости линии опухолевых клеток HeLa на фоне добавления трифторметилпирроло[2,3-f]хинолинона (1) превышал контрольные цифры, статистически значимого эффекта не наблюдалось, но прослеживалась тенденция к увеличению количества метаболически активных клеток в его присутствии.
Таблица 1
Показатели выживаемости культуры клеток HeLa при культивировании с тестерными соединениями in vitro
|
Тестерное соединение |
Доза тестерного соединения |
Эквивалент жизнеспособных клеток (по отношению к контролю), % |
|
Контроль |
|
100 |
|
1
|
50,0 мкг/мл |
106,2±3,5 |
|
500,0 мкг/мл |
109,5±2,4 |
|
|
1000,0 мкг/мл |
112,2±2,6 |
|
|
2 |
50,0 мкг/мл |
96,1±3,8 |
|
500,0 мкг/мл |
92,5±3,2 |
|
|
1000,0 мкг/мл |
89,2±1,5 |
|
|
3 |
50,0 мкг/мл |
95,7±3,4 |
|
500,0 мкг/мл |
92,2±4,4 |
|
|
1000,0 мкг/мл |
89,3±3,1 |
|
|
4 |
50,0 мкг/мл |
85,1±3,8 |
|
500,0 мкг/мл |
71,2±7,5 |
|
|
1000,0 мкг/мл |
70,4±1,3 |
При внутрибрюшинном введении лабораторным мышам и крысам соединений 1–4 LD50 укладывалась в диапазон 596,0–1753,0 мг/кг (табл. 2).
Перед гибелью животных наблюдалась сходная картина острого токсикоза. Состояние экспериментальных животных перед гибелью через 15–20 мин после введения тестерного соединения: общее состояние – угнетенное, двигательная активность – снижена, дыхательная функция – вначале частое, поверхностное дыхание, затем – глубокое и судорожное. Поведение экспериментальных животных: забиваются в угол, иногда проявляют признаки повышения рефлекторной возбудимости. По мере нарастания интоксикации: тремор и подергивание конечностей, одышка, приступ тонических судорог, боковое положение и гибель животных. Патологоанатомическое вскрытие экспериментальных животных после гибели на фоне применения тестерных соединений: точечные кровоизлияния в тканях сердца и легких, увеличение печени, дряблость почек – неспецифические изменения паренхиматозных органов, характерные для острого токсикоза.
Пероральное введение через желудочный зонд экспериментальным мышам соединений 1–4 демонстрировало LD50 в диапазоне 751,0–1994,0 мг/кг. Гибели лабораторных крыс при внутрижелудочном введении тестерных соединений не наблюдалась, поэтому невозможно было определить показатель средней смертельной дозы.
Таблица 2
Показатели острой токсичности исследуемых соединений in vivo
|
Способ введения, исследуемое животное |
Пол |
Исследуемые показатели |
Исследуемое соединение |
|||
|
Трифторметил-пирроло[2,3-f] хинолинон (1) |
Трифторметил-пирроло[2,3-h]-хинолинон (2) |
Трифторметил-1Н-индол-6-илоксобутанамид (3) |
Трифторметил-пирроло[3,2-h] хинолинон (4) |
|||
|
Внутрибрюшинное введение (мыши) |
Самцы
|
LD50 |
863 (771÷967) |
964 (796÷1166) |
853 (755÷964) |
1753 (1565÷1963) |
|
LD16 |
616 |
716 |
606 |
1306 |
||
|
LD84 |
1042 |
1234 |
1032 |
2032 |
||
|
Самки
|
LD50 |
760 (679÷851) |
859 (709÷1039) |
748 (662÷845) |
1649 (1472÷1847) |
|
|
LD16 |
458 |
658 |
507 |
1247 |
||
|
LD84 |
977 |
1197 |
965 |
1966 |
||
|
Внутрибрюшинное введение (крысы) |
Самцы
|
LD50 |
623 (556÷698) |
721 (605÷857) |
711 (629÷803) |
1511 (1337÷1707) |
|
LD16 |
494 |
565 |
586 |
1013 |
||
|
LD84 |
748 |
899 |
938 |
1838 |
||
|
Самки
|
LD50 |
590 (527÷661) |
690 (580÷800) |
596 (527÷673) |
1380 (1221÷1560) |
|
|
LD16 |
411 |
510 |
393 |
1010 |
||
|
LD84 |
707 |
897 |
887 |
1675 |
||
|
Внутрижелудочное введение (мыши) |
Самцы |
LD50 |
1105 (969÷1259) |
1106 (945÷1294) |
1095 (978÷1226) |
1994 (1780÷2233) |
|
LD16 |
833 |
893 |
821 |
1521 |
||
|
LD84 |
1501 |
1401 |
1397 |
2390 |
||
|
Самки |
LD50 |
1050 (921÷1197) |
1152 (985÷1348) |
1041 (929÷1166) |
2041 (1822÷2286) |
|
|
LD16 |
721 |
821 |
710 |
1610 |
||
|
LD84 |
1391 |
1445 |
1334 |
2334 |
||
|
Внутрижелудочное введение (крысы) |
Самцы |
LD50 |
не определена* |
|||
|
Самки |
LD50 |
не определена* |
||||
|
Накожное нанесение (крысы) |
Самцы |
LD50 |
не определена* |
|||
|
Самки |
LD50 |
не определена* |
||||
Примечание: * LD50 – не определена, так как гибели животных в эксперименте не наблюдалось.
Состояние животных после введения соединений в дозе более 1000,0 мкг/мл: общее состояние – угнетенное, двигательная активность – снижена, реакция на звуковые раздражители – вздрагивание и подпрыгивание на месте, иногда появлялись тремор, одышка. Описанные симптомы наблюдались в течение 30–40 мин и исчезали через 6–12 ч по мере восстановления жизненных функций организма лабораторных животных. Дальнейшее наблюдение в течение последующих суток свидетельствовало о полном восстановлении функций: животные внешне – здоровы, груминг – активный, дыхательная функция – полноценная, количество дыхательных движений в пределах физиологической нормы, потребление корма и воды – активное; физиологические отправления – физиологическая норма; масса животного: первые двое суток – некоторое снижение, затем – физиологическое прибавление в весе. Статистически значимого отличия прибавки в весе лабораторных животных в контрольной и опытных группах не наблюдалось. Патологоанатомическое вскрытие выживших экспериментальных животных после эвтаназии на фоне применения тестерных соединений: отсутствие гиперемии, нарушения целостности слизистой оболочки, макроскопических признаков повреждения желудка. Статистически значимых отличий от животных контрольной группы не выявлено.
Гибели экспериментальных животных, как мышей, так и крыс, при накожном нанесении тестерных препаратов в дозах от 2000,0 до 5000,0 мкг/кг не наблюдалось, поэтому определение LD50 при данном пути введения не представлялось возможным. Патологоанатомическое вскрытие выживших экспериментальных животных после эвтаназии на фоне применения тестерных соединений: видимых изменений в макроскопической картине не выявлено.
Заключение. Цитотоксичность препаратов 1–4, проанализированная с использованием культуры опухолевых клеток HeLa ATCC ® CCL-2TM в МТТ-тесте in vitro, свидетельствует о том, что тестерные соединения не способны оказывать токсическое воздействие на клетки в исследуемом интервале концентраций (50,0–1000,0 мкг/мл). При внутрибрюшинном введении экспериментальным животным (мышам, крысам) соединения 1–4 проявляли свойства умеренно токсичных веществ. Но при других путях введения: внутрижелудочном, перорально через зонд – крысам и накожном – лабораторным мышам и крысам – определение средней смертельной дозы не представлялось возможным в силу объективных причин. Так, в максимально возможной концентрации для данных способов тестерные соединения не вы,зывали гибели экспериментальных животных. Значимых различий по гендерному признаку животных на фоне введения исследуемых соединений не выявлено. Препарат диоксидин, используемый в качестве препарата сравнения в эксперименте по определению противомикробной активности исследуемых соединений [9], является широко известным антимикробным средством, активным в отношении как грамотрицательных, так и грамположительных микроорганизмов [14, 15], но препарат обладает мутагенностью и способен индуцировать антибиотикорезистентность микроорганизмов [16].
Тестируемые концентрации исследуемых соединений 1–4 в тесте Эймса не проявили признаков мутагенности [17]. Учитывая результаты противомикробной активности [9], по совокупности результатов, полученных в настоящем экспериментальном исследовании, изучаемые соединения по классификации токсичности веществ [18] относятся к практически нетоксичным веществам (класс токсичности III–IV). Цель экспериментального исследования достигнута. Безопасное применение исследуемых соединений в качестве противомикробных средств для химиотерапии in vivo возможно. Анализ полученных данных изучения острой токсичности указывает на то, что данные производные, скорее всего, не всасываются при приеме внутрь, так как в результате эксперимента было невозможно установить показатель ЛД50 при введении тестерных соединений 1–4 внутрижелудочно на фоне токсичности, определяемой при внутрибрюшинном инъекционном введении. Возможно, что создание пероральных лекарственных форм с ожиданием накопления необходимых противомикробных концентраций в крови бесперспективно. Но местное применение исследуемых соединений, например для обработки раневых поверхностей, учитывая активность в отношении возбудителей инфекций области хирургического вмешательства [9], заслуживает внимания и определяет необходимость дальнейшего исследования.



