Согласно данным Всемирной организации здравоохранения [1] и статистическим отчетам ведущих стран мира [2, 3], основной причиной смертности во всем мире продолжают оставаться сердечно-сосудистые заболевания. Высокий уровень смертности и низкая прогнозируемая продолжительность жизни, отмеченные для Российской Федерации, обусловлены болезнями системы кровообращения, которые у трудоспособного населения в 3–6 раз выше в сравнении с жителями стран ЕС [4]. При этом опыт экономически развитых стран свидетельствует о возможности снижения смертности от ССЗ в 2 раза и более путем реализации лечебно-профилактических мероприятий [5]. К их числу следует отнести высокоэффективные и безопасные методы, основанные на применении низкоинтенсивного лазерного излучения (НИЛИ). Для более успешного клинического использования лазерной терапии необходимым является научное обоснование механизмов, лежащих в основе взаимодействия когерентного излучения и биологических структур организма.
Цель работы – изучение механизмов воздействия низкоинтенсивного лазерного излучения на метаболическую активность митохондрий лимфоцитов у пациентов с артериальной гипертензией в динамике.
Материалы и методы исследования. Материалом исследования послужила кровь больных с I–II стадией гипертонической болезни, находящихся на лечении в ГБУЗ РКБСМП РСО-А. Средний возраст больных составил 43,2 ± 6,6 года. Диагноз устанавливался в соответствии с критериями Всероссийского научного общества кардиологов от 2009 г. Диагноз выставлялся больным при наличии основного признака – артериальная гипертензия ≥140/90 мм рт. ст. и сопутствующих дополнительных диагностических признаков, способствующих нарушению состояния сосудистого русла: повышение уровня триглицеридов ≥1,7 ммоль/л, снижение уровня холестерина липопротеинов высокой плотности <1,0 ммоль/л у мужчин, <1,2 ммоль/л у женщин; повышение уровня холестерина липопротеинов низкой плотности >3,0 ммоль/л. Схема лечения пациентов включала сочетание стандартной медикаментозной терапии (антигипертензивные препараты) и физиотерапевтических процедур внутривенного лазерного освечивания крови. Длина волны излучения составляла 525 нм, что соответствует зеленому спектру, мощность – 1,5–2,0 мВт, продолжительность воздействия – 10 мин. Курс состоял из 10 сеансов, по 1 ежедневно. Кровь из локтевой вены отбирали дважды: до процедуры лазерного освечивания и через 15 мин после НИЛИ-терапии. Биоэнергетические функции митохондрий оценивали до освечивания крови и после первого, пятого и десятого сеансов. Для контроля эффективности лечения кровь отбирали через 1 месяц и через 6 месяцев после последнего сеанса освечивания. Контрольную группу обследованных составили 28 условно здоровых доноров в возрастных рамках, соответствующих экспериментальным. Забор крови в данной группе осуществляли в период ведения больных.
Мазки крови готовили при помощи аппарата Microscopy Vision (Австрия), предварительно обезжирив стекла смесью Никифорова. Стекла высушивали на воздухе в течение 30 мин. Препараты фиксировали при комнатной температуре забуференным (10 мМ HEPES) 60%-ным раствором ацетона (рН 5,2–5,4) на бидистиллированной воде. После ополаскивания дистиллированной водой мазки высушивали 30 мин.
С целью определения оксигеназной активности митохондрий осуществляли реакцию восстановления нитросинего тетразолия (НСТ) в цитобиохимической среде с использованием добавок янтарной кислоты на фоне основного состава среды инкубации. Основной состав среды инкубации содержал: KCl – 125 мМ, HEPES – 10 мМ, НСТ – 1 мг/мл, рН – 7,2+0,01 [6]. Нами поставлены следующие пробы.
1. Восстановление НСТ за счет эндогенных субстратов (ЭС) – осуществляли в цитобиохимической среде инкубации основного состава (проба ЭС показывает интенсивность восстановления НСТ эндогенными субстратами).
2. Восстановление НСТ в присутствии янтарной кислоты – основная среда инкубации + 5 мМ янтарной кислоты (проба СДГ показывает величину общей активности ключевого дыхательного фермента).
В приготовленную среду опускали готовые мазки. Окрашивание проводили в водяном термостате 1ТЖ-0-03 в течение 1 ч при температуре 37оС.
По окончании инкубации мазки ополаскивали дистиллированной водой и высушивали при комнатной температуре в течение 20 мин. Ядра клеток окрашивали 0,05%-ным раствором водного нейтрального красного в течение 8 мин. После 5–10 с промывания в дистиллированной воде и высушивания на воздухе мазки микроскопировали. Клетки фотографировали и обрабатывали в программе Blood Runner и Bio Images (г. Пущино), используя микроскоп «Микромед-2» (Россия) при увеличении 10 х 100 и цифровую камеру Toup Cam 9.0 MP (Китай).
На каждом мазке пациента анализировали по 100 лимфоцитов, рандомизированно отбираемых из трех зон стекла: начальной, средней и финишной. Интенсивность восстановления НСТ рассчитывали в соответствии с принципом работы программы, основанным на обсчете площадных характеристик клеток и их компартментов, сканирования гранул на разных уровнях плотности, что позволяет выявить интенсивность отложения формазана, вычислить количество образуемого маркера дыхательной активности митохондрий – диформазана. Поскольку для каждой пробы компьютеризированному анализу подлежали от 100–350 до 600–700 (в зависимости от активности дыхательной цепи) окрашенных объектов на 1 лимфоцит, и учитывая, что обсчету подлежат 100 клеток в мазке, можно заключить, что метод обладает высокой статистической достоверностью каждого описываемого параметра (99,9%; при р?0,001) [7]. Рассчитывали среднюю величину (M) и стандартную ошибку среднего (±m). Статистическую обработку результатов осуществляли по критерию Стьюдента в программе Microsoft Excel.
Результаты исследований и их обсуждение
Динамика изменений общей окислительной метаболической активности митохондрий лимфоцитов здоровых доноров и пациентов с АГ в условиях терапии представлена на рисунке 1.
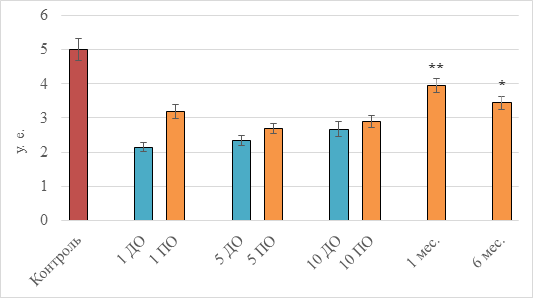
Рис. 1. Результаты изучения воздействия НИЛИ на суммарную дыхательную активность митохондрий у больных с гипертонией
Примечание: 1 ДО, 5 ДО, 10 ДО – 1-й, 5-й и 10-й сеансы до лазерного облучения крови; 1 ПО, 5 ПО, 10 ПО – 1-й, 5-й и 10-й сеансы через 15 мин после процедуры лазерного облучения; 1 и 6 месяцев – соответствующие периоды ремиссии с момента последней процедуры; * – p<0,05; ** – p<0,01 относительно «1 ДО»
Биохимические изменения общей активности дегидрогеназ в клетках обследованных больных гипертонией по сравнению с контрольными показателями изменяются в сторону снижения интенсивности энергетической функции и составляют 42,7% от контроля. Через 15 мин после первого сеанса НИЛИ общая активность пула дегидрогеназ возросла на 49% относительно значений, отмеченных до начала процедуры. Важно подчеркнуть, что каждая процедура ВЛОК сопровождается активацией метаболической активности митохондрий, максимальная степень которой выражена в первый сеанс (отмеченные выше 49%), и сохраняется на уровне 8–15% в течение последующих освечиваний. При этом общая энергопродукция клеток постоянно повышается и достигает наивысшего значения через 1 месяц после проведенного десятидневного курса терапии. К этому времени исходный базовый уровень оксигеназной активности митохондрий оказывается повышенным на 84%. Выявленный эффект носит длительный характер, и по истечении полугода значения суммарной дыхательной активности клеток превышают таковые до начала проведения внутрисосудистого освечивания на 60%. Тем не менее, как видно из графика, достичь значений, характерных для условно здоровых доноров, одним курсом (10 процедур) лазерной терапии не удается. Разница между экстремумом для пролеченных пациентов и величиной, характеризующей уровень активности здоровых людей, составляет 21%, что на фоне исходной разницы в 57% свидетельствует о выраженном корригирующем действии когерентного излучения, направленном на восполнение дефицита энергии в организме.
Более детальное изучение молекулярных механизмов выявленного модифицирующего действия электромагнитного излучения видимой части спектра на энергопродукцию клетки представлено на рисунке 2.
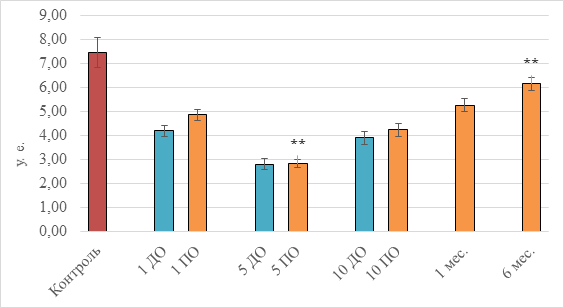
Рис. 2. Изменение активности сукцинатдегидрогеназы у больных АГ в процессе лазерной терапии и на стадии ремиссии заболевания (обозначения см. рис. 1)
Из рисунка 2 видно, что первый сеанс освечивания является самым эффективным и приводит к повышению активности ключевого фермента дыхания (СДГ) на 15%. Последующие процедуры – пятая и десятая – также активируют деятельность дыхательного комплекса II на 0,7% и 9% соответственно относительно значений, полученных до начала НИЛИ. Эффект лазерной реактивации сукцинат-убихинон-оксидоредуктазы сохраняется длительно и после окончания терапевтического курса: через 1 месяц активность СДГ превышает исходные базовые показатели на 25%, через полгода – на 46%. При этом, как и в случае общей оксигеназной реактивации, уровень значений условно здоровых доноров не достигается. Если сравнивать исходное расхождение в активности (контроль и 1 ДО), равное 44%, и полученное значение по истечении полугода (контроль и 6 месяцев), равное 17%, то становится очевидным один из механизмов терапевтического действия лазерного облучения крови: увеличение скорости катаболизма в цикле трикарбоновых кислот митохондрий и, как следствие, продукции макроэргических соединений.
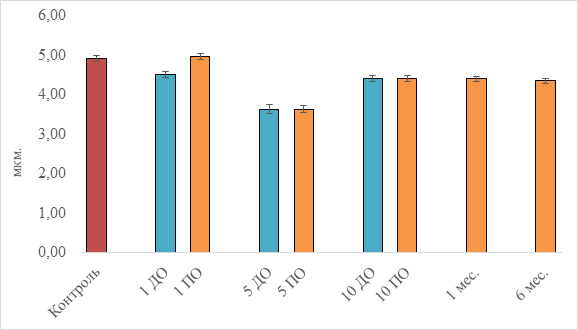
Рис. 3. Радиус лимфоцитов (обозначения см. рис. 1)
Из рисунка видно, что среднестатистическое распределение лимфоцитов (без их разделения на субпопуляции: малые, средние и большие) по линейным размерам для здоровых и больных достоверно не различается и находится в пределах физиологической нормы: 4,91±0,08 мкм контрольная группа и 4,50±0,07 мкм для пациентов до лечения. Проведение первого сеанса освечивания крови сопровождается увеличением радиуса клеток на 10%. К пятому сеансу терапии отмечается общее изменение качественного состава основных клеток иммунной системы в сторону преобладания малых лимфоцитов в общем количестве их совокупной популяции. Визуально регистрируемого воздействия когерентного излучения на состав пула клеток не выявлено: средние размеры клеток (радиус) в обеих сравниваемых группах (5 ДО и 5 ПО) остаются неизменными и составляют 3,63±0,10 мкм. К десятому сеансу достигается стабилизация неоднородной группы клеток лимфоидного ряда, их средний радиус сохраняется в пределах 4,35–4,41 мкм.
В научной литературе приводятся результаты исследований лазерного излучения различных диапазонов на общую дыхательную активность митохондрий, выделенных из различных источников (печени, мышечной ткани). Так, в работе [8] авторы отмечают, что после использования низкоинтенсивной лазерной терапии возрастает мышечная производительность в условиях эксперимента (крысы) и клинических испытаний. Согласно результатам исследований, эффект достигается за счет увеличения мембранного потенциала митохондрий и повышения выработки АТФ. В этом аспекте выявленная в данной работе активация митохондрий в условиях in situ у пациентов с АГ находится в полном согласии с данными литературы. В работе [9] авторы отмечают, что лазерное излучение зеленой части спектра при длине волны 532 нм является более эффективным по сравнению с красным, имеющим длину волны 650 нм. Облучение выделенных из печени крыс органелл в условиях in vitro зеленым лазерным светом способствует более чем двукратному повышению респираторной активности митохондрий, измеряемой оксиграфом.
Применение в нашей работе НИЛИ с длиной волны 525 нм сопровождалось закономерным повышением общей оксигеназной активности митохондрий, оцениваемой ростом маркера дыхательной активности – диформазаном. Согласно результатам проведенных исследований, одной из основных мишеней для непосредственного воздействия квантов света выступает ключевой фермент, участвующий одновременно в цикле трикарбоновых кислот и являющийся переносчиком электронов в дыхательной цепи митохондрий, – сукцинатдегидрогеназа. Зафиксированные паттерны повышенной дыхательной активности после сеансов освечивания свидетельствуют о возможности терапевтического воздействия лазерного излучения на клетки и системы организма.
Увеличение радиуса лимфоцитов, наблюдаемое после первого сеанса НИЛИ, также может быть связано с изменением энергопродукции/энергопотребления в клетках, изменением проницаемости мембран [10]. Так, авторы работы [11] отмечают, что в условиях велоэргометрии при повышенных нагрузках (70% VO2max в течение 90 мин) уже в первые 15 мин происходит изменение клеточного состава лимфоцитов, который затем стабилизировался и оставался на протяжении всего остального времени тестирования постоянным. Данное обстоятельство может свидетельствовать о глубоких качественных перестройках в организме, которые наиболее явственно проявляются во время первого сеанса лазерной терапии.
Заключение
Результаты проведенных клинико-диагностических исследований больных с артериальной гипертензией свидетельствуют о направленности воздействия лазерного облучения на нормализацию клеточного дыхания и компенсацию энергетического дефицита, сопровождающего патологический процесс. Терапевтическое воздействие низкоинтенсивного лазерного излучения с длиной волны 525 нм приводит к достоверному повышению общей оксигеназной активности митохондрий лимфоцитов и способствует таргетной активации ключевого фермента дыхательной цепи – сукцинатдегидрогеназы.
Высокая информативность, быстрота проведения и возможность оценки метаболической активности митохондрий ex tempore в условиях in situ позволяют рекомендовать цитобиохимический метод к использованию в клинической практике для повышения эффективности лазерной терапии, научного обоснования объемов лечебных процедур и периода ремиссии заболевания. Применение классической схемы, включающей 10 процедур по 10 мин, обеспечивает достоверное значимое повышение энергопродукции и сохранение энергетического баланса клеток на временной отрезок не менее 6 месяцев.



