За последнее десятилетие использование адоптивной иммунотерапии стало многообещающим методом лечения широкого спектра злокачественных новообразований, в частности рака молочной железы (РМЖ) [1, 2]. Современные иммунотерапевтические подходы для лечения РМЖ основаны на способности иммунной системы устранять опухолевые клетки, оставляя при этом здоровые ткани нетронутыми [3]. Одним из таких современных методов лечения является иммунотерапия на основе цитокинов. Цитокины как белки иммунной системы способны модулировать иммунный ответ хозяина и напрямую вызывать гибель опухолевых клеток, поэтому некоторые из цитокиновых препаратов применяют в качестве иммунотерапии при ряде заболеваний, а также в качестве адъювантов при вакцинации. Однако монотерапия низкими дозами цитокинов не дает значимых терапевтических результатов, а лечение высокими дозами приводит к ряду побочных эффектов, в связи с чем возникает вопрос об оптимизации доз и комбинаций цитокинов. Поэтому необходимо исследовать влияние цитокинов на иммунные клетки, которые участвуют в механизмах регуляции про- и противоопухолевого иммунного ответа [4].
Согласно данным современных исследований цитокины влияют на развитие, дифференцировку и гомеостаз лимфоцитов. Цитокины I типа (IL-2, IL-7 и IL-15) имеют общую γ-цепь (γ-chain) рецепторов и разнонаправленно действуют на процессы, связанные с жизнеспособностью, активацией и клональной экспансией лимфоцитов, а также с развитием и поддержанием клеток памяти [5]. Несмотря на плейотропность цитокинов и сходство в сигнальных путях, γс-цитокины способны проявлять различное действие на разные субпопуляции Т-клеток: IL-2 играет основную роль в развитии и поддержании регуляторных Т-клеток [6], IL-7 опосредует гомеостаз наивных CD4 + и CD8 + Т-клеток и клеток памяти, а IL-15 стимулирует пролиферацию и цитотоксические функции CD8+ T-клеток и NK-клеток, что приводит к усилению противоопухолевого ответа [7]. Пути передачи сигналов IL-2, IL-7 и IL-15 рассматриваются в литературе в качестве мишеней иммунотерапевтических стратегий [8].
Для успешной адоптивной иммунотерапии необходимо добиться адекватного количества и качества лимфоцитов. Первое обусловлено возможностью их экспансии in vitro, второе – преимущественной стимуляцией цитотоксических субпопуляций, таких как NK-клетки CD8+ Т-лимфоциты.
Ранее в проведенном нами исследовании влияния IL-2, IL-7, IL-15 и их комбинаций на пролиферацию натуральных киллеров, сепарированных из крови больных раком молочной железы, максимальная стимуляция in vitro была зафиксирована в пробах с внесенным IL-15 и комбинациями γс-цитокинов, включающих его.
Целью настоящего исследования была оценка комбинированного воздействия цитокинов (IL-2, IL-7, IL-15) на пролиферацию лимфоцитов в условиях in vitro у пациентов с диагнозом «рак молочной железы».
Материалы и методы исследования. Работа была одобрена этическим комитетом НМИЦ онкологии Минздрава России, протокол № 33/1 от 29.11.2018 г. Пациенты подписывали информированное согласие о принятии участия в исследовании.
В качестве материала для исследования использовали мононуклеарные клетки (МНК) периферической венозной крови от 10 больных местно-распространенным раком молочной железы I–III стадии. Забор крови осуществляли из локтевой вены в объеме 32 мл в пробирки для выделения МНК (BD Vacutainer® CPT™, США). Полученные клетки культивировали в равной посевной дозе по 500 тыс. клеток/мл в 6-луночных планшетах (Biofil, Китай) в питательной среде RPMI 1640 (Gibco, США) с добавлением 10% телячьей эмбриональной сыворотки (HyClone, США) при 37°С, во влажной атмосфере, содержащей 5% СO2. Жизнеспособность клеток оценивали с помощью анализатора (Eve, NanoEnTekInc, Корея).
Экспансию лимфоцитов проводили с использованием буфера в концентрации 10 мкг/мл, содержащего анти-биотиновые магнитные частицы MACSiBead и антитела к CD2, CD3 и CD28 (MiltenyiBiotec, Германия), в соответствии с протоколом производителя.
Индукцию пролиферации лимфоцитов выполняли на 4-е, 8-е и 12-е сутки внесением рекомбинантных цитокинов – IL-2, IL-7, IL-15 (MiltenyiBiotec, Германия) и их комбинаций. Отрицательным контролем являлись пробы лимфоцитов после экспансии in vitro без внесения цитокинов. Цитокины вносили в концентрации 40 нг/мл каждый в следующих вариантах: IL-2; IL-2/IL-15; IL-2/IL-15/IL-7; IL-15; IL-15/IL-7. Планшеты с клеточной суспензией культивировали при 37°C в среде с содержанием CO2 в течение 15 суток. В каждой пробе ежедневно оценивали жизнеспособность клеток в суспензии на анализаторе (Eve, NanoEnTekInc, Корея), а также морфологию с помощью инвертированного микроскопа (AxioImagerA.2 Zeiss, Германия).
Оценку статистической достоверности различий в показателях между группами определяли по t-критерию Стьюдента. Данные выражали как средние значения ± ошибка среднего (M±m). Количество клеток в первые сутки культивирования соответствовало посевной дозе и принималось за 100%.
Результаты исследования и их обсуждение
Результаты нашего исследования показали, что во всех пробах после проведенной экспансии прирост клеток и его спад происходили равномерно вплоть до 11-х суток сокультивирования. В опытных образцах с цитокинами количество жизнеспособных клеток продолжало увеличиваться, а в контроле неизменно снижалось.
Полученные данные на 11-е сутки инкубации показали статистически достоверные различия в пробах с добавлением комбинации интерлейкинов IL-7 и IL-15 по сравнению с контролем в 1,5 раза (p<0,05). На 12-е сутки сокультивирования доля лимфоцитов в пробах с добавлением только IL-15 и комбинации IL-7/IL-15 была выше в 1,47 и 1,6 раза соответственно по сравнению с контролем (p<0,05).
После окончания срока культивирования (15 суток) все опытные пробы статистически достоверно превышали контроль (292%), а именно присутствие IL-2 (658%) приводило к увеличению количества жизнеспособных клеток в 2,25 раза, добавление комбинации IL-2/IL-15 (680%) – в 2,33 раза, комбинации цитокинов IL-2/IL-7/IL-15 (704%) – в 2,4 раза, действие IL-15 (824%) и комбинации ИЛ-7/15 (838%) – в 2,9 раза (p<0,05). Результаты количественного состава лимфоцитов с добавлением различных комбинаций цитокинов представлены в таблице 1.
Таблица 1
Количественный состав лимфоцитов на фоне экспансии в условиях культивирования с IL-2, IL-7, IL-15 in vitro (%)
|
Проба |
Прирост лимфоцитов в период культивирования (%) |
|||||||||
|
2 сут. |
3 сут. |
4 сут. |
5 сут. |
8 сут. |
9 сут. |
10 сут. |
11 сут. |
12 сут. |
15 сут. |
|
|
Контроль |
169± 32,3 |
214± 37,7 |
193± 37,1 |
360± 93,3 |
471± 91,5 |
551± 77,5 |
433± 71,5 |
524± 71,9 |
476± 60,9 |
292± 59,2 |
|
IL-2 |
165± 36,8 |
217± 44,9 |
178± 35,9 |
296± 73,8 |
412± 98,4 |
501± 95,2 |
368± 65,8 |
608± 52,9 |
658± 76,1 |
658± 61,3* |
|
IL-2/15 |
176± 43,5 |
232± 44,0 |
192± 36,4 |
294± 69,5 |
497± 88,1 |
552± 94,4 |
438± 73,1 |
706± 72,8 |
664± 97,9 |
680± 58,1* |
|
IL-2/7/15 |
144± 31,7 |
241± 44,6 |
181± 36,1 |
292± 75,9 |
420± 74,5 |
477± 86,2 |
413± 60,8 |
644± 70,3 |
632± 66,1 |
704± 47,5* |
|
IL-15 |
170± 38,8 |
220± 50,9 |
165± 29,7 |
318± 82,1 |
530± 76,4 |
509± 89,5 |
460± 79,7 |
674± 61,5 |
702± 72,6* |
824± 66,3* |
|
IL-7/15 |
178± 37,0 |
270± 66,3 |
196± 44,9 |
342± 92,5 |
470± 85,7 |
526± 89,6 |
466± 83,1 |
778± 72,2* |
756± 99,3* |
838± 94,6* |
* – статистически достоверные различия с контролем (p<0,05). Количество клеток в первые сутки культивирования соответствовало посевной дозе и принималось за 100%.
Добавление в среду культивирования IL-15 значительно увеличивало прирост лимфоцитов по сравнению с другими пробами. Действие только IL-2 на прирост лимфоцитов было менее выраженным по сравнению с пробами, в которых присутствовали IL-15 и IL-7.
Важно отметить, что на 3-и сутки культивирования наблюдали активный рост количества лимфоцитов, а уже на 4-е сутки во всех пробах было отмечено резкое снижение числа жизнеспособных клеток. Эти данные позволяют предположить, что добавление цитокинов на 3-и сутки культивирования в фазу экспоненциального роста клеток может положительно повлиять на уровень дальнейшего прироста биоматериала.
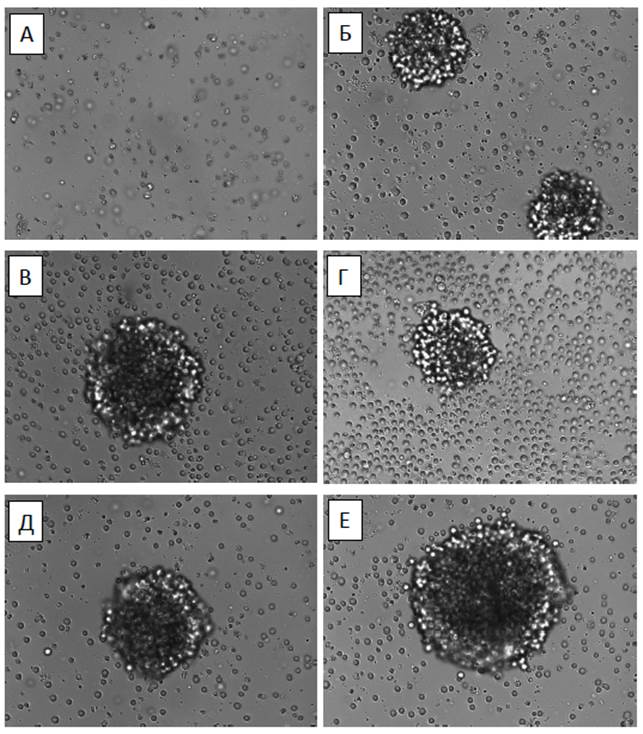
Рис. 1. Культивирование лимфоцитов после экспансии с цитокинами IL-2, IL-7, IL-15, 11 суток. А – контроль, Б – IL-2, В – IL-2/ IL-15, Г – IL-7/IL-15, Д – IL-2/IL-7/IL-15, Е – IL-15
На протяжении всего срока культивирования было зафиксировано образование клеточных конгломератов в пробах с добавлением γс-цитокинов (рис. 1). Клеточные конгломераты имели сферическую форму и различались размером в зависимости от вносимых в пробу цитокинов. Так, наименьшие размеры конгломератов были отмечены в образцах только с IL-2 (диаметр 93,2±6,1 мкм) и смесью IL-7/IL-15 (диаметр 87,4±5,9 мкм). Незначительные различия в размере клеточных структур наблюдали в образцах с IL-2/IL-15 (диаметр 107,4±8,7 мкм) и IL-2/IL-7/IL-15 (диаметр 118,1±6,3 мкм). Максимальных размеров достигали конгломераты из лимфоцитов в пробах только с IL-15 (диаметр 147,3±7,1 мкм). В применяемом нами протоколе экспансии (Miltenyi Biotec, Германия) указана возможность образования клеточных конгломератов. Интересным является отсутствие подобных структур в контрольном образце без добавления цитокинов, который также подвергался указанному протоколу экспансии. Возможно, присутствие цитокинов стимулировало клоногенность лимфоцитов. Однако не стоит исключать вынужденную агрегацию клеток ввиду высокой клеточной плотности, вызванной стимуляцией пролиферации лимфоцитов в опытных пробах с цитокинами.
Цитокины являются решающими факторами развития иммунных клеток in vivo и необходимы для генерации активированных лимфоцитов ex vivo. Интерлейкины I типа из γс-семейства IL-2, IL-7, IL-15 играют важную роль в экспансии и пролиферативной активности лимфоцитов, а также являются регуляторами различных типов иммунных клеток, включая CD4+ Т-хелперы [9].
IL-2 представляет собой секретируемый цитокин и связывает заранее сформированные гетеротримерные рецепторы на поверхности активированных клеток. В исследовании in vitro было выявлено, что при определенном пороге концентрации IL-2 осуществляется реализация апоптоз-индуцирующего действия этого цитокина на лимфоциты крови [10]. В качестве одной из причин слабо выраженной пролиферации лимфоцитов в пробах с IL-2 в литературе рассматривается нарушение баланса системы IL-2/IL-7, функциями которой являются как подавление, так и активация Т-клеточного ответа для регуляции равновесия между иммунитетом и толерантностью [11]. Вместе с тем по данным литературной периодики IL-2 способствует активации Т-лимфоцитов CD8+ и является фактором роста Т-лимфоцитов CD4+, а также натуральных киллеров (NK). IL-2 также используется в качестве адъюванта при лечении пациентов с меланомой, прогрессирующим колоректальным раком или раком яичников аутологичными дендритными клетками, стимулируемыми аутологичным опухолевым лизатом. По данным клинических исследований добавление IL2 в схему лечения способно повысить эффективность терапии за счет индукции экспансии опухолевого антигена, представленного Т-клетками [12].
Впервые IL-7 был определен как фактор роста, ответственный за стимулирование пролиферации предшественников В-клеток мыши в системе долговременного культивирования костного мозга. Тем не менее позже были представлены результаты исследований, которые свидетельствуют, что IL-7 также содействует развитию лимфоцитов и регулирует популяции периферических Т-клеток [9]. IL-7, сформировав высокоаффинный связывающий комплекс, передает сигналы через Jak1 / Jak3 / STAT5 и пути передачи сигналов PI3K-AKT [13]. Эти пути являются общими с IL-2, несмотря на то, что каждый цитокин имеет свои особенности в регуляции различных клеток иммунной системы [11].
IL-15 в основном связан с мембраной и индуцирует передачу сигналов при межклеточном контакте в иммунологическом синапсе. Перспективность применения IL-15 связана с описанными у него свойствами стимулировать пролиферацию и цитотоксические функции CD8+ T-клеток и NK-клеток, что приводит к усилению противоопухолевого ответа [14, 15]. Кроме того, было установлено, что IL-2, IL-17, IL-15 играют важную роль в пролиферации и жизнеспособности периферических Т-клеток, повышая регуляцию PD-1 и PD-L1 на очищенных Т-клетках in vitro. Этот эффект был наиболее выраженным на Т-клетках памяти. При этом эти цитокины косвенно индуцировали экспрессию PD-L1 и PD-L2 на моноцитах/макрофагах в МНК [6]. Если подобное действие будет отмечено на опухолевых клетках, это позволит повысить их чувствительность к иммунотерапии ингибиторами контрольных точек. В современной клинической практике IL-15 активно используется для активации и размножения NK-клеток, которые затем трансплантируются пациентам с лейкемией или солидными опухолями, а также для стимулирования пролиферации Т-клеток химерного антигенного рецептора (CAR) в сочетании с IL2. В недавнем клиническом испытании клетки анти-CD19 CAR-NK, кодирующие ген человеческого IL15, использовали для лечения пациентов с рецидивирующим или рефрактерным CD19-положительным раком. Большинство пациентов ответили на лечение клетками CAR-NK без развития серьезных токсических эффектов [4].
Заключение
Невзирая на обширные исследования в области адоптивной иммунотерапии, результаты об участии γс-цитокинов I типа (IL-2, IL-7 и IL-15) в процессе регуляции выживаемости и пролиферации лимфоцитов пока не нашли выхода в клиническую практику.
Нами получена экспансия in vitro лимфоцитов больных раком молочной железы, наиболее ранняя и наиболее выраженная при использовании IL-7/IL-15 и одного IL-15. Несмотря на анализ только культурального этапа, полученные данные могут иметь значение для оценки возможности применения γc-цитокинов в лечении пациентов с диагнозом «рак молочной железы».



