На данный момент можно наблюдать существенное увеличение количества операций эндопротезирования тазобедренного сустава и наличия молодых пациентов трудоспособного возраста, для которых скорейшая реабилитация и возврат к обычной жизни являются важными компонентами лечения [1].
При выполнении операции у пациентов данной возрастной категории особенное внимание следует уделять бережному отношению к мягкотканым структурам, окружающим тазобедренный сустав, в особенности средней ягодичной мышце. Ее повреждение может привести к стойкому болевому синдрому и возникновению хромоты в послеоперационном периоде [2, 3]. Это заставляет задуматься о применении малотравматичных доступов, так как пациенты данной возрастной группы неизбежно столкнутся с операцией ревизионного эндопротезирования и повторным повреждением мягкотканых структур [4]. Однако на настоящий момент одним из наиболее популярных доступов, используемых как для первичного, так и для ревизионного эндопротезирования, является прямой латеральный доступа Хардинга – около 42% ортопедов используют его в своей практике [5]. Данный доступ обеспечивает отличный обзор вертлужной впадины и проксимального отдела бедра, но наносит существенный ущерб передней порции средней ягодичной мышце – так, частота ее жирового перерождения при первичной артропластике может достигать 20%, по данным Howell et all. [6]. При ревизионном эндопротезировании стоит учитывать, что ее повторное повреждение может привести к жировой дегенерации почти 70% передней и 40% центральной порции после выполнения двух и более вмешательств [7].
В отличие от стандартных доступов, мини-инвазивные методики позволяют сохранить целостность анатомических структур, окружающих тазобедренный сустав, а также связаны с меньшей травматичностью. В то же время большинство исследований изучают травматизацию мягкотканых структур только при первичном эндопротезировании тазобедренного сустава (путем анализа биохимических маркеров тканевой травматизации), исключая ревизионное, что и послужило причиной выполнения нашего собственного исследования.
Цель исследования: провести лабораторные исследования уровня содержания маркеров тканевой травматизации в зависимости от вида использованного хирургического доступа у пациентов при ревизионном эндопротезировании тазобедренного сустава.
Материалы и методы исследования
В исследование вошли 56 пациентов, средний возраст которых составил 56 (±10,65) лет, из них 22 мужчины и 34 женщины.
Пациенты были разделены на 3 группы по типу используемого доступа – мини-инвазивного переднелатерального доступа (МПЛД) (n=11), стандартного прямого латерального доступа (СПЛД) (n=33) и стандартного заднего доступа (СЗД) (n=12). Распределение пациентов по группам в зависимости от возраста и индекса массы тела (ИМТ) представлено в таблице 1.
Таблица 1
Распределение пациентов в зависимости от возраста и ИМТ
|
Параметры |
МПЛД |
СПЛД |
СЗД |
|
Возраст (лет) |
65,6(±7,7) |
63,3(±11,3) |
58(±11,8) |
|
ИМТ (кг/м2) |
30,7(±6,8) |
29,43(±13,4) |
27,9(±2,97) |
Критерием включения в исследование был сохранный проксимальный отдел бедренной кости с сохранными стенками и крышей вертлужной впадины. У пациентов в анамнезе было только одно вмешательство на оперированном суставе – операция первичной артропластики, т.е. предстоящая ревизионная операция была второй. Критерием исключения было наличие ревматоидного артрита у исследуемых пациентов.
Был проведен сравнительный анализ травматичности мягких тканей между группами путем измерения содержания следующих маркеров тканевой травматизации – креатининфосфаткиназы (ЛДГ), лактатдегидрогеназы (ЛДГ), аспартатаминотрансферазы (АСТ), креатинина (КРЕ), с-реактивного белка (срб). В историях болезни всех пациентов, включенных в исследование, проанализированы данные протоколов операций (оценивались длительность вмешательства и величина интраоперационной кровопотери), также учтены трудности, возникающие во время операции, и интраоперационные осложнения. В таблице 2 перечислены операции, которые проводились пациентам в соответствующих группах: замена только вертлужного компонента (замена ВК), замена только бедренного компонента (замена БК), замена вертлужного и бедренных компонентов (замена ВБК), замена полиэтиленового вкладыша (замена ПЭВК).
Таблица 2
Замена компонентов в зависимости от типа доступов
|
Диагноз |
МПЛД n=11 (19,64%) |
СПЛД n=33 (58,93%) |
СЗД n=12 (21,43%) |
Всего n=56 (100%) |
|
Замена ВК |
4 7,14% |
7 12,50% |
4 7,14% |
15 26,79% |
|
Замена БК |
1 1,79% |
7 12,50% |
1 1,79% |
9 16,07% |
|
Замена ВБК |
3 5,36% |
7 12,50% |
6 10,71% |
16 28,57% |
|
Замена ПЭВК |
3 5,36% |
12 21,43% |
1 1,79% |
16 28,57% |
Уровень маркеров тканевой травматизации оценивался до операции и на 3-й, 5-й, 7-й дни после вмешательства.
Для наилучшего отражения динамики изменения после операции расчет уровня показателя в послеоперационном периоде проводился по формуле:
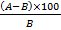 , где А – уровень показателя в анализируемый день после операции, B – уровень показателя до операции. Данная формула позволяла получить величину изменения показателя в процентах по сравнению с его исходным уровнем до операции.
, где А – уровень показателя в анализируемый день после операции, B – уровень показателя до операции. Данная формула позволяла получить величину изменения показателя в процентах по сравнению с его исходным уровнем до операции.
Для выполнения статистического анализа использовались методы прикладной статистики в программе Statictica 10. Так как большая часть полученных данных была распределена ненормально, то для их обработки применялись методы непараметрической статистики, а количественные данные выражались с помощью использования медианы (МЕ) и квартилей (Q1-Q3). Для сравнения количественных данных при наличии двух независимых выборок использовали критерий Манна–Уитни (Mann–Whitney), если же количество выборок было три и выше, то применяли критерий Краскела–Уоллиса (Kruskal–Wallis). Для поиска и оценки корреляционной связи использовался критерий ранговой корреляции Спирмена, подходящий для обработки данных, распределенных ненормально.
Результаты исследования и их обсуждение
Все вмешательства выполнялись опытными хирургами, использующими исследуемые доступы в своей обычной практике как при первичном, так и при ревизионном эндопротезировании. Использовались эндопротезы гибридной (74, 61,7%) и бесцементной фиксации (46, 38,3%) компонентов. Не было обнаружено инфекционных осложнений, тромбоэмболии и тромбоза, т.е. все проанализированные операции не были связаны с общехирургическими ранними послеоперационными осложнениями.
Во время изучения соотношения длительности операции и интраоперационной кровопотери была найдена корреляционная связь средней силы – Spearman R=0,56 (p<0,001). Корреляции между ИМТ и длительностью операции обнаружено не было (p=0,23), как и между ИМТ и интраоперационной кровопотерей (p=0,409). В результате анализа разницы в длительности выполнения ревизионного эндопротезирования была определена статистически значимая разница между изучаемыми подгруппами – выполнение операции с использованием стандартного заднего доступа заняло больше времени (p=0,0002), а кровопотеря при этом доступе оказалась максимальной (p=0,0054) (табл. 3).
Таблица 3
Длительность операции и объем кровопотери в исследуемых подгруппах
|
|
МПЛД |
СПЛД |
СЗД |
p= |
|
ME (Q1–Q3) |
ME (Q1–Q3) |
ME (Q1–Q3) |
||
|
Длительность операции (мин) |
75 (Q1–Q3: 60–85) |
87 (Q1–Q3: 65–115) |
130 (Q1–Q3: 117–170) |
p=0,0002 |
|
Объем кровопотери (мл) |
200 (Q1–Q3: 120–250) |
250 (Q1–Q3: 175-400) |
575 (Q1–Q3: 300–925) |
p=0,0054 |
Далее длительность операции и интраоперационная кровопотеря изучались в зависимости от типа удаляемого компонента – только бедренный, только вертлужный, бедренный и вертлужный, а также те вмешательства, когда производилась только замена полиэтиленового вкладыша. Была обнаружена статистически значимая разница между типами удаляемого компонента: операция по замене полиэтиленового вкладыша ожидаемо протекала заметно быстрее, чем удаление вертлужного и бедренных компонентов (табл. 4).
Таблица 4
Длительность операции и интраоперационная кровопотеря в зависимости от типа удаляемого компонента
|
Замена ПЭВК |
Замена ВБК |
Замена ВК |
Замена БК |
p= |
|
|
ME (Q1–Q3) |
ME (Q1–Q3) |
ME (Q1–Q3) |
ME (Q1–Q3) |
||
|
Длительность операции (мин) |
75 (Q1–Q3: 58–92) |
122,5 (Q1–Q3: 95–162) |
100 (Q1–Q3: 65–120) |
100 (Q1–Q3: 80–115) |
p=0,0069 |
|
Кровопотеря (мл) |
150 (Q1–Q3 100–250) |
400 (Q1–Q3: 325–675) |
225 (Q1–Q3: 150–600) |
200 (Q1–Q3: 200–300) |
p=0,001 |
Болевой синдром пациентов измерялся на 1-е, 2-е, 3-и, 4-е, 5-е сутки после операции с помощью визуально-аналоговой шкалы (ВАШ). В раннем послеоперационном периоде данные ВАШ постепенно снижались, и была обнаружена статистически значимая разница между стандартными доступами и малоинвазивным переднелатеральным доступом – пациенты, прооперированные с помощью МПЛД, отмечали меньший болевой синдром, кроме результатов на 5-й день после вмешательства (табл. 5).
Таблица 5
Уровень интенсивности болевого синдрома у пациентов, перенесших ревизионное эндопротезирование тазобедренного сустава
|
МПЛД |
СПЛД |
СЗД |
p |
|
|
ME (Q1–Q3) |
ME (Q1–Q3) |
ME (Q1–Q3) |
||
|
ВАШ д/о |
5,5 (Q1–Q3: 4–6) |
5 (Q1–Q3: 4–6) |
5 (Q1–Q3: 4–6) |
p=0,9402 |
|
ВАШ на 1-й день п/о |
5 (Q1–Q3: 4–6) |
7 (Q1–Q3: 6–8) |
7 (Q1–Q3: 6–8) |
p=0,0278 |
|
ВАШ на 2-й день п/о |
4 (Q1–Q3: 3–5) |
6 (Q1–Q3: 5–7) |
6,5 (Q1–Q3: 5,5–7) |
p=0,0042 |
|
ВАШ на 3-й день п/о |
3 (Q1–Q3: 2–5) |
5 (Q1–Q3: 4–6) |
6 (Q1–Q3: 5–6,5) |
p=0,0021 |
|
ВАШ на 4-й день п/о |
3 (Q1–Q3: 2–4) |
4 (Q1–Q3: 3–6) |
5,5 (Q1–Q3: 4,5–6) |
p=0,0023 |
|
ВАШ на 5-й день п/о |
3 (Q1–Q3: 2–4) |
4 (Q1–Q3: 3–5) |
4 (Q1–Q3: 3,5–5) |
p=0,0350 |
При оценивании динамики роста таких биохимических маркеров тканевой травматизации, как КФК, ЛДГ, АСТ, креатинин, в послеоперационном периоде не было обнаружено статистически значимой разницы между группами исследуемых доступов на 3-й, 5-й, 7-й дни после операции (табл. 6).
Таблица 6
Динамика роста КФК, ЛДГ, АСТ, КРЕ в послеоперационном периоде
|
|
МПЛД |
СПЛД |
СЗД |
p |
|
|
ME (Q1–Q3) |
ME (Q1–Q3) |
ME (Q1–Q3) |
|||
|
КФК |
3-й день п/о, % |
1131,63 (Q1–Q3: 163,8–1871,91) |
1112,39 (Q1–Q3: 300–1534,5) |
877,87 (Q1–Q3: 428–1233,91) |
p=0,95 |
|
5-й день п/о, % |
484,27 (Q1–Q3: 100–681,46) |
577,45 (Q1–Q3: 108,8–1025,9) |
480,99 (Q1–Q3: 174,01–741,78) |
p=0,8 |
|
|
7-й день п/о, % |
245,29 (Q1–Q3: –46,84–431,46) |
233,61 (Q1–Q3: –10,08–305,88) |
192,43 (Q1–Q3: 24,5–271,15) |
p=0,82 |
|
|
ЛДГ |
3-й день п/о, % |
7,80 (Q1–Q3: 4,41–56,65) |
15,73 (Q1–Q3: 6,82–36,31) |
5,11 (Q1–Q3: 0,52–23,89) |
p=0,278 |
|
5-й день п/о, % |
19,15 (Q1–Q3: 7,05–43,1) |
22,35 (Q1–Q3: 13,61–44,15) |
21,04 (Q1–Q3: 9,5–32,77) |
p=0,342 |
|
|
7-й день п/о, % |
28,00 (Q1–Q3: –5,74–53,62) |
35,43 (Q1–Q3: 19,66–53,33) |
35,86 (Q1–Q3: 22,42–55,7) |
p=0,796 |
|
|
АСТ |
3-й день п/о,% |
103,67 (Q1–Q3: 16,67–273,36) |
116,28 (Q1–Q3: 38,52–189,25 |
97,98 (Q1–Q3: 32,9–155,56) |
p=0,93 |
|
5-й день п/о, % |
57,62 (Q1–Q3: 8,57–185,31) |
106,58 (Q1–Q3: 37,5–201,94) |
68,14 (Q1–Q3: 16,47–122,69) |
p=0,226 |
|
|
7-й день п/о, % |
22,86 (Q1–Q3: 8,07–74,67) |
48,19 (Q1–Q3: 13,07–176,28) |
54,01 (Q1–Q3: 21,39–92,77) |
p=0,368 |
|
|
КРЕ |
3-й день п/о, % |
–5,45 (Q1–Q3: –7,8–8,64) |
–2,94 (Q1–Q3: –15,58–4,23) |
–1,06 (Q1–Q3: –10,8–7,19) |
p=0,775 |
|
5-й день п/о, % |
–11,70 (Q1–Q3: –12–(–4,69)) |
–8,06 (Q1–Q3: –12,7–0) |
–9,01 (Q1–Q3: –12,5–(–3,12)) |
p=0,7410 |
|
|
7-й день п/о, % |
–5,32 (Q1–Q3: –7,2–1,24) |
–6,00 (Q1–Q3: –12,28–0,33) |
–4,00 (Q1–Q3: –8,06–4,28) |
p=0,83 |
|
Далее проводился анализ динамики изменения показателей срб в послеоперационном периоде, и были обнаружены статистически значимые различия между подгруппами МПЛД и СПЛД на 3-й, 5-й, 7-й дни после операции – СПЛД продемонстрировал наибольшее увеличение этого показателя. Данные СРБ наглядно продемонстрированы в таблице 7.
Таблица 7
Показатели СРБ в послеоперационном периоде
|
|
МПЛД |
СПЛД |
СЗД |
p |
|
ME (Q1–Q3) |
ME (Q1–Q3) |
ME (Q1–Q3) |
||
|
3-й день п/о, % |
964,17 (Q1–Q3: 441–1446,54) |
2611,84 (Q1–Q3: 922,09–4797,42) |
1652,58 (Q1–Q3: 914,08–3855) |
p=0,014 |
|
5-й день п/о, % |
539,09 (Q1–Q3: 311,6–728,24) |
1120,00 (Q1–Q3: 525–3059,27) |
604,97 (Q1–Q3: 370,03–1388,57) |
p=0,015 |
|
7-й день п/о,% |
315,72 (Q1–Q3: 100–44,53) |
799,52 (Q1–Q3: 208,02–1272,41) |
421,70 (Q1–Q3: 176,05–691,47) |
p=0,007 |
Таким образом, проведенный анализ маркеров тканевой травматизации продемонстрировал, что статистически значимые различия между хирургическими доступами были обнаружены только у одного показателя – с-реактивного белка (стандартный прямой латеральный доступ оказался связан с его максимальным увеличением), а разницы в КФК, ЛДГ, АСТ, КРЕ обнаружено не было. В то же время группа МПЛД продемонстрировала статистически меньшую интенсивность болевого синдрома в первые 4 суток после вмешательства, чем группы стандартных хирургических доступов.
На данный момент существует достаточное количество исследований, изучающих разницу в биохимических маркерах тканевой травматизации мышц между различными хирургическими доступами при эндопротезировании тазобедренного сустава. Однако часто их результаты противоречат друг другу: то заявляется о меньшей травматизации при использовании малоинвазивных доступов, то утверждается, что разница в биохимических показателях отсутствует.
Michael Muller с соавторами сравнили мышечную травматизацию при переднелатеральном мини-инвазивным доступе и модифицированной версии стандартного латерального доступа. Авторы выяснили, что стандартный латеральный доступ оказался связан с более высоким уровнем миоглобина в послеоперационном периоде, однако никакой статистически значимой разницы с мини-инвазивным переднелатеральным доступом найдено не было, а уровень креатининфосфаткиназы был почти одинаковым в этих двух группах [8].
Rykov с соавторами измерили уровень креатининкиназы и с-реактивного белка у пациентов, прооперированных с помощью переднего (n=23) и заднелатерального (заднего, n=23) доступов. Авторы не обнаружили никаких статистически значимых различий, а функциональные результаты пациентов также значимо не отличались [9].
В то же время Zhao с соавторами также сравнили результаты переднего (n=60) и заднелатерального (n=60) доступов. Оценивая величину мышечной травмы, хирурги отслеживали в послеоперационном периоде такие биохимические показатели, как креатининкиназа, с-реактивный белок, интерлейкин-6, скорость оседания эритроцитов, гемоглобин и гематокрит. В течение первых 4 дней после операции передний доступ был связан с меньшим увеличением этих показателей после операции, а разница с заднелатеральным доступом была статистически значима. Также передний доступ показал меньший болевой синдром в течение первых 3 дней после операции (со статистически значимой разницей), однако на 6-й месяц после операции результаты у изучаемых доступов были одинаковыми [10].
Nistor et al. оценили результаты тотального эндопротезирования, выполненного с помощью переднего (n=35) и латерального (n=35) доступа. Все операции были проведены хирургом, находящимся в начале кривой обучения. Оценивая мышечную травму, авторы измеряли уровни миоглобина, креатининкиназы и лактатдегидрогеназы в послеоперационном периоде, также фиксировались уровень болевого синдром и потребление обезболивающих после вмешательства. Было установлено, что в послеоперационном периоде уровень миоглобина в группе переднего доступа был ниже (p<0,001), однако в содержании креатининкиназы и лактатдегидрогеназы не было обнаружено никаких различий. В то же время передний доступ продемонстрировал меньший болевой синдром (p<0,001) с меньшим потреблением морфина (p<0,001) [11].
Langraeber et al. сравнили результаты тотального эндопротезирования тазобедренного сустава, выполненного с использованием переднелатерального мини-инвазивного (n=36) и стандартного (n=39) доступов. Авторы не нашли статистически значимой разницы между доступами в уровне креатинининкиназы и с-реактивного белка после операции, а также в уровне послеоперационного болевого синдрома [12].
Заключение
Учитывая, что в проведенном исследовании все подгруппы продемонстрировали примерно одинаковые результаты при оценке биохимических параметров (кроме срб), можно утверждать, что мышечная травма присутствует при выполнении любых доступов. Это демонстрирует, что основной урон, который влияет на изменение биохимических показателей, наносится не путем отсечения мышц (как при выполнении стандартного латерального и стандартного заднего доступов), а при давлении хирургических инструментов на мышцы, которое присутствует при выполнении как стандартных, так и малоинвазивных доступов, при которых отсечения мышц от мест прикрепления не производится. Однако группа мини-инвазивного переднелатерального доступа продемонстрировала меньшую интенсивность болевого синдрома в послеоперационном периоде, что следует учитывать при предоперационном планировании, особенно у пациентов младшей возрастной группы, для которых скорейший возврат к активной трудоспособной жизни является важнейшим компонентом лечения.
Конфликт интересов: отсутствует.



