Воспалительные заболевания кишечника (ВЗК), среди которых выделяют язвенный колит (ЯК) и болезнь Крона (БК), представляют собой хронические рецидивирующие аутоиммунные заболевания, в основе патогенеза которых лежат срыв иммунологической толерантности к собственной кишечной микробиоте и, как следствие, обильная инфильтрация стенки кишечника клетками специфического и неспецифического иммунитета, а также синтез аутоантител. Основным различием между ЯК и БК является характер поражения желудочно-кишечного тракта (ЖКТ): при ЯК воспаление поверхностное и охватывает только толстый кишечник, в то время как при БК воспаление трансмуральное и вовлекает любой отдел ЖКТ [1].
Важнейшими критериями дифференциальной диагностики ЯК и БК являются данные эндоскопических методов визуализации и гистологический материал. Сложность диагностики заключается в том, что не всегда возможно правильно интерпретировать морфологические изменения ввиду отсутствия в биоптате характерных клеточных маркеров [2]. В связи с этим вопросу диагностики ВЗК посвящено множество работ. Наиболее интересными нам представляются методы поиска диагностических маркеров в биологических субстратах: сывороточного и фекального кальпротектина, аутоантител крови (к перинуклеарным нейтрофильным антигенам (pANKA) и манановому полисахариду клеточной стенки Saccharomyces cerevisiae (ASCA)), антител к гликопротеину 2 (анти-GP2 IgA) в копроэкстрактах и т.д. [3, 4]. Однако обнаружение антител является дорогостоящим и недостаточно чувствительным методом, а определение уровня кальпротектина при относительной доступности и высокой чувствительности не позволяет дифференцировать ЯК и БК между собой.
Основой воспалительного инфильтрата кишечной стенки при ВЗК, помимо лимфоцитов, являются активированные нейтрофилы и макрофаги, продуцирующие провоспалительные интерлейкины, активные формы кислорода и свободные радикалы. Перспективно изучение цитохимической активности именно этих клеток у пациентов с ВЗК. Актуальность исследования метаболической активности нейтрофилов и моноцитов крови обусловлена немногочисленностью работ, посвященных этому вопросу [5, 6, 7].
Цель исследования: оценить риск развития язвенного колита и болезни Крона в зависимости от метаболической активности нейтрофилов и моноцитов периферической крови.
Материалы и методы исследования
В наше исследование были включены 69 пациентов с ВЗК гастроэнтерологического отделения ГБУЗ АО «Александро-Мариинская областная клиническая больница», из них 49 пациентов с ЯК и 20 – с БК. Средний возраст пациентов с ЯК и БК составил 44,4 года и 40,4 года соответственно. По половому признаку пациенты обеих групп распределились одинаково: 55% женщин и 45% мужчин.
Критерии включения в исследование: диагнозы «язвенный колит», «болезнь Крона», возраст от 20 до 65 лет.
Критерии исключения: злокачественные заболевания в анамнезе, декомпенсированные хронические заболевания, тяжелые гематологические заболевания, острые инфекционные заболевания, отказ испытуемых от участия в исследовании, возраст старше 65 лет.
Диагноз был выставлен на основании диагностических критериев, утвержденных в клинических рекомендациях Российской гастроэнтерологической ассоциации и ассоциации колопроктологов России.
Первичных пациентов с ЯК, не получавших ранее базисную противовоспалительную терапию (БПВП), при поступлении в стационар было 26 человек; 23 пациента с ЯК и все пациенты с БК уже получали соответствующую терапию (5-аминосалициловая кислота, иммуносупрессоры, глюкокортикостероиды).
В качестве контрольной группы выступили 35 здоровых доноров.
Распределение пациентов с ВЗК по локализации воспаления: у 79,6% пациентов с ЯК диагностирован левосторонний колит, у 20,4% – тотальный колит, терминальный илеит выявлен у 55,0% пациентов с БК, илеоколит – у 45%. У всех пациентов с БК и у большинства пациентов с ЯК (63,7%) течение заболевания расценивалось как хроническое рецидивирующее, у 4,3% пациентов с ЯК – как хроническое непрерывное и у 2,9% пациентов – как острое. Степень тяжести воспалительной атаки, установленная с помощью критерия Truelove-Witts, у 59,2% пациентов с ЯК была определена как средняя; легкая и тяжелая степени тяжести заболевания были определены у 20,4% пациентов. Тяжесть атаки БК устанавливалась согласно индексу Беста (баллы): у 55% пациентов установлена легкая степень тяжесть атаки (150–300 баллов), у 45% – среднетяжелая атака (301–450 баллов).
У 38,8% пациентов с ВЗК системные проявления не диагностированы, у 61,2% пациентов были выявлены: у всех – синдром эндотоксемии, метаболические расстройства – у 20,4%, артрит – у 18,4%, узловатая эритема – у 22,4%.
Метаболическая активность нейтрофилов и моноцитов исследовалась в день госпитализации в стационар и в день выписки. В венозной крови определялась активность следующих окислительно-восстановительных ферментов: сукцинатдегидрогеназы (СДГ), лактатдегидрогеназы (ЛДГ), глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) [8]. Исследование активности нейтрофилов проводилось с использованием метода Р.П. Нарциссова (1970), выделение моноцитов осуществлялось по методике И.С. Фрейдлин (1978).
Метод полуколичественной оценки Kaplow [9] с определением среднего цитохимического показателя (СЦП) использовался для объективной интерпретации результатов цитохимических реакций. Описание этого метода мы приводили в ранее опубликованной работе [10].
Обработку полученных результатов производили с использованием пакета программ Статистика 8. Достоверность полученных величин определяли с помощью критерия χ2. Статистически значимыми считали различия при p<0,05.
Результаты исследования и их обсуждение
Несмотря на ожидаемые различия в активности ферментов нейтрофилов и моноцитов крови у первичных пациентов и пациентов, получающих БПВП, статистически значимых различий между ними не было выявлено, в связи с чем далее мы приводим усредненные показатели. Этот феномен можно объяснить непродолжительностью приема БПВП пациентами, находящимися на терапии до госпитализации (1–2 месяца).
Сравним степень активности окислительно-восстановительных ферментов нейтрофилов и моноцитов крови пациентов с ЯК и БК (табл. 1).
Таблица 1
Сравнительный анализ активности окислительно-восстановительных ферментов нейтрофилов и моноцитов крови у пациентов с БК и ЯК до курса стационарного лечения
|
ВЗК |
Ферменты нейтрофилов |
Ферменты моноцитов |
||||
|
СДГ |
ЛДГ |
Г-6-ФДГ |
СДГ |
ЛДГ |
Г-6-ФДГ |
|
|
БК (n=20) |
95,0 [92,0; 99,0]* ** |
70,0 [65,0; 74,0]* ** |
73,0 [71,0; 78,0]* ** |
282,0 [277,0; 285,0]* ** |
279,0 [276,0; 285,0]* ** |
269,0 [266,0; 274,0]* ** |
|
ЯК (n=49) |
105,5 [101,0; 108,0]** |
113,5 [110,0; 117,0]** |
150,0 [146,0; 152,0]** |
74 [68,0; 76,0]** |
54,0 [48,0; 57,0]** |
65,5 [60,0; 68,0]** |
|
Контроль (n=35) |
15,07±0,35 |
20,25±0,80 |
34,97±0,33 |
15,04±0,02 |
14,98±0,38 |
15,15±0,51 |
Примечание: *р<0,05 – при сравнении пациентов с БК и ЯК.
**р<0,05 – при сравнении активности ферментов нейтрофилов и моноцитов крови пациентов обеих групп с активностью ферментов в норме.
Наблюдаются достоверные различия активности окислительно-восстановительных ферментов нейтрофилов и моноцитов крови у пациентов с ЯК и БК. У пациентов с ЯК в большей степени возросла метаболическая активность нейтрофилов, а у пациентов с БК – моноцитов крови. Также отмечены достоверные различия активности ферментов нейтрофилов и моноцитов крови у пациентов контрольной группы и пациентов с ЯК и БК. Так, активность окислительно-восстановительных ферментов нейтрофилов у пациентов с ЯК превышала аналогичные показатели пациентов контрольной группы в 7–10 раз, а моноцитов – в 3–4 раза. СЦП ферментов нейтрофилов был представлен клетками средней степени активности. Качественный состав реагирующих моноцитов по всем трем ферментам был представлен клетками низкой и средней степени активности.
У пациентов с БК метаболическая активность нейтрофилов превышала активность соответствующих клеток контрольной группы в 4–6 раз, моноцитов – в 17–18 раз. По всем трем ферментам нейтрофилов клетки были низкой степени активности. СЦП ферментов моноцитов был представлен клетками высокой степени активности.
В рамках нашего исследования обнаружено, что метаболическая активность нейтрофилов и моноцитов имеет средние и сильные корреляционные связи с клинико-лабораторной активностью ВЗК.
Сильная положительная корреляция наблюдалась между всеми ферментами как нейтрофилов, так и моноцитов пациентов с ЯК и частотой стула (в среднем r=0,8), температурой тела (в среднем r=0,72), уровнем СОЭ (в среднем r=0,75); сильная отрицательная – между соответствующими ферментами и показателем гемоглобина (в среднем r=–0,73).
У пациентов с БК определены положительная сильная корреляционная связь между метаболической активностью нейтрофилов и моноцитов крови и величиной индекса Беста (в среднем r=0,75), уровнем СОЭ (в среднем r=0,80), лейкоцитами (в среднем r=0,75), уровнем СРБ (в среднем r=0,81) и отрицательная корреляционная связь средней силы между вышеперечисленными ферментами и уровнем общего белка крови (в среднем r=–0,73).
Для оценки диагностической точности определения активности окислительно-восстановительных ферментов нейтрофилов и моноцитов крови у пациентов с ЯК и БК была произведена оценка абсолютных и относительных рисков с расчетом значимости каждого фактора с помощью критерия Хи-квадрат Пирсона (табл. 2).
Таблица 2
Оценка абсолютных и относительных рисков развития ЯК и БК в зависимости от активности окислительно-восстановительных ферментов нейтрофилов и моноцитов крови
|
|
Наличие ВЗК |
|
|
|
|||
|
Фактор (у.е.) |
Клетки |
Группа |
Фактор: нет Частота (абс. риск) |
Фактор: есть Частота (абс. риск) |
Изменение риск (95% ДИ) |
Уровень Р (df=1) |
Хи-квадрат |
|
СДГ ≥ 99,0 |
нейтрофилы |
Язвенный колит |
2 (4,8%) |
47 (97,9%) |
93,2 |
<0,0001 |
78,3 |
|
ЛДГ ≥ 90,0 |
2 (4,8%) |
47 (97,9%) |
93,2 |
<0,0001 |
78,3 |
||
|
Г-6-ФДГ ≥ 120,0 |
2 (4,8%) |
47 (97,9%) |
93,2 |
<0,0001 |
78,3 |
||
|
50 < СДГ < 100 |
моноциты |
1 (2,4%) |
48 (98%) |
95,5 |
<0,0001 |
82,1 |
|
|
40 < ЛДГ < 100 |
1 (2,4%) |
48 (98%) |
95,5 |
<0,0001 |
82,1 |
||
|
50 < Г-6-ФДГ < 100 |
2 (4,8 %) |
47 (97,9%) |
93,2 |
<0,0001 |
78,3 |
||
|
88 < СДГ < 99 |
нейтрофилы |
Болезнь Крона |
1 (5,0%) |
19 (95%) |
90,0 |
<0,0001 |
32,4 |
|
60 < ЛДГ < 90 |
1 (5,0%) |
19 (95%) |
90,0 |
<0,0001 |
32,4 |
||
|
50 < Г-6-ФДГ < 120 |
1 (5,0%) |
19(95%) |
90,0 |
<0,0001 |
32,4 |
||
|
СДГ ≥ 250,0 |
моноциты |
1 (5,0%) |
19(95%) |
90,0 |
<0,0001 |
32,4 |
|
|
ЛДГ ≥ 250,0 |
1 (5,0%) |
19 (95%) |
90,0 |
<0,0001 |
32,4 |
||
|
Г-6-ФДГ ≥ 250,0 |
1 (5.0%) |
19 (95%) |
90,0 |
<0,0001 |
32,4 |
||
Исходя из полученных данных все изученные нами ферменты как нейтрофилов, так и моноцитов являются значимыми для диагностики ЯК и БК.
Далее мы использовали метод «дерево классификации» для прогнозирования вероятности ЯК или БК по активности ЛДГ, СДГ и Г-6-ФДГ нейтрофилов и моноцитов крови. Данный метод позволяет предсказать принадлежность наблюдений (объектов) в зависимости от значений одной или нескольких предикторных переменных к тому или иному классу зависимой категориальной переменной. Этот метод удобен для нашего исследования, поскольку благодаря ему возможно изучить эффект влияния отдельных переменных последовательно, а также выполнить одномерное ветвление для анализа вклада этих переменных (табл. 3).
Таблица 3
Результаты построения дерева решений
|
№ |
Правило |
Клетки |
Объем группы |
Риск |
|
1 |
ЯК и СДГ ≥ 99,0 |
нейтрофилы |
49 |
97,9% |
|
2 |
ЯК и ЛДГ ≥ 90 |
49 |
97,9% |
|
|
3 |
ЯК и Г-6-ФДГ ≥ 120 |
49 |
97,9% |
|
|
4 |
ЯК и 50 < СДГ < 100 |
моноциты |
49 |
97,9% |
|
5 |
ЯК и 40 < ЛДГ < 100 |
49 |
97,9% |
|
|
6 |
ЯК и 50 < Г-6-ФДГ < 100 |
49 |
97,9% |
|
|
7 |
БК и 88 < СДГ < 99 |
нейтрофилы |
20 |
95% |
|
8 |
БК и 60 < ЛДГ < 90 |
20 |
95% |
|
|
9 |
БК и 50 < Г-6-ФДГ < 120 |
20 |
95% |
|
|
10 |
БК и СДГ ≥ 250 |
моноциты |
20 |
95% |
|
11 |
БК и ЛДГ ≥ 250 |
20 |
95% |
|
|
12 |
БК и Г-6-ФДГ ≥ 250 |
20 |
95% |
Если активность СДГ, ЛДГ или Г-6-ФДГ как нейтрофилов, так и моноцитов крови у пациентов с ЯК и БК выходила за указанные в таблице 3 границы, вероятность развития соответствующего заболевания составляла не более 5%.
Для показателя «ВЗК» смоделировано дерево решений и составлен диагностический алгоритм (рисунок). Предложенная модель получилась достаточно удачной: AuROC=0,98, эффективность=97% (чувствительность 95,7%, специфичность 98,3%), это означает, что более 95% всех случаев идентифицированы верно.
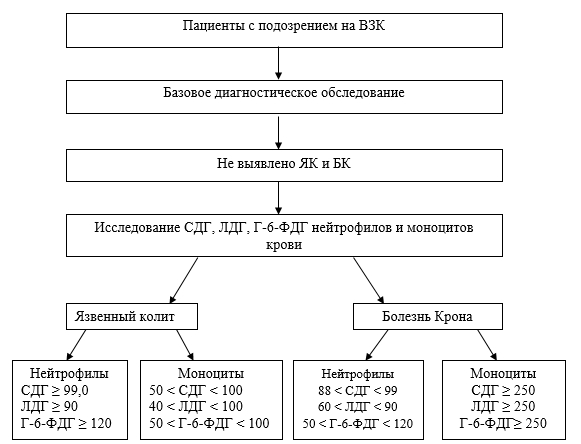
Алгоритм дифференциальной диагностики ЯК и БК
Заключение
Таким образом, мы построили достаточно адекватную модель, благодаря которой можно прогнозировать исход недифференцированного колита в ЯК или БК. Это даст возможность в максимально ранние сроки подобрать специфическую терапию для таких пациентов, тем самым снизив процент инвалидности и улучшив качество жизни пациентов.



