Колоректальный рак занимает четвертое место по частоте диагностирования среди всех злокачественных новообразований и третье - среди причин онкологической смертности. Хирургическое лечение синхронных метастазов печени колоректального рака является сложной и актуальной проблемой современной онкохирургии [1; 2]. Продолжительность жизни пациентов из-за отсутствия специфического лечения в редких случаях достигает одного года [3; 4]. В настоящее время результаты лечения пациентов с распространенными формами онкологического процесса значительно улучшились. Это обусловлено как совершенствованием хирургической техники выполнения оперативного вмешательства, так и успехами анестезиологии и реаниматологии, внедрением эффективных антибактериальных препаратов, современного энтерального и парентерального питания [5; 6]. Немалую роль также сыграли достижения химиолучевой терапии и появление новых таргетных препаратов и схем лечения [7-9].
Особое место в определении тактики лечения и объема хирургического пособия у пациентов с внутрипеченочными метастазами отводится вопросам диагностики [1; 6; 9]. Разработка оптимального алгоритма обследования пациентов и оценка эффективности разных методов визуализации, как по отдельности, так и в их комбинации, является весьма актуальной задачей, решение которой позволит еще на дооперационном этапе оценить радикализм предполагаемого вмешательства. Правильная интерпретация результатов дает возможности выявлять очаговые поражения печени менее 1 см в диаметре. Следовательно, при полноценном и правильном проведении предоперационной лучевой диагностики пораженной печеночной ткани можно значительно уменьшить количество нерадикальных резекций [10].
На современном этапе развития хирургической гепатологии оперативные вмешательства на печени заключаются не только в резекции пораженного участка органа, но и в локальном воздействии на опухолевую ткань [3]. Это позволяет расширить показания к симультанным операциям у ослабленных пациентов и тем самым увеличить продолжительность жизни. Существует множество исследований по результатам лечения как синхронных, так и метахронных внутрипеченочных метастазов, описаны различные критерии выбора того или иного способа оперативной тактики. Отсутствие единого подхода к хирургическому лечению метастатического колоректального рака в печень является основой для выполнения исследований с разработкой оптимального диагностического и лечебного алгоритмов [7; 11].
Цель исследования – ретроспективный анализ результатов хирургического лечения метастатического колоректального рака.
Материал и методы исследования. С 2005 по 2018 г. в хирургическом отделении РостГМУ проходили лечение 256 пациентов с внутрипеченочными метастазами колоректального рака. В ретроспективный анализ включены 74 пациента. Средний возраст респондентов в конечной выборке составил 56,4±10,9 года. В исследовании было 34 мужчины (46%) и 40 женщин (54%). Критерии включения в исследование были следующими: наличие у пациентов резектабельных метастазов печени и/или возможность выполнить радиочастотную термодеструкцию опухолевой ткани, при отсутствии экстрапеченочного распространения опухолевого процесса; резектабельность первичной опухоли и возможность одномоментного формирования межкишечного анастомоза. Помимо рутинных клинических и биохимических исследований, дополнительно выполняли определение уровня ракового эмбрионального антигена (РЭА), СА 19-9, что позволяло выявлять ранний рецидив заболевания. Перед планированием симультанных операций в обязательном порядке проводилась оценка нутритивного статуса согласно клиническим рекомендациям по нутритивной поддержке при химиотерапии и лучевой терапии. Спиральную компьютерную томографию (СКТ) органов брюшной полости, малого таза (при локализации опухоли в прямой кишке и ректосигмоидном отделе) с контрастированием выполняли для определения распространенности как местного процесса, так и метастатического поражения печени.
У 4 больных выполнены повторные вмешательства на печени в течение первых 6 месяцев из-за рецидива метастатического поражения печени. Операции выполнялись лапаротомным способом. С целью снижения количества послеоперационных осложнений со стороны операционной раны мы использовали разработанную методику лапаротомии «Способ оперативного доступа к органам верхнего этажа брюшной полости» (Патент РФ № 2524973 от 10.06.2014).
В послеоперационном периоде адъювантная химиотерапия проводилась по стандартным схемам через 2-4 недели после хирургического лечения на протяжении 4-6 месяцев. Среднее число курсов составило 5±3,0.
Все пациенты находились под диспансерным наблюдением на предмет раннего выявления метахронных внутрипеченочных метастазов. В первые два года определяли уровень РЭА и СА 19-9 (1 раз в 3 месяца на протяжении двух лет и далее 1 раз в 6 месяцев на протяжении трех лет), выполняли СКТ органов брюшной полости, малого таза 1 раз в 6 месяцев первые два года, затем 1 раз в год в течение трех лет.
Анализ данных был произведен с помощью программ Microsoft Excel и Statistica 7.0. Для оценки статистически значимых различий был использован t-критерий Стьюдента.
Результаты исследования и их обсуждение. При анализе историй болезни пациентов обеих групп было выявлено, что у большинства больных первичным источником опухолевого процесса явились нисходящая ободочная кишка и сигмовидная (43%), а в 39% наблюдений субстрат локализовался в прямой кишке, в меньшем числе случаев первичная опухоль располагалась в правой половине ободочной кишки (18%) (рис. 1).
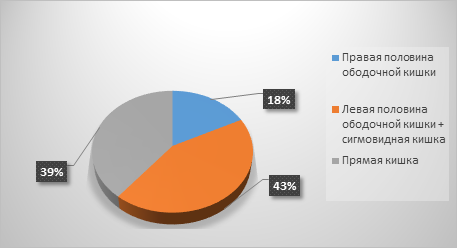
Рис. 1. Локализация первичной опухоли
У большинства пациентов (78,3%, 58 человек) была диагностирована умеренно дифференцированная аденокарцинома (G2).
При анализе метастатического поражения печени выявлено (рис. 2), что правая доля была поражена в 55,4% (41 человек), а левая в 33,7% наблюдений (25 человек). В 10,8% случаев (8 человек) отмечено билобарное поражение с общим количеством опухолевых узлов не более четырех (рис. 3).
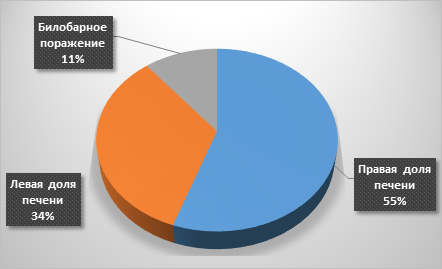
Рис. 2. Локализация МТС в печени
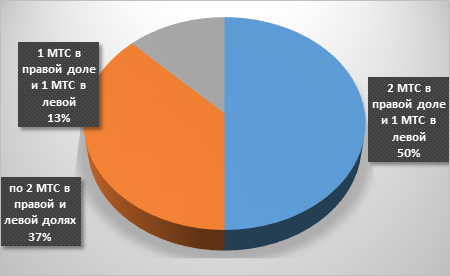
Рис. 3. Билобарная локация
Хирургическая тактика лечения метастазов печени зависела от количества опухолевых очагов, их максимального размера, топографо-анатомических взаимоотношений с крупными сосудистыми структурами, а также их топической локализации. Резекционной хирургии при поражении одной из долей печени подвержены 47,2% пациентов (35 человек). Размеры метастатических узлов у данных больных составили от 40 до 65 мм в максимальном диаметре (Mе=46 mm; Q1=37,2, Q2=44, Q3=57,8). У 31 пациента произведена радиочастотная термоабляция (РЧТА) опухолевых очагов. Показанием для данной манипуляции являлось наличие метастазов диаметром до 35 мм в количестве 4 и менее. Размеры метастатических узлов, подвергшихся локальной термодеструкции (45 метастазов), у пациентов с монолобарным поражением составили от 14 до 35 мм в максимальном диаметре.
Согласно результатам патоморфологических исследований удаленных операционных макропрепаратов, метастазы первичной опухоли были обнаружены в лимфатических узлах гепатодуоденальной связки у 7 больных (9,4%). Подробный анализ распределения оперативных вмешательств в зависимости от локализации первичной опухоли и ее распространенности, а также возраста пациентов представлен в таблице 1.
Таблица 1
Объем выполненных вмешательств у больных метастатическим раком толстой кишки
|
Признак |
Резекция печени |
РЧТА метастазов печени |
Резекция печени+РЧТА метастазов |
|
Возраст пациентов |
53,2±5,1 |
56,3±9,4 |
56,8±9,3 |
|
Количество пациентов (всего n=74) |
35 (47,2%) |
31 (41,8%) |
8 (10,8%) |
|
Объем операций на толстой кишке |
|||
|
Левосторонняя гемиколэктомия |
5 (14,2%) |
10 (32,2%) |
2 (25%) |
|
Резекция сигмовидной кишки |
6 (17,1%) |
6 (19,3%) |
2 (25%) |
|
Правосторонняя гемиколэктомия |
8 (22,8%) |
5 (16,1%) |
1 (12,5%) |
|
Передняя резекция прямой кишки |
9 (25,7%) |
5 (16,1%) |
2 (25%) |
|
Низкая передняя резекция прямой кишки |
7 (20%) |
5 (16,1%) |
1 (12,5%) |
|
Распространенность первичной опухоли |
|||
|
T1-2 |
8 (22,8%) |
6 (19,3%) |
3 (37,5%) |
|
T3-4 |
27 (77,2%) |
25 (80,6%) |
5 (62,5%) |
|
N0 |
11 (31,4%) |
13 (41,9%) |
0 |
|
N+ |
24 (68,5%) |
18 (58%) |
8 (100%) |
Одним из важных этапов операции является оптимальный доступ к пораженным органам. В наших наблюдениях выполняли срединную лапаротомию.
При проведении симультанных операций очередность резекции пораженных органов достоверно не влияла как на непосредственные, так и на отдаленные результаты операции. Атипичные резекции были выполнены пациентам с единичными метастазами в обеих долях. Левосторонняя гемигепатэктомия в сочетании с экономной резекцией контралатеральной доли была единственным способом радикального лечения больных с массивным опухолевым поражением печеночной ткани. Объемы резекций печени представлены в таблице 2.
Таблица 2
Виды оперативных вмешательств на печени при метастатическом ее поражении
|
Объем резекции |
Количество пациентов |
|
Атипичная резекция сегмента |
16 (45,7%) |
|
Анатомическая резекция сегмента |
8 (22,8%) |
|
Анатомическая резекция двух и более сегментов |
10 (28,5%) |
|
Левосторонняя гемигепатэктомия + атипичная резекция правой доли |
1 (2,8%) |
|
Всего |
35 |
Линию резекцию намечали с учетом данных интраоперационного УЗИ. Во всех случаях по результатам морфологического исследования макропрепарата край резекции был негативным. Длительность операции составляла 134,4±45,6 мин. Для снижения интраоперационной геморрагии мы использовали специальную аппаратуру, гемостатические губки. Резекцию печени мы выполняли аппаратом «CUSA Excel+» (n=21) и РЧ-электродом «Habib 4x» (n=14). При ультразвуковой диссекции паренхимы печени сосуды и желчные протоки более 2-3 миллиметров клипировали или лигировали. Касательно техники резекции в нашем исследовании показано, что использование РЧ-электрода «Habib 4x» сопровождается большим количеством осложнений со стороны печени в ближайшем послеоперационном периоде, нежели при использовании «CUSA Excel+», особенно при атипичных резекциях органа, когда требуется более длительная коагуляция печеночной ткани с целью надежного гемостаза, и тем самым создается значительная зона коагуляционного некроза. Интраоперационная кровопотеря на печеночном этапе в среднем составила 845,9±174,4 мл при использовании ультразвукового деструктора, а при РЧ-резекции - 1290±98,0 мл (р<0.05), что в ряде случаев требовало интраоперационной гемо- и плазмотрансфузии. Использование «CUSA Excel+» позволило прецизионно выделять сосудистые и желчные протоки, а также секторальные ножки сегментов без термического повреждения печеночной ткани, тем самым снижая риск развития осложнений и интраоперационного кровотечения. При выполнении РЧТА кровопотери не отмечено.
Нагноение послеоперационной раны было отмечено у 5 пациентов (6,7%) прооперированных, при чем у 4 человек после различного рода резекции печени. У одной пациентки отмечена подкожная эвентерация, потребовавшая интенсивного консервативного лечения и ежедневных перевязок. У 10 пациентов (13,5%) выявлены реактивные правосторонние плевриты различной степени выраженности, которые не требовали пункций. Субфебрильная температура тела в течение 7-9 дней сохранялась у всех больных после РЧ-резекции HABIB SEALER. В 5 наблюдениях (6,7%) отмечено длительное отхождение по дренажам коагуляционного струпа печеночной ткани (от 5 до 9 дней, Ме=6). Во всех случаях после резекции отмечалось повышение уровня трансаминаз (АЛТ, АСТ). Гипертрансаминаземия достоверно была выше у пациентов, подвергшихся радиочастотной резекции, и сохранялась более длительный срок. Что касается осложнений после РЧТА, то наиболее тяжелым у 2 пациентов стоит отметить формирование гематомы в зоне проведения РЧ-абляции, которая не требовала повторного вмешательства. В течение месяца по результатам динамических УЗ-исследований был отмечен фиброз этой области. Среднее количество койко-дней пребывания пациентов в стационаре - 11.
Послеоперационная летальность отмечена в 2,7% случаев (2 человека). В одном случае отмечена несостоятельность низкого колоректального анастомоза, потребовавшая выполнения неоднократных релапаротомий с последующим развитием полиорганной недостаточности на фоне абдоминального сепсиса. В другом случае пациент умер от массивной тромбоэмболии легочной артерии, несмотря на проведение определенных профилактических мер и динамического контроля показателей коагулограммы.
Как было отмечено выше, в 4 наблюдениях (12,9%) после ранее выполненной РЧТА при контрольных осмотрах в течение первых 6 месяцев выявлено локальное прогрессирование опухоли. Размеры опухолевых очагов на время первичной операции составляли не менее 30 мм. Повторная РЧТА произведена через 3 месяца в одном случае, еще у трех больных выполнена атипичная резекция правой доли печени. Повторные вмешательства производили с помощью разработанного в клинике метода лапаротомии, позволяющего улучшить послеоперационный реабилитационный период и снизить количество осложнений со стороны лапаротомной раны (Патент РФ № 2524973 от 10.06.2014). Рецидива опухоли печени после резекционной хирургии не выявлено.
Отдаленный послеоперационный период был прослежен не у всех пациентов, лишь у 46 человек. Трехлетняя выживаемость составила 57,4%. Медиана жизни – 38,0 мес.
Наилучшие результаты диагностированы у больных с солитарным метастатическим поражением печени, 3-летняя выживаемость которых составила 42,8%. У пациентов с билобарным поражением данный показатель составил 19,5%.
Выводы. Детальное изучение результатов лучевых методов диагностики позволяет достаточно четко определить критерии выбора оптимального вида оперативного вмешательства на печеночной ткани. Резекция печени является условно радикальным методом оперативного лечения метастазов рака толстой кишки и должна рассматриваться в первую очередь. РЧТА может применяться как в моноварианте, так и в комбинации с резекционной хирургией. Объем резекции должен основываться на количестве и размерах метастазов, топографо-анатомическом взаимоотношении с крупными сосудистыми структурами, потенциально остающемся объеме паренхимы печени, а также отсутствии или наличии печеночной недостаточности. Разработанный в клинике способ лапаротомии позволяет улучшить непосредственные и отдаленные результаты со стороны операционной раны.



