В ряду хронических осложнений сахарного диабета (СД) ожидается всё большее увеличение бремени диабетической автономной кардиальной нейропатии (АКН) из-за всемирной эпидемии СД с его более ранним началом и широким распространением [1; 2]. АКН играет значимую роль в отношении смертности и сердечно-сосудистой заболеваемости пациентов с СД, проявляясь тахикардией, удлинением интервала QT, ортостатической гипотонией, нарушением вариабельности сердечного ритма (ВСР), однако частота ее диагностики недостаточная [3; 4]. Решение этой проблемы исследователи видят в распространении скрининга симптомов и признаков кардиальной дисфункции, упрощении кардиоваскулярных рефлекторных тестов, отборе кандидатов для скрининга АКН [1; 5]. Изучение ВСР с помощью высокоразрешающей ритмокардиографии (РКГ) с проведением кардиоваскулярных тестов [6; 7] позволяет диагностировать АКН и классифицировать её по 3 стадиям (начальные проявления, выраженная и тяжелая АКН) согласно диагностическим критериям подкомитета по АКН согласительной комиссии в Торонто по диабетической нейропатии [1]. Хронические неинфекционные заболевания (ХНИЗ) являются главной причиной снижения трудоспособности, качества жизни больных, а также смертности и инвалидизации населения [8]. Изучение влияния коморбидной нагрузки на прогрессирование АКН актуально ввиду полиморбидности СД с ключевой ролью заболеваний сердечно-сосудистой системы [9; 10]. Таким образом, актуальным является изучение кардиоваскулярной вегетативной дисфункции с выявлением РКГ – признаков, определяющих стадию АКН у больных СД с сопутствующими заболеваниями.
Цель исследования: оценить на основании анализа показателей РКГ распространенность АКН, разработать модель прогноза степени тяжести данного осложнения с оценкой адекватности полученной модели на практике у больных СД с коморбидной патологией.
Материал и методы исследования. Дизайн исследования – одномоментное поперечное. Обследовано 587 коморбидных больных, госпитализированных в эндокринологическое отделение с СД. По критериям включения: 1) возраст старше 18 лет; 2) СД в соответствии с диагностическими критериями диагностики сахарного диабета ВОЗ, 1999-2013; 3) информированное согласие пациента на участие в исследовании; и исключения: 1) острые и хронические заболевания органов соматической сферы в активной фазе; 2) прием в день обследования лекарственных препаратов; 3) острый период нарушений мозгового и коронарного кровообращения, транзиторная ишемическая атака, ишемический инсульт, геморрагический инсульт, инфаркт миокарда, нестабильная стенокардия; 4) пароксизмальная желудочковая тахикардия, фибрилляция предсердий, желудочков, а-в блокада II ст. и выше, полная блокада левой ножки пучка гиса; 5) оперативные вмешательства в предшествующие 3 месяца до включения в исследование; 6) тяжелые нарушения функции печени (печеночная недостаточность), заболевания печени в активной фазе; 7) ХБП со снижением скорости клубочковой фильтрации (СКФ) менее 30 мл/мин/1,73 м2; 8) критическая ишемия нижних конечностей, синдром диабетической стопы; 9) БА; 10) ХОБЛ; 11) злокачественные новообразования, лечение цитостатиками; 12) психические заболевания, злоупотребление алкоголем и психоактивными веществами; 13) беременность; 14) отказ пациента от участия в исследовании, исследуемую группу составили 310 мужчин (55,8%) и женщин (54,2%) в возрасте 18-70 лет. Медиана возраста 40,5(26,0;52,0) лет, длительность заболевания - 10,0(4;16) лет, возраст начала диабета - 46,0(34;52) лет, у 147 пациентов был СД 1 типа, у 163 – СД 2 типа. Медиана HbA1c составила 9,4(7,9;10,8)%, ИМТ - 30,2(26,5;34,) кг/м2, общий холестерин - 5,3(4,7;6,2) ммоль/л, медиана СКФ - 83,9(71,3;99,5) мл/мин. Все пациенты, включенные в исследование, страдали сопутствующими заболеваниями и имели факторы риска ХНИЗ, медиана сопутствующих заболеваний у одного пациента составила 8(6;10), с минимумом в 2 и максимумом до 17. Был рассчитан индекс Сharlson по стандартной методике [9], составил 4(2;5), с минимумом в 1 и максимумом в 6 баллов. Артериальная гипертензия (АГ) выявлена у 202 (65,1%) больных, при этом АГ 1 стадии - у 51 (16,5%), АГ 2 стадии - у 131 (42,3%) пациента, АГ 3 стадии - у 20 (6,5%). У 78 (25,2%) пациентов была ИБС с клиникой стабильной стенокардии напряжения (СН) 1ф. к. (n=14), 2ф. к. (n=22) и 3 ф. к. (n=42), I-IIб стадии хронической сердечной недостаточности. Функциональный класс ХСН по NYHA: I – 31 (10%) пациент, II – 104 (33,5%), III – 43 (13,9%). Изучали ВСР методом высокоразрешающей РКГ на КАП-РК-01-«Микор» (рег. уд. № ФС-022б2005/2447-06). Всем пациентам проведена РКГ с формированием двух групп в зависимости от выраженности вегетативных дизрегуляций по результатам РКГ-исследования и согласно утвержденным критериям Toronto Consensus Panel on Diabetic Neuropathy, 2011 [1]: без АКН (n=216) и с АКН (n=94), группа АКН по степени её выраженности подразделилась на подгруппы АКН1 (n=36), АКН2 (n=38), АКН3 (n=20). Оценивались показатели ВСР: общая вариабельность SDNN, амплитуда дыхательной аритмии АRA, среднеквадратические отклонения гуморально-метаболических – бl, симпатических -бm, парасимпатических -бs волн в секундах (с) и их процентные соотношения (VLF, LF, HF; %). В РКГ-исследовании использовались пробы: модифицированная Вальсальвы-Брюкера (Vm) - с глубоким вдохом и задержкой дыхания, Ашнера-Даньини (рА), активная ортостатическая (Аор) и нагрузочная (PWC120) с дозированной по ЧСС-120 нагрузкой на велоэргометре [11]. В пробах оценивались: Δ RR(%) - максимальная реакция относительно исхода, TAB (с) - время достижения максимальной реакции, Tr (с) - время восстановления после стимула. Статистическая обработка c помощью SPSS 17.0, STATISTICA 10 с использованием рекомендация Ребровой О.Ю., 2002. Учитывая, что распределение большинства изученных признаков было отличным от нормального, применяли непараметрические методы. Межгрупповые различия для двух групп оценивали с помощью критерия Манна-Уитни. Для сравнения количественных признаков в трех группах и более - критерий Краскела-Уоллиса, сравнение качественных показателей с использованием χ2-критерия Пирсона, корреляция по Спирмену. Применялся многофакторный дискриминантный анализ для получения математической модели прогнозирования АКН и степени её тяжести на основе наиболее информативных для классификации индексов РКГ-анализа. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05. Данные представлены как медианы (Me) с 25-ми и 75-ми процентилями Me[25;75].
Результаты исследования и их обсуждение. Пациенты без АКН (n=216) и с АКН (n=94) по многим показателям отличались друг от друга: в группе с АКН был значимо больший возраст, большая длительность СД, уровень HbA1c, в группе с АКН на одного пациента было 8[6;10,5] сопутствующих нозологий против 5[3;9] в группе без АКН, при АКН найдена большая частота АГ, хронической цереброваскулярной болезни, облитерирующих заболеваний периферических артерий, диабетической ретинопатии и нефропатии, ИБС со СН I-II ф.к., чаще по результатам ЭХОКГ выявлено ремоделирование миокарда (табл.1). Холестерин, триглицериды, креатинин достоверно не различались в изучаемых группах (табл.1).
Таблица 1
Клинико-лабораторные показатели и сопутствующие заболевания в исследуемых группах
|
Показатели; Мe(25;75) |
Без АКН, n=216 |
АКН, n=94 |
p |
|
Возраст, лет |
49,0[31;57] |
55,0[45,7;60,2] |
p<0.001 |
|
Длительность СД, лет |
7,0[3;11] |
10,0[5;17,2] |
p<0.001 |
|
Возраст начала СД, лет |
39[24;49] |
42[25;50] |
p>0.05 |
|
ИМТ, кг/м2 |
27,7[23,9;32,9] |
29,3[25;33,2] |
p>0.05 |
|
HbA1C, % |
9,5[8,2;11] |
9,3[8,1;10,9] |
p>0.05 |
|
Холестерин, ммоль/л |
5,3[4,4;6,2] |
5,2[4,7;6,2] |
p>0.05 |
|
Триглицериды, ммоль/л |
1,31[0,9;2,0] |
1,38[1,0;2,2] |
p>0.05 |
|
Креатинин, мкмоль/л |
73,0[64;82] |
75,0[63;92] |
p>0.05 |
|
Мочевина, ммоль/л |
4,7[3,8;5,8] |
6,2[4,9;7,2] |
p<0.001 |
|
СКФ, мл/мин по MDRD |
93,4[77,7;108,2] |
87,2[73,2;102] |
p=0.023 |
|
Количество сопутствующих нозологий |
5[3;9] |
8[6;10,5] |
p<0.001 |
|
Артериальная гипертензия, n(%) |
114(52,8%) |
71(85,5%) |
p<0.05 |
|
ОТ>80 у ж, >94 у м, n (%) |
112(45%) |
62(60%) |
p<0.05 |
|
Хр. цереброваскулярная болезнь, n |
42(20,4%) |
23(24,5%) |
p<0.05 |
|
Хр. облитерирующие заболевания периферических артерий, n |
11(5,1%) |
9(8,6%) |
p<0.05 |
|
Д. ретинопатия, n(%) |
165(76,4%) |
85(90,4%) |
p<0.001 |
|
Д. нефропатия, n(%) |
79(36%) |
39(41,5%) |
p<0.05 |
|
Д. нейропатия, n(%) |
157(72,7%) |
85 (90,4%) |
p<0.001 |
|
ИБС, СН I-II ФК, n(%) |
48 (22%) |
30 (32%) |
p<0.05 |
|
Наличие ремоделирования миокарда ЛЖ по ЭХОКГ |
102(47,2%) |
62(66,0%) |
p=0,002 |
|
Примечание: в данной и следующих таблицах жирным шрифтом выделены значения критерия Z, при котором отвергается гипотеза равенства, с уровнем статистической значимости p<0,05 |
|||
При сравнении результатов временного статистического анализа ВСР у пациентов с АКН в сравнении с пациентами без АКН получены данные, свидетельствующие о крайне выраженном снижении периферической автономной регуляции в синусовом узле (СУ) сердца. Выявлено угнетение симпато-парасимпатической регуляции ритма в целом (SDNN до 0,012 c, ARA в до 0,011 с) как в покое, так и после стимуляции в пробах. По временным статистическим показателям σl, σm, σs в СУ автономное угнетение относилось, в наибольшей степени, к парасимпатическому фактору регуляции c резким снижением до единиц миллисекунд амплитуды парасимпатических волн (σs), с минимумом в 0,003 с в Aop (табл.2). Полученные данные свидетельствуют о резком снижении ВCР-показателей трёх видов волн, причём большинства из них до единиц миллисекунд, в особенности σs в группе с АКН в сравнении с пациентами без кардионейропатии. Тот факт, что временные статистические показатели пациентов с АКН составили единицы миллисекунд (табл.2), подчеркивает необходимость использования высокоразрешающих методов изучения ВСР, в частности РКГ [11].
Таблица 2
Временные статистические показатели анализа ВСР пациентов без АКН (n=216, верхняя строка) и с АКН (n=94, вторая строка)
|
ВСР показатели Me[25;75] |
Исходно в позе лёжа |
Vm |
pA |
Aop |
PWC 120 |
|
SDNN, с |
0,024 [0,017;0,032] 0,012 [0,008;0014] p<0,001 |
0,022 [0,016;0,031] 0,010 [0,008;0,014] p<0,001 |
0,024 [0,017; 0,033] 0, 011 [0,008; 0,014] p<0,001 |
0,017 [0,013;026] 0,009 [0,006;0,012] p<0,001 |
0,024 [0,017;0,035] 0,011 [0,008;0,015] p<0,001 |
|
Z=10,8 |
Z=10,9 |
Z=10,8 |
Z=9,7 |
Z=10,8 |
|
|
ARA, с |
0,028 [0,020;0,044] 0,011 [0,008;0,017] p<0,001 |
0,025 [0,018;0,041] 0,011 [0,008;0,016] p<0,001 |
0,028 [0,019;0,043] 0,010 [0,007; 0,015] p<0,001 |
0,018 [0,012;0,028] 0,007 [0,005;0,010] p<0,001 |
0,034 [0,022;0,053] 0,012 [0,008;0,019] p<0,001 |
|
Z=10,6 |
Z=10,5 |
Z=10,9 |
Z=9,4 |
Z=10,6 |
|
|
σl, с |
0,016 [0,012;0,021] 0,008 [0,006;0,012] p<0,001 |
0,015 [0,011;0,020] 0,007 [0,005;0,010] p<0,001 |
0, 015 [0,011;021] 0,008 [0,006;0,012] p<0,001 |
0,012 [0,009;0,017] 0,007 [0,005;0,009] p<0,001 |
0,014 [0,009;0,020] 0,007 [0,005;0,010] p<0,001 |
|
Z=9,8 |
Z=9,5 |
Z=9,2 |
Z=8,5 |
Z=8,5 |
|
|
σm, с |
0,009 [0,006;0,014] 0,004 [0,003;0,005] p<0,001 |
0,009 [0,006;0,014] 0,004 [0,003;0,005] p<0,001 |
0,010 [0,006;0,015] 0,004 [0,003;0,005] p<0,001 |
0,008 [0,006;0,014] 0,003 [0,002;0,005] p<0,001 |
0,010 [0,006;0,015] 0,004 [0,003;0,005] <0,001 |
|
Z=10,7 |
Z=10,2 |
Z=10,3 |
Z=10,0 |
Z=10,2 |
|
|
σs, с |
0,011 [0,008;0,018] 0,004 [0,003;0,007] p<0,001 |
0,010 [0,007;0] 0,014 [0,003;0,005] p<0,001 |
0,012 [0,008;0,017] 0,004 [0,003;0,006] p<0,001 |
0,006 [0,004;0,010] 0,003 [0,002;0,004] p<0,001 |
0,014 [0,010;0,022] 0,005 [0,003;0,008] p<0,001 |
|
Z=10,1 |
Z=10,2 |
Z=10,8 |
Z=8,3 |
Z=10,4 |
Спектральный анализ показал крайне выраженное перераспределение регулирующих факторов в пользу гуморально-метаболического влияния (VLF%) в группе с АКН до 61,5[45;74,9] по сравнению с пациентами без данного осложнения, где доля VLF% 49,2[37,2;63], p<0,001 c максимальным уменьшением доли парасимпатического влияния (HF%) в СУ при АКН до 20,1[9,7;37,3] против 25,4[17,3;43,2], p<0,05 у пациентов без АКН (таблица 3). С учётом того, что в СУ парасимпатическая регуляция в норме является преобладающей [11], выявленное перераспределение патологично. Подобные соотношения показателей сохранялись во всех пробах, несмотря на разную направленность и интенсивность стимулов с формированием патологического паттерна реагирования в постстимульных периодах проб. При сравнении РКГ показателей реактивности в пробах Vm, Pa, Aop, PWC120 в группе АКН в сравнении с пациентами без кардионейропатии величина реакции на стимул (Δ RR) была ниже в два раза (p<0,001), возрастало время ее достижения (TAB) и больше требовалось времени на восстановление волновой структуры сердечного ритма после стимулов (Tr) (табл.3).
Таблица 3
Показатели спектрального анализа ВСР и периодов стимуляции в пробах пациентов без АКН (n=216, верхняя строка) и с АКН (n=94, вторая строка)
|
ВСР показатели Me[25;75] |
Исходно в позе лёжа |
Vm |
pA |
Aop |
PWC 120 |
|
|
VLF% |
49,2 [37,2;63] 61,5 [45;74,9] |
50,6 [32,9;63,5] 61,8 [44,8;75,3] |
47,4 [32,3;60,9] 65,2 [50;76,7] |
53,9 [34,8;69,4] 66,0 [54,8;79,3] |
37,1 [19,6;50,6] 46,0 [31,6;71,4] |
|
|
p<0,001 |
p<0,001 |
p<0,001 |
p<0,001 |
p<0,001 |
||
|
Z=4,3 |
Z=4,0 |
Z=5,8 |
Z=4,6 |
Z=4,1 |
||
|
LF% |
16,7 [11,0;26,0] 10,9 [7,2;18,6] |
18,8 [11,7;28,9] 12,1 [6,9;24,8] |
19,0 [11,2;32,4] 12,1 [6,9;20,1] |
24,5 [14,9;39,9] 14,4 [9,1;24,3] |
18,5 [10,3;28,8] 12,8 [8,4;22] |
|
|
p<0,001 |
p<0,001 |
p<0,001 |
p<0,001 |
p<0,05 |
||
|
Z=4,8 |
Z=3,9 |
Z=4,4 |
Z=5,3 |
Z=3,1 |
||
|
HF% |
25,4 [17,3;43,2] 20,1 [9,7;37,3] |
25,2 [14,5;41,5] 18,8 [10,3; 31] |
27,2 [17,0; 42,3] 19,3 [8,6;29,5] |
13,4 [7,4;22,6] 11,1 [6,2;26,5] |
39,0 [27,3;56] 29,2 [17,5;46,7] |
|
|
p<0,05 |
p<0,05 |
p<0,001 |
p<0,05 |
p<0,05 |
||
|
Z=2,5 |
Z=2,6 |
Z=4,0 |
Z=2,1 |
Z=3,2 |
||
|
Δ RR (%) |
- |
13,5 [7,9;19,1] 5,2 [2,6;11,5] |
8,2 [4,4;13,9] 5,1 [2,5;8,4] |
-25,3 [-31,4;18,6] -14,5 [-19,1;9,3] |
-21,6 [-27,7;16,05] -12,5 [-18,0;6,2] |
|
|
p<0,001 |
p<0,001 |
p<0,001 |
p<0,001 |
|||
|
Z=9,9 |
Z=5,2 |
Z=8,9 |
Z=7,8 |
|||
|
TAB (с) |
- |
7,6 [6,6; 9,1] 6,9 [5,7; 7,9] |
7,3 [5,7;9,2] 7,3 [5,8;8,3] |
15,7 [13,7;18,3] 17,8 [16,1;21,7] |
35,3 [31,5;39,3] 34,6 [30,4;39,0] |
|
|
p<0,001 |
p<0,001 |
p<0,001 |
p<0,05 |
|||
|
Z=9,7 |
Z=2,8 |
Z=5,6 |
Z=4,5 |
|||
|
Tr (с) |
- |
7,0 [5,5; 9,5] 6,8 [5,3; 8,7] |
10,5 [7,9;14,3] 10,2 [8,1;13,5] |
10,6 [7,8;14,4] 9,5 [7,8;12,2] |
81,2 [70,6;95,9] 72,7 [61,4,88,6] |
|
|
p<0,001 |
p<0,001 |
p<0,001 |
p<0,001 |
|||
|
Z=6,8 |
Z=3,2 |
Z=11,1 |
Z=5,4 |
|||
Результаты анализа включенных в прогностическую модель групп пациентов по степени выраженности дизрегуляций ВСР показали высокое качество распознавания объектов исследования в 94,3%, однако наименьший процент правильной классификации был в отношении начальной АКН. Для увеличения процента распознавания новых объектов исследования с целью их классификации по степени выраженности автономных дизрегуляций СУ сердца, подгруппы АКН1 и АКН2 были объединены, и для дискриминантного анализа сформировалось три группы: 1 - пациенты без вегетативной кардиальной нейропатии (n=216); 2 – с начальной или вероятной АКН (АКН1+АКН2, n=74); 3 - с тяжелой АКН3 (n=20). На основе дискриминантного анализа были построены две прогностические функции (f1, f2) с высокой статистической значимостью как для f1(p<0,0001), так и для f2 (p=0,0027). При использовании полученной модели поочередно проводился расчёт по двум прогностическим функциям f1 и f2, использовались фактические значения всех тех РКГ-показателей, которые вошли в функцию, к ним подставлялись соответствующие значения коэффициентов и констант из приведенной ниже таблицы по формуле:
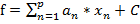 , (1)
, (1)
где p - число входящих в линейную дискриминантную функцию показателей,
xn - фактическое значение n-го по порядку РКГ-показателя (в секундах или %),
an - коэффициент при этом РКГ-показателе, полученный по результатам моделирования,
С – константа (в секундах) из соответствующего столбца таблицы 4.
Объект исследования относили к той степени АКН, для которого функция принимала наибольшее значение, в случае отрицательных значений обеих функций (f1 и f2) делался вывод об отсутствии АКН. Наиболее значимые РКГ–показатели для определения степени выраженности АКН представлены таблице 4.
Таблица 4
Наиболее информативные РКГ-признаки для определения степени тяжести АКН и значения их коэффициентов для линейных дискриминантных функций
|
Показатели |
f1 |
f2 |
|
|
Ph, фон исходный |
VLF(%) |
-0,014 |
-0,036 |
|
Vm, маневр Вальсальвы |
RR(с) |
-8,380 |
-7,520 |
|
Δ RR(%) |
-0,049 |
-0,244 |
|
|
Δ RR (с) |
3,032 |
28,595 |
|
|
ТAB (с) |
-0,089 |
0,116 |
|
|
pA, проба Ашнера |
SDNN(с) |
50,965 |
-8,270 |
|
бl(с) |
-127,325 |
12,029 |
|
|
VLF(%) |
0,039 |
0,001 |
|
|
Aop, активная ортопроба |
ΔRR(%) |
0,282 |
0,104 |
|
ΔRR (с) |
25,351 |
13,416 |
|
|
ТAB в (с) |
0,048 |
0,007 |
|
|
Константа (С) |
7,694 |
6,779 |
|
Проведена проверка адекватности полученной прогностической модели на практике с помощью выборки из новых случаев, представляющих собой экзаменационную выборку из 102 пациентов с СД, впервые прошедших РКГ-исследование в лаборатории нейрокардиологии ЧОКБ. Расчеты проводились по стандартным формулам:
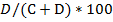 = Чувствительность (%), (2)
= Чувствительность (%), (2)
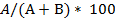 = Специфичность (%), (3)
= Специфичность (%), (3)
где (A) - количество истинных отрицательных диагнозов, составило 40;
(В) - количество ложноположительных диагнозов, составило 18;
(С) - количество ложноотрицательных диагнозов, составило 0;
(D) - количество истинных положительных диагнозов, составило 62.
Чувствительность (2), т.е. доля пациентов, у которых был поставлен диагноз о наличии АКН, составила 100%. Специфичность, т.е. доля пациентов, которые правильно были идентифицированы в группу без АКН, составила 64%. Доля правильной классификации составила 85%, а доля неправильной классификации - 15%. Таким образом, все случаи неправильной классификации были в пользу гипердиагностики АКН. Данная модель может быть актуальной в повседневной клинической практике, особенно при диагностике с учётом опыта, полученного при её тестировании на новой выборке, а именно с ограничением её использования в случае наличий особенностей ВСР в виде дисфункции СУ сердца и/или наличия высокочастотных колебаний, состоящих из низкоамплитудных удлинений 3-5 RR интервалов c «пиком» спектральной плотности в диапазоне 0,2 Гц, названных «непарасимпатические волны» [7; 11].
Выводы
У больных с АКН стабильно снижены все ВСР показатели с наиболее резким снижением парасимпатических влияний в СУ. Ведущим паттерном регуляции стал медленный гуморально-метаболический (VLF%) c угнетением быстрого рефлекторного симпато-парасимпатического влияния (HF%-LF%) в СУ. Научная новизна предпринятого исследования заключается в определении значимости сочетанной патологии для ухудшения параметров ВСР, когда при полиморбидном характере СД особенностью дизрегуляций СУ сердца явилась АКН. Существует практическая значимость впервые разработанной модели автоматизированного определения АКН и степени ее тяжести для своевременного выявления данного осложнения и возможности персонализации терапии у пациента с СД с сопутствующими заболеваниями сердечно-сосудистой системы и почек. Проверка адекватности полученной модели на базе созданной по результатам исследования программы ЭВМ, дополняющей РКГ-анализ, показала ее достаточную чувствительность и специфичность для использования в повседневной клинической практике.



