С каждым годом актуальность проблемы неалкогольной жировой болезни печени (НАЖБП) приобретает новое значение ввиду увеличения числа лиц с ожирением и метаболическим синдромом. В общемировой популяции, согласно результатам исследований, выполненных в период 1989–2015 гг., НАЖБП обнаруживается у 25% населения. По данным исследования Wong и соавт. (2013), распространенность НАЖБП в Азии составляет 15–30% среди общего населения и более 50% у пациентов с диабетом и метаболическим синдромом. В Шри-Ланке по данным Dassanayake и соавт. (2009), ее распространенность довольно высока и составляет 33% в общей численности населения. В Индии, как отмечают Amarapurkar и соавт. (2007), распространенность НАЖБП составляет 9–32% в общей популяции и наиболее часто встречается среди пациентов с избыточным весом / ожирением и диабетом. В Корее, по оценкам исследователей, распространенность НАЖБП составляет от 25 до 30%, и этот показатель неуклонно растет из-за западных привычек питания, чрезмерного потребления пищи, изменений в образе жизни, увеличения численности пожилого населения и общего недостатка физических упражнений [1; 2]. Многие зарубежные исследователи обнаружили тесную связь НАЖБП с ожирением, инсулинорезистентностью (ИР) / сахарным диабетом 2 типа (СД2) и метаболическим синдромом. В своих исследованиях Bellentani и Tiribelli (2001) отмечают, что у индивидов с избыточным весом распространенность стеатоза в два раза чаще, чем у индивидов с низкой массой тела. Установлено, что при ожирении почти у всех пациентов присутствует стеатоз, и более чем треть людей с ожирением страдает неалкогольным стеатогепатитом (НАСГ) [1; 2].
Биологические механизмы НАЖБП, приводящие к внепеченочным заболеваниям, полностью не установлены. Тем не менее совокупные данные убедительно свидетельствуют о том, что периферическая резистентность к инсулину, дислипидемия и активация воспалительных путей, связанных с НАЖБП, имеют отношение к развитию внепеченочных заболеваний, в том числе к СД 2 типа. Некоторые исследования показали, что периферическая резистентность к инсулину и дислипидемия являются факторами риска развития желчнокаменной болезни [2].
В настоящее время, как наиболее распространенная причина хронических заболеваний печени, НАЖБП нуждается в ранней профилактике, такой как физические упражнения и изменение образа жизни, так как при ее отсутствии данная патология может привести к развитию стеатогепатита, фиброза печени, цирроза и гепатоцеллюлярной карциномы.
Исследованиями установлено, что пациенты, имеющие в анамнезе неалкогольный стеатогепатит, по сравнению с общей популяцией чаще демонстрируют смертность от печёночной недостаточности болезней. Важную роль в развитии НАЖБП играют генетические и экологические факторы. При этом НАЖБП была самой частой патологией в структуре заболеваний печени в России: по данным на 2014 г., диагностирована в 72% случаев. В числе пациентов с диагнозом НАЖБП у 77% наблюдался стеатоз печени, у 23% - неалкогольный стеатогепатит (НАСГ), у 3% диагностирован цирроз печени [3-5].
При помощи метода «ассоциативное тестирование всего генома» (GWAS) были проведены исследования, целью которых являлось определение значимости отдельных сайтов SNP, для которых предполагалась связь с НАЖБП и метаболизмом липидов. Результаты исследований продемонстрировали, что ключевую роль в развитии НАЖБП вне зависимости от региона и этнической составляющей выполняют гены PNPLA3, KLF6, GCKR, LYPLAL1. На сегодняшний день SNP rs58542926 в локусе TM6SF2 является одним из трех основных генов наряду с PNPLA3 и GCKR, ассоциированных с НАЖБП. Первым доказанным геном, который ассоциируется с НАЖБП, является PNPLA3. Он влияет на уровень ферментов печени в плазме. Аллель G полиморфизма rs738409 гена PNPLA3 сильно связана с НАЖБП, а также с увеличением показателей AСТ и AЛТ, уровня ферритина и стадии фиброза у пациентов с НАЖБП. PNPLA3 в основном экспрессируется в печени и обладает липазной активностью триацилглицерина. Мутация I148M связана со сниженной активностью триглицерид-липазы, как показано в исследованиях с рекомбинантным белком PNPLA3. Это приводит к накоплению триглицеридов в клетках печени, но уменьшает выделение липопротеинов очень низкой плотности (VLDL) в кровообращение [6-8].
Вариант TM6SF2 ассоциируется со стеатозом и фиброзом у пациентов с НАЖБП. Анализ пациентов с хроническим вирусным гепатитом С показал, что SNP rs58542926 усиливает фиброгенез печени и совместно с вирусным заболеванием может способствовать прогрессированию заболевания печени и атеросклероза [9]. Распространенность полиморфизма rs58542926 гена TM6SF2 в мире представлена на рисунке 1.
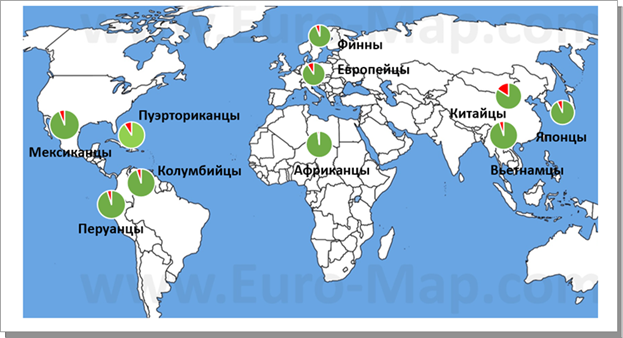
Рис. 1. Частота встречаемости аллелей полиморфизма rs58542926 гена TM6SF2 в различных популяциях, по данным Ensembl.org. Красным цветом обозначен аллель Т, зеленым цветом обозначен аллель С
Полиморфизм rs58542926 представляет собой нуклеотидную замену гуанина на аденин в гене TM6SF2, что в свою очередь приводит к замене глутаминовой кислоты лизином в 167 (E167K) аминокислотном остатке.
На данный момент исследования полиморфизма rs58542926 гена TM6SF2 в популяции якутов не проводились.
Цель исследования: анализ распространенности полиморфного варианта rs58542926 гена TM6SF2 в якутской популяции.
Материалы и методы исследования
Исследование полиморфизма rs58542926 гена TM6SF2 было проведено в лаборатории наследственной патологии отдела молекулярной генетики Якутского научного центра комплексных медицинских проблем (ЯНЦ КМП). Всего было исследовано 142 образца ДНК, 48 образцов ДНК индивидов, имеющих в анамнезе хронические неинфекционные заболевания печени, и 94 образца ДНК здоровых добровольцев. Информированное согласие на проведение генетического исследования было получено от каждого участника исследования. Все участники исследования по этнической принадлежности были якутами и проживали на территории РС (Я). Всем участникам исследования проведено комплексное клинико-функциональное обследование в больнице ЯНЦ КМП.
Выделение ДНК из лимфоцитов периферической крови проводилось с помощью набора для выделения из цельной крови фирмы ООО «Excell Biotech» (г. Якутск, Россия). Однонуклеотидный полиморфизм определяли методом полимеразной цепной реакции (ПЦР) с последующим анализом полиморфизма длин рестрикционных фрагментов (ПДРФ). Амплификация области гена, содержащего полиморфный вариант, проводилась стандартными парами праймеров производства «ООО Биотех-Индустрия» (г. Москва, Россия). Реакционная смесь для ПЦР содержала: праймер прямой и обратный по 10 пикомоль/мкл (1 мкл); Dream Taq PCR мастер микс - 12,5 мкл; деионизированной воды 9,5 мкл и ДНК в количестве 100 мкг/мл – 1 мкл. Общий объем реакционной смеси для амплификации составил 25 мкл. Смесь для ПДРФ объемом 20 мкл состояла из: амплификата - 7 мкл, деионизированной воды - 10,9 мкл, рестрикционного буфера - 2 мкл и эндонуклеазы рестрикции Hpy188I (2 е.а.).
Температурно-временной режим для проведения ПЦР оптимизирован для амплификации данной нуклеотидной последовательности и представлен в таблице 1.
Таблица 1
Условия проведения ПЦР
|
Ген |
Амплификат |
Условия проведения ПЦР |
|
TM6SF2 |
429 п.н. |
1. 94 °С – 10 мин. 2. (94 °С – 1 мин.; 62 °С – 40 сек.; 72 °С – 1 мин.) - 40 циклов 3. 72 °С – 10 мин. |
Примечания: п.н. – пар нуклеотидов.
Детекция ПЦР продуктов проводилась с помощью горизонтального электрофореза в пластине 2% агарозного геля с добавлением бромистого этидия - специфического интеркалирующего флуоресцентного ДНК(РНК)-красителя - с использованием стандартного трис-ацетатного буфера при напряженности поля ~20 В/см в течение 30 минут.
Детекция ПДРФ продуктов проводилась с помощью горизонтального электрофореза в 4% агарозном геле окрашенным бромистым этидием с использованием стандартного трис-ацетатного буфера (1%) при 120 В в течение 1 часа (рис. 2).
Интерпретация результатов генотипирования была выполнена на основе различных шаблонов бэндов: CC-178, 166, 85 п. н.; TT-251, 178 п.н. и CT- 251, 178, 166, 85 п.н., и представлена на рисунке 2.
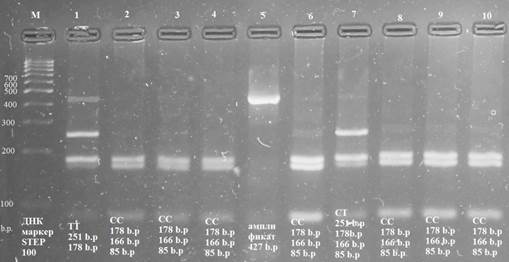
Рис. 2. Результаты электрофореза в 4% агарозном геле. М – маркер, с 1 по 10 лунки - расположены рестриктазы, в 5 лунке – амплификат
Примечание: b.p (base pairs) - пар нуклеотид.
Статистический анализ полученных результатов исследования был проведен с помощью программы Office Microsoft Excel 2010. Соответствие распределений генотипов ожидаемым значениям при равновесии Харди-Вайнберга и сравнение частот аллельных вариантов/генотипов проводили с использованием критерия X (хи-квадрата) методом Пирсона для таблиц сопряженности 2x2, расчетом отношения шансов (OR), 95% доверительного интервала (95% CI). Различия считались достоверными при P<0,05.
Результаты исследования и их обсуждение
Сравнительный анализ распределения аллелей полиморфизма rs58542926 гена TM6SF2 установил, что группа больных, так же как и группа здоровых, характеризовалась преобладанием носителей аллеля С 62% и 88% соответственно (табл. 2).
Таблица 2
Распределение встречаемости генотипов и аллелей полиморфизма rs58542926 в группах больных и контрольной выборки
|
Генотипы, аллели |
Больные (n = 48), (%) |
Контрольная выборка (n =94), (%) |
Х2 |
OR (95% CI) |
Значимость, p |
|
для аллеля Т |
|||||
|
С/С |
54,17 |
81,91 |
20,691 |
5.257 (2.862-9.654) |
0,000* |
|
С/T |
14,58 |
13,83 |
|||
|
T/T |
31,25 |
4,26 |
|||
|
С |
64,7 |
88,8 |
27,636 |
0,000** |
|
|
T |
35,3 |
11,2 |
Примечание. Достигнутый уровень значимости при сравнении распределения генотипов (*) и частоты аллелей (**) в группах сравнения больных и контрольной выборки; n – численность выборок, Х2 с поправкой Йейтса.
Сравнительный анализ генотипов в группах больных и здоровых выявил преобладание лиц с генотипом СС (54% и 82% соответственно). При этом генотип ТТ достоверно чаще встречался в группе лиц с хроническими неинфекционными заболевания печени (31%, p≤ 0,005). Значение OR (95% CI) для аллеля Т составило 5,257 (2,862-9,654), для гомозиготного генотипа ТТ 10,227 (3,165- 33,047).
Исследования Liu Y. и соавт. (2014) подтвердили ассоциацию между полиморфизмом rs58542926 гена TM6SF2 и НАЖБП в мультиэтнических группах как у взрослых, так и детей [10]. Wang и соавт. [11] в исследовании 768 пациентов с диагнозом НАЖБП и здоровых индивидов китайской популяции установили, что, несмотря на свою низкую частоту, аллель Т был достоверно связан с НАЖБП (р<0,001). Аналогично в более раннем исследовании Wong и соавт. сообщили, что вариант аллеля Т гена TM6SF2 был обнаружен у четырех китайских индивидов из 920. Все четверо характеризовались повышенным содержанием печеночного жира, а у двух из них наблюдалась НАЖБП. Эти результаты были воспроизведены в когорте из 300 финских индивидов. Содержание жира в печени у анализируемых индивидов было значительно выше у носителей аллеля Т по сравнению с носителями противоположного аллеля. В исследовании 226 пациентов с гистологически подтвержденной НАЖБП в Аргентине Sookoian с коллегами обнаружили, что полиморфизм rs58542926 гена TM6SF2 был тесно связан со степенью стеатоза печени, измеренной биопсией печени; и независимо от возраста, пола, индекса массы тела (ИМТ) и полиморфизма PNPLA3 I148M [11]
В исследовании 1074 пациентов европейских национальностей с гистологически подтверждённым НАЖБП разной стадии Sookoian S. и соавт. (2015) обнаружили, что полиморфизм rs58542926 гена TM6SF2 был достоверно (р=0,037) связан с повышенным риском выраженного стеатоза [12].
По данным исследования Liu Y.L. и соавт. (2014), носительство Т-аллеля предрасполагает к НАЖБП, в то время как носительство С-аллеля способствует выведению липопротеидов очень низкой плотности (ЛПОНП) из печени, таким образом защищая печень за счет повышенного риска сердечно-сосудистых заболеваний (ССЗ) [12]. Полученные результаты согласуются с данными других исследований. В исследованиях Kozlitina J. и соавт. (2014) была обнаружена значимость полиморфизма rs58542926 гена TM6SF2 в развитии НАЖБП в трех независимых популяциях (n>80000). Авторы установили связь носительства аллеля T с более высоким циркулирующим уровнем аланиновой трансаминазы, маркера поражения печени и более низким содержанием липопротеидов низкой плотности (ЛПНП), триглицеридов и щелочной фосфатазы [13].
Заключение
Таким образом, в результате проведенного исследования установлено, что популяция якутов характеризуется преобладанием аллеля С rs58542926 гена TM6SF2. Среди лиц, имеющих в анамнезе хронические неинфекционные заболевания печени, преобладали носители генотипа ТТ rs58542926 гена TM6SF2, предрасполагающего к развитию неалкогольной жировой болезни печени (НАЖБП). Высокая частота носителей генотипа TT, вероятно, связана с недостаточным количеством исследуемых по выборке (n=48).
Исследование данного полиморфизма rs58542926 гена TM6SF2 требует дальнейшего изучения на более крупных выборках популяций Якутии.



