Рак пищевода на протяжении многих лет продолжает оставаться одной из самых агрессивных опухолей ЖКТ, занимая 6-е место среди показателей онкологической смертности и составляя 4,9% от общего количества смертей, вызванной онкологической патологией [1]. В большинстве случаев выявление рака пищевода на ранних стадиях затруднено, несмотря на широкое распространение высокоразрешающей эндоскопической диагностики, по причинам поздней обращаемости за медицинской помощью, агрессивности течения опухолевого процесса и отсутствия программ скрининга населения. Наряду с дооперационным уточнением степени инвазии карциномы в стенку органа количественное выявление вовлеченности в метастатический процесс регионарных лимфоколлекторов является основой стадирования рака пищевода. Объективизация клинической стадии эзофагеальной карциномы определяет выбор лечебной стратегии, показания и схемы неоадъювантной терапии, определяет объем лимфодиссекции и предварительный прогноз для жизни пациента. На современном этапе совокупность диагностических методов клинического стадирования N-статуса рака пищевода включает эндоскопическую ультрасонографию (ЭУС) [2-4], тонкоигольную аспирационную биопсию под ЭУС-контролем (ЭУС-ТАБ), трепан-биопсию под ЭУС-контролем [2; 5], эндобронхиальное ультразвуковое исследование (ЭБУС) [6; 7], позитронно-эмиссионную компьютерную томографию (ПЭТ-КТ) [8; 9], которые являются основой клинического дооперационного определения критерия N у больных. Несмотря на постоянное совершенствование существующих и внедрение новых методов диагностики местной распространённости опухолевого процесса, каждый из перечисленных методов имеет свои пределы чувствительности и специфичности, характерные недостатки и ограничения. В этой связи отмечаются значительные расхождения клинических и патогистологических стадий рака пищевода с тенденцией к «недостадированию» ранних и локализованных форм (T1-2N0M0) и «перестадированию» местнораспространенных форм пищеводной карциномы по критерию N, что подтверждается морфологическими заключениями [9-11]. По данным различных авторов, в 30-57% лимфатических узлов, признанных метастатическими по данным CКТ, патоморфологами выявляется лишь доброкачественная гиперплазия [8]. А в ряде случаев, ввиду невозможности проведения эхоэндоскопа в пищевод за опухолевую стриктуру, исследование остается незавершенным, что снижает чувствительность и специфичность ЭУС до 50% [12]. На сегодняшний день показатели диагностической эффективности внутрипросветной ультрасонографии, по данным мировой литературы, в вопросах клинического, дооперационного стадирования рака пищевода весьма вариабельны. Точность методики составляет 66-90%, а чувствительность и специфичность 42% и 93% соответственно [4; 13]. При этом не существует универсального исследования и диагностического алгоритма применения лучевых методик в рамках дооперационного стадирования местной распространенности эзофагеальной карциномы. Порядок, в котором они используются, является нерегламентированным и зависит возможности каждого конкретного лечебного учреждения, занимающегося данной проблемой. Рассмотренные методики не позволяют получить полноценное представление о количественном и пространственном распространении лимфогенных метастазов рака пищевода, а лишь дополняют друг друга [3; 14]. Методики математико-пространственного объединения неинвазивных методик, компенсирующих недостатки их изолированного применения, на современном этапе остаются недостаточно реализованы. В современной публикации H. Kikuchi с соавт. (2018) показано, что дооперационное стадирование с построением трехмерной пространственной (3D) модели средостения и верхнего этажа брюшной полости помогает хирургам выполнять эзофагэктомию с лимфодиссекцией с более благоприятным прогнозом течения раннего и позднего послеоперационного периода, улучшая отдаленную выживаемость [6]. Однако в мировой литературе описаны единичные попытки совмещения графических данных ЭУС и СКТ для N-стадирования рака желудка [15].
Цель исследования: оценить эффективность изолированного использования спиральной компьютерной томографии, эндоскопической ультрасонографии и 3D-моделирования средостения и верхнего этажа брюшной полости на основе интеграции графических данных СКТ и ЭУС в клиническом N-стадировании рака пищевода.
Материал и методы исследования. В работе представлен сравнительный анализ эффективности использования трех методов оценки лимфогенного метастазирования рака пищевода у 198 больных. Использование изучаемых диагностических модальностей для дооперационного N-стадирования пищеводной карциномы предусматривало верификацию регионарных лимфоузлов с признаками их метастатического поражения и подсчетом абсолютного числа метастатических узлов в количестве от 0 до 7. Интерпретация степени выраженности метастатической лимфаденопатии по градациям от сN0 до сN3 оценивались согласно классификации TNM 8 пересмотра (2017 г.). Спиральная компьютерная томография груди и живота с внутривенным трехфазным контрастным усилением выполнена всем 198 больным. Эндоскопическая ультрасонография с использованием радиального ультразвукового эхоэндоскопа UM160 и процессора ME-2 фирмы Olympus с применением режимов доплеровского сканирования проведена 112 пациентам. 3D-моделирование средостения и верхнего этажа брюшной полости на основе интеграции графических данных ЭУС и СКТ (способ дооперационной оценки лимфогенного метастазирования рака пищевода и желудка – патент РФ № 2653807 от 27.06.2016) произведено у 91 больного исследуемой выборки. Всем 198 больным выполнена резекция пищевода с последующим патоморфологическим стадированием опухолевого процесса. Верификация распространенности карциномы по критериям pTNM принималась в качестве «золотого стандарта» при оценке информативности методик дооперационного стадирования.
При совпадении данных, полученных с помощью изучаемой клинической методики стадирования, свидетельствующих об отсутствии признаков лимфогенного метастазирования, с результатами патоморфологического исследования фиксировался истинно-отрицательный (ИО) результат. При совпадении клинических данных о количестве пораженных метастазами лимфоузлов в интервалах n=1-2, n=3-6, n=≥7 с данными гистологического исследования о количестве пораженных метастазами 1-2, 3-6, ≥7 лимфоузлов соответственно, регистрировался истинно-положительный (ИП) результат по градациям N1, N2 и N3 соответственно. При занижении изучаемой лучевой методикой числа выявленных лимфогенных метастазов ниже пределов указанных интервалов регистрировался ложноотрицательный (ЛО) результат, а при завышении интервального значения – ложноположительный (ЛП). По количеству ИО, ИП, ЛО, ЛП результатов для вышеуказанных методик клинического стадирования рассчитывались показатели чувствительности (ИП/ИП+ЛО), специфичности (ИО/ИО+ЛП), точности (ИО+ИП/ИП+ИО+ЛО+ЛП) с 95% доверительным интервалом, а также проводился анализ классификации кривых ошибок или ROC-кривых с использованием количественного показателя площади под ROC-кривой (AUC). Согласно классификации экспертной шкалы значение AUC в пределах 0,5-0,6 интерпретировалось как непригодное качество моделирования. Показатель AUC 0,6-0,7 расценивался как среднее качество диагностической модели; 0,7-0,8 – хорошее качество предсказания; а больше 0,8 – как очень хороший метод диагностики.
Распределение больных изучаемой когорты по градациям cN согласно методикам стадирования рака пищевода представлено в таблице.
Распределение больных раком пищевода по градациям N-критерия в зависимости от методик стадирования
|
Степень регионарного метастазирования РП по TNM 8th ed, 2017 |
Методика стадирования cN по данным |
Методика стадирования pN по патоморфологическим данным |
||
|
СКТ |
ЭУС |
3D-модель |
||
|
N0 |
71 (35,8%) |
32 (28,6%) |
29 (35,2%) |
47 (23,7%) |
|
N1 |
24 (12,1%) |
22 (11,1%) |
17 (18,4%) |
43 (21,7%) |
|
N2 |
36 (18,2%) |
24 (21,4%) |
19 (20,6%) |
45 (22,7%) |
|
N3 |
64 (33,9%) |
34 (38,9%) |
26 (25,8%) |
63 (31,9%) |
|
Точность |
44,2% |
64,6% |
75,8% |
100% |
Как видно из таблицы, при сравнении числа истинно-положительных результатов выше представленных методов дооперационного стадирования наиболее высокий показатель точности – 75,8%, встречается при использовании методики 3D-моделирования, что говорит о важности использования интегрированного подхода к оценке графических данных предоперационных методов N-стадирования.
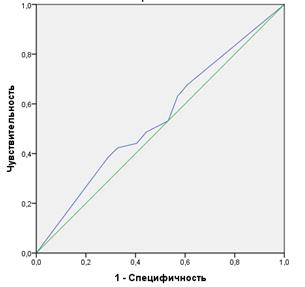
Результаты исследования и их обсуждение. При анализе операционных характеристик трех изучаемых диагностических методик в оценке лимфогенной распространенности рака пищевода были получены следующие результаты: диагностическая эффективность СКТ по моделированию N-критерия была оценена как неудовлетворительная по показателю AUC=0,543, расчетной чувствительности и специфичности методики 47,7% и 39,2% соответственно. Расчеты площадей под ROC-кривой показали среднее качество моделирования N-статуса c применением ЭУС (AUC=0,696; порог отсечения при максимальной суммарной чувствительности и специфичности = 0,35) (рисунок 1).
|
AUC |
Стандартная ошибкам |
Асимптотическая знч.b |
Асимптотический 95% ДИ |
|
|
Ниж. граница |
Верх. граница |
|||
|
Переменные результата проверки: cN СКТ |
||||
|
0,543 |
0,042 |
0,313 |
0,460 |
0,626 |
|
Переменные результата проверки: cN ЭУС |
||||
|
0,696 |
0,047 |
0,000 |
0,604 |
0,797 |
Рис. 1. Кривые операционных характеристик (ROC-кривые) СКТ и ЭУС в определении сN-статуса с переменными результатов проверки AUC
Согласно рисунку 1, более оптимистичные результаты дооперационного N-стадирования рака пищевода показала эндоскопическая ультрасонография, имеющая среднее качество диагностической процедуры. Чувствительность и специфичность данной методики в оценке N-статуса составила 65,3% и 63,0%. Рассчитанные в нашем исследовании показатели диагностической эффективности ЭУС ниже общемировых, что может объясняться невозможностью в ряде случаев проведения радиального эхоэндоскопа за опухолевую стриктуру. Снижению операционных характеристик метода также способствовало отсутствие в нашей работе технической возможности выполнения тонкоигольной аспирационной биопсии при подозрении на опухолевое поражение различных анатомических структур средостения.
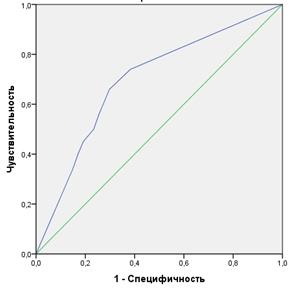
Третий метод 3D-моделирования на основе интегрирования графических данных ЭУС и СКТ средостения верхнего этажа брюшной полости показал значительное увеличение диагностической ценности в стадировании N-критерия по сравнению с вышеописанными изолированно применяемыми методиками. Показатель AUC = 0,842 с порогом отсечения = 0,46 свидетельствует об очень хорошем качестве моделирования N-статуса и о диагностической ценности исследования (рисунок 2). Чувствительность и специфичность методики составляет 77,4% и 72,4% при выявлении градаций метастатически пораженных лимфоузлов при общей точности 75,8%. Данные показатели можно объяснить тем, что методика 3D-моделирования превосходит СКТ и ЭУС за счет возможностей псевдоцветного картирования анатомических структур средостения, прецизионного измерения размера, разграничения мозгового и коркового слоя лимфоузла. Реализуя потенциал вращения и масштабирования модели в различных плоскостях, нивелируются отрицательные стороны ЭУС и СКТ, такие как операторозависимость, отсутствие объемного представления, четкой контрастности объектов и их топографо-анатомической «привязанности» к определенному сегменту средостения. Агрегация положительных эффектов вышеописанных диагностических методов способствует «топографической» локализации лимфоузлов с возможностью определения их структуры при помощи внутрипросветной ультрасонографии.
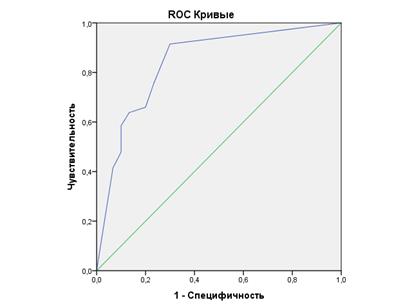
|
AUC |
Стандартная ошибкаa |
Асимптотическая знч.b |
Асимптотический 95% ДИ |
|
|
Нижняя граница |
Верхняя граница |
|||
|
Переменные результата проверки: cN 3D-модель |
||||
|
0,842 |
0,044 |
0,000 |
0,755 |
0,929 |
Рис. 2. Кривая операционных характеристик 3D-модели в определении сN-статуса и переменные результата проверки площади под кривой (AUC)
Выводы. По показателям чувствительности, специфичности, точности, операционным характеристикам сравниваемых методик (СКТ, ЭУС и 3D-моделирования) 3D-моделирование средостения и верхнего этажа брюшной полости является наиболее эффективным способом клинического N-стадирования рака пищевода с наибольшей диагностической ценностью за счет эффекта усиления «положительных» сторон и нивелирования недостатков спиральной компьютерной томографии и эндоскопической ультрасонографии.



