Для успешного лечения той или иной нозологической формы необходимо воздействие на причинно-следственную связь ее формирования в самом начале этого пути, т.е. на причину, которая во многих случаях кроется именно на уровне клетки, ее органелл, молекул и ДНК [1].
В офтальмологии мы ежедневно сталкиваемся с недостатком донорского материала и с низким его качеством [2]. Проблемы гистосовместимости не позволяют использовать любую часть донорского глаза в качестве материала для трансплантации и вынуждают использовать иммуносупрессивную терапию, имеющую ряд нежелательных побочных эффектов [3, 4]. Большое количество офтальмологических заболеваний не поддается лечению хирургическими методами или стандартной медикаментозной терапии, так как часто причина болезни кроется на уровне клетки или отдельного гена, что диктует необходимость совершенствования методов клеточной терапии и углубления исследований, проводимых в этом направлении.
Мультипатентные мезенхимальные стромальные клетки (ММСК) играют важную роль в структурном и функциональном равновесии в тканях и репаративном ремоделировании. Спектр растворимых цитокинов, продуцируемых ММСК, очень широк и включает молекулы, обладающие иммуномодуляторными, проангиогенными, стромаобразующими, хемоаттрактивными, антиапоптотическими и другими эффектами. Благодаря своим уникальным свойствам ММСК приобретают все большее значение в терапевтической и хирургической офтальмологии [5, 6]. ММСК человека признаются одним из самых перспективных видов клеточного материала для лечения большого спектра заболеваний и тканевой инженерии с крайне низкой возможностью спонтанной злокачественной деформации при непродолжительном культивировании вплоть до 4–5 пассажей [7-9].
Цель исследования: повысить качественный и количественный показатель «выхода» клеточной массы ММСК из фрагментов донорского лимба в процессе их культивирования.
Материал и методы исследования
В качестве источника ММСК брались аллогенные фрагменты лимба от 10 неинфицированных трупов-доноров обоих полов в возрасте от 18 до 30 лет (средний возраст 24,9 М±3,90), получаемые при хирургическом выделении лимба во время заготовки роговично-склеральных дисков с целью трансплантации, причем фрагменты лимба, выделенные из правого глаза, составляли контрольную группу (n=10), а полученные из левого глаза – опытную (n=10).
Культивация ММСК, полученных из аллогенных фрагментов донорского лимба, проводилась по методике, описанной в Патенте РФ № 2475218 (С.А. Борзенок, Б.Э. Малюгин, Х.Д. Тонаева и соавт., 2013) (контроль), хирургическое выделение лимбальных трансплантатов проводили из цельного трупного донорского глазного яблока, исключая его перфорацию, органо-типическую консервацию проводили при температуре 37°C в СО2-инкубаторе при 5%-ном содержании СО2 в среде 199 на солях Хенкса, дополнительно содержащей (на 1000 мл) декстран 40000 – 50 г, HEPES 1M – 15 мл, 7,5%-ный раствор бикарбоната – 10 мл, 40%-ный раствор глюкозы – 5 мл, L-глутамин – 1,5 г, инсулин – 0,8 мл, дексаметазон с молярностью 10-8 – 1 мл, амфотерицин В – 1,4 мг, пенициллин – 250000 Ед., стрептомицин – 200 мг и сыворотку крови крупного рогатого скота – 100 мл [10].
Замену питательной среды проводили 1 раз в 3 дня, при этом осуществлялось удаление неадгезированных клеток. Перед каждой заменой питательной среды проводили микроскопию с помощью инвертированного микроскопа Nikon Eclipse TS100 и оценивали морфологические свойства клеток, отмечали время «выхода» клеток ММСК из лимбальных фрагментов и их прикрепления ко дну культурального планшета.
После получения монослоя клеток ММСК на культуральном планшете клетки подвергали пассированию. Пассаж производили по стандартной методике путем внесения в культуральные планшеты 0,05% трипсин + ЭДТА и последующего выдерживания в инкубаторе в течение 1 часа до открепления клеток от культурального пластика с контролем этого процесса посредством инвертированного микроскопа. Затем взвесь клеток центрифугировали при 1000 оборотах в течение 5 минут, а надосадочную жидкость сливали и добавляли в пробирки 1 мл ростовой среды, осадок ресуспендировали. После этого проводили подсчет концентрации клеток на автоматическом счетчике TC20 (Bio-Rad). Затем клетки вносились в культуральный флакон 25 см2 с 10 мл ростовой среды в количестве 1х106 на планшет. Затем проводилась культивация в СО2-инкубаторе в стандартных условиях 14 дней с заменой питательной среды каждые 3 дня.
Результаты исследования и их обсуждение
Модифицированный состав питательной среды, применяемой с целью культивации ММСК, полученных при нормотермической консервации аллогенных фрагментов лимба, следующий (опыт): среда DMEM/F12, содержащая дополнительно (на 1000 мл) декстран 40000 – 50 г, инсулин – 0,8 мл, HEPES 1M – 15 мл, 7,5%-ный раствор бикарбоната натрия – 10 мл, 40%-ный раствор глюкозы – 10 мл, L-глутамин – 1,5 г, дексаметазон с молярностью 10-8 – 0,5 мл, амфотерицин В – 1,4 мг, пенициллин – 250000 Ед., стрептомицин – 200 мг и фетальную лошадиную сыворотку – 200 мл.
При культивации лимбальных трансплантатов контрольной группы в среднем на 7,8-е сутки (разброс составил от 7 до 9 суток) культивации происходил «выход» адгезирующихся к пластику клеток за пределы лимбального фрагмента (табл. 1, рис. 1).
Таблица 1
Средние сроки формирования монослоя клетками лимбальной зоны роговицы, культивированными на контрольной и опытной культуральной среде
|
Группа |
№ образца |
Возраст донор лимба, лет |
Выход клеток на культуральный пластик, сутки культивации |
Формирование клетками монослоя, сутки культивации |
Количество клеток, полученных с планшета 25 см2 |
|
Контроль, n=10 |
К1 |
18 |
7 |
23 |
1,21 х 106 |
|
К2 |
21 |
8 |
23 |
1,38 х 106 |
|
|
К3 |
23 |
8 |
24 |
1,43 х 106 |
|
|
К4 |
25 |
8 |
25 |
1,30 х 106 |
|
|
К5 |
27 |
7 |
23 |
1,61 х 106 |
|
|
К6 |
30 |
8 |
24 |
1,12 х 106 |
|
|
К7 |
22 |
7 |
23 |
1,73 х 106 |
|
|
К8 |
27 |
9 |
30 |
1,01 х 106 |
|
|
К9 |
26 |
7 |
23 |
1,68 х 106 |
|
|
К10 |
30 |
9 |
26 |
9,76 х 105 |
|
|
Опыт, n=10 |
О1 |
18 |
6 |
25 |
2,30 х 106 |
|
О2 |
21 |
6 |
22 |
2,23х 106 |
|
|
О3 |
23 |
6 |
22 |
1,63 х 106 |
|
|
О4 |
25 |
5 |
20 |
2,26 х 106 |
|
|
О5 |
27 |
7 |
25 |
1,78 х 106 |
|
|
О6 |
30 |
6 |
22 |
2,15 х 106 |
|
|
О7 |
22 |
5 |
20 |
2,17 х 106 |
|
|
О8 |
27 |
6 |
20 |
1,83 х 106 |
|
|
О9 |
26 |
7 |
27 |
1,71 х 106 |
|
|
О10 |
30 |
5 |
21 |
1,96 х 106 |

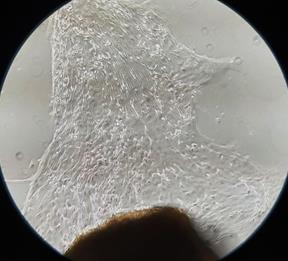
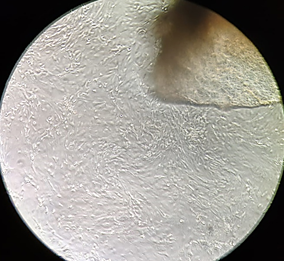

Рис. 1. Участок культивируемого лимбального трансплантата и клетки ММСК, прикрепленные к планшету. 7-е сутки культивации (А. контроль) и 5-е сутки культивации (Б. опыт). Фазово-контрастная микроскопия, ув. х100
При использовании модифицированного состава питательной среды (опыт) «выход» и адгезия клеток происходили немного раньше, в среднем на 5,9-е сутки (разброс составлял от 5 до 7 суток) культивации (рис. 1 Б). Причем отмечались значительно меньшее количество неадгезированных шаровидных клеток, а также меньшая вакуолизация цитоплазмы.
Часть клеток имела фибробластоподобную (рис. 2 А), вытянутую форму, часть – полигональную (по-видимому, эпителиоциты), и часть клеток представляла собой пул округлых (рис. 2 Б), неприкрепленных клеток с ровной поверхностью, четко очерченным ядром, занимающим большую часть цитоплазмы. Все клетки имели множество цитоплазматических гранул, включений и вакуолей, представляющих собой митохондрии, рибосомы и другие органоиды. Вакуоли же свидетельствовали об обводнении цитоплазмы, по-видимому, за счет перестройки и адаптации клеток к новым условиям существования и питания.

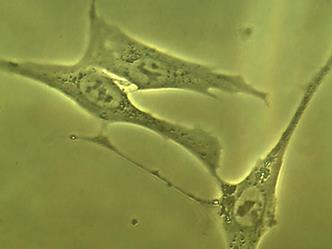
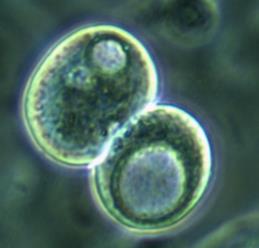

Рис. 2. Адгезированные (А) и неадгезированные (Б) клетки, вышедшие из участка культивируемого лимбального фрагмента. Фазово-контрастная микроскопия, ув. х400
В процессе культивирования все неприкрепившиеся клетки удалялись при смене культуральной среды каждые 3 дня.
В зависимости от использованной опытной или контрольной культуральной среды разнились и сроки достижения клетками монослоя. Так, в контрольной группе образцов клетки достигали монолоя в среднем к 24,4-м суткам (с разбросом от 23 до 30 суток) культивации. Во всех образцах контрольной группы клеточный монослой был достаточно неоднороден по форме и морфологии клеток, его образующих; встречались поля фибробластоподобных и полигональных клеток (рис. 3 А). Клетки имели выраженную грануляризацию цитоплазмы, четко очерченные крупные ядра с ядрышками, что говорит о высокой функциональной активности клеток.

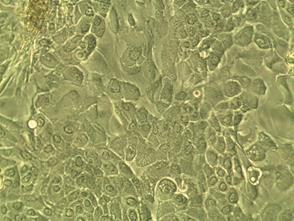


Рис. 3. Монослой клеток ММСК, прикрепленных к планшету. 23-е сутки культивации (А. контроль) и 20-е сутки культивации (Б. опыт). Фазово-контрастная микроскопия, ув. х200
В опытной группе образцов достижение клетками монослоя происходило немного раньше, в среднем к 22,4-м суткам (разброс составил от 20 до 27 суток) культивации (рис. 3 Б). Большинство клеток имели вытянутую фибробластоподобную форму, меньшую вакуолизацию цитоплазмы по сравнению с контрольной группой, а также менее выраженную грануляцию цитоплазмы. В большинстве клеток можно было визуализировать ядро с ядрышком.
При достижении монослоя клетки подвергались первому пассажу на культуральный флакон 25 см2. Сразу после проведения первого пассажа клетки были шаровидной формы, в большинстве – с хорошо заметным рельефом поверхности (рис. 4). Значительную часть цитоплазмы у пассированных клеток занимало ядро, в некоторых ядрах было заметно ядрышко, в цитоплазме располагались многочисленные округлые гранулы, очевидно, являющиеся митохондриями, вакуолями, лизосомами и другими органеллами.
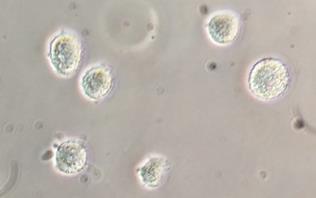
Рис. 4. Фазово-контрастная микроскопия клеток лимбальной зоны роговицы сразу после первого пассажа, ув. х100
На следующие сутки после проведения пассажа большинство клеток адгезировались к культуральному пластику, имели многочисленные выросты и приобретали узкую вытянутую форму (10–15 мкм в толщине и 20–30 мкм и более по длине), крупные, хорошо очерченные ядра с ядрышками, визуализировалась эндоплазма с гранулами (органеллами и включениями) (рис. 5).

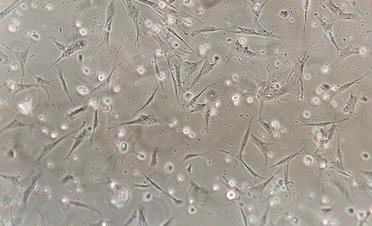
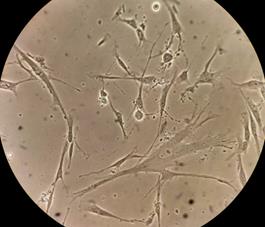

Рис. 5. Фазово-контрастная микроскопия ММСК на следующий день после пассажа.
Ув. х100 (А) и х400 (Б)
Следует отметить, что количество адгезированных клеток было значительно выше в опытной группе образцов. А формирование сплошного монослоя с более чем 90%-ной конфлюэнтностью пассированными клетками достигалось к 7–8-м суткам культивации в контрольной группе и к 5–7-м суткам – в опытной группе.
Заключение. Использование в качестве базового компонента для ростовой среды DMEM/F12 (среда Игла в модификации Дульбекко с добавлением питательных веществ F-12 в соотношении 1:1), а также увеличение содержания глюкозы и фетальной сыворотки в два раза позволяют значительно повысить содержание витаминов, аминокислот и ростовых факторов по сравнению с контрольной питательной средой, предназначенной для культивации клеток лимбальной зоны роговицы глаза человека. Это привело к ускорению «выхода» адгезионных клеток из аллогенных фрагментов лимба, уменьшило вакуолизацию цитоплазмы клеток, а также форсировало формирование этими клетками сплошного и однородного монослоя с более чем 90%-ной конфлюэнтностью.
После проведения первого пассажа клетки опытной группы обладали большей скоростью пролиферации и обеспечивали раннее формирование монослоя уже на 5-е сутки культивации.



