Рак шейки матки (РШМ) является одной из ведущих причин заболеваемости и смертности женщин во всем мире, несмотря на все усилия, предпринимаемые исследователями и клиницистами по улучшению его диагностики и лечения. Это четвертый по распространенности рак [1], средний уровень заболеваемости которым составляет 9,0 на 100 000 человек в развитых странах и 17,8 на 100 000 – в развивающихся странах. Согласно данным Международного агентства по изучению рака, ежегодно в мире от этого заболевания умирают 190 000 женщин (летальность составляет около 30%) [2]. Отмечается «омоложение» данной патологии: 53,2% пациенток находятся в репродуктивном возрасте (30–49 лет), что обусловливает необходимость разработки и применения щадящих методов лечения с возможным сохранением репродуктивной функции [3]. Наблюдается также тенденция к росту запущенных случаев заболевания: в 42,7% РШМ впервые диагностируется на III–IV стадиях.
Появление метастазов из клеток опухоли в лимфатических узлах (ЛУ) является одним из главных звеньев распространения ракового процесса, в том числе и РШМ. В литературе содержатся результаты изучения ЛУ онкологических больных до и после возникновения метастазов. Метастазы в регионарные лимфатические узлы являются, по мнению некоторых авторов, важным прогностическим фактором для пациентов с РШМ [4], что обусловливает необходимость их изучения с использованием расширяющегося арсенала структурно-функциональных и молекулярных методов [5].
Лечение РШМ определяется стадиями заболевания и включает, как правило, хирургическое вмешательство (от малоинвазивных до радикальных манипуляций), химиотерапию (неоадъювантную и адъювантную), сочетанную химио- и лучевую терапию [6]. В последние десятилетия все большее внимание уделяется разработке органосохраняющих хирургических операций при лечении новообразований разной локализации, что обусловлено необходимостью снижения инвалидизации, послеоперационных осложнений, достижения хороших косметических результатов [7; 8]. Однако следует отметить, что малоинвазивная (органосохраняющая) хирургия часто сопровождается значительно более высокими показателями рецидивов и значительным ухудшением общей выживаемости, поэтому во многих случаях предпочтительными являются комбинированные схемы лечения, направленные на эффективное подавление опухолевого роста. Основная роль в подавлении опухолевого роста принадлежит химиотерапии и лучевой терапии, которые оказывают разной степени выраженности как системное, так и местное повреждающее воздействие на другие органы и ткани. Показано, что химиотерапия и отдельные химические соединения, в частности препараты платины, оказывают повреждающее действие на разные лимфоидные органы [9], что может приводить к иммуносупрессии и нарушениям лимфотока.
Для протекции выраженных цитотоксических повреждений лимфоидных органов, в том числе ЛУ, и индукции в них регенераторных процессов в схемы противоопухолевой терапии все чаще вводят различные иммуномодуляторы. Ранее было показано, что неоадъювантная иммунотерапия ридостином без сочетания с другими видами лечения при раке вызывает выраженный лечебный патоморфоз опухоли и не приводит к повышению частоты послеоперационных осложнений [10], что может быть обусловлено его способностью индуцировать широкий спектр генов системы интерферона [11]. Применение иммуномодуляторов стимулирует процессы регенерации иммунокомпетентных клеток в поврежденных лимфатических коллекторах, также отмечена положительная тенденция к снижению длительности лимфореи в послеоперационном периоде. Однако действие иммуномодуляторов, в том числе и индукторов интерферона, на измененные вследствие химиотерапии ЛУ пациентов при РШМ изучено недостаточно. Оценка динамики структурных преобразований в лимфатических узлах при РШМ при разных схемах химиотерапии имеет большое значение для разработки наиболее эффективных методов лечения этого заболевания.
Цель исследования – изучить характер и выраженность патоморфологических изменений общих подвздошных лимфатических узлов больных при раке шейки матки после неоадъювантной химиотерапии в комбинации с индуктором синтеза интерферона Панавиром.
Материал и методы исследования
Обследованы 170 больных, находившихся на лечении в отделении онкогинекологии ГБУЗ НСО «Новосибирский областной онкологический диспансер» в 2004–2015 гг. с диагнозом «Рак шейки матки I, II или III стадии»; по классификации «TNM» все пациенты соответствовали T1N0-1M0 или T2N0-1M0. В зависимости от метода неоадъювантной химио- и иммунотерапии женщины были распределены на 4 группы: 1-я группа – 21 больная после радикальной абдоминальной трахелэктомии без неоадъювантной химиотерапии; 2-я группа – 17 пациентов после расширенной экстирпации матки по Вертгейму без неоадъювантной химиотерапии; 3-я группа – 75 пациенток после расширенной экстирпации матки по Вертгейму после неоадъювантной монохимиотерапии препаратами паклитакселя и платины [12]; 4-я группа – 57 больных после расширенной экстирпации матки по Вертгейму после неоадъювантной монохимиотерапии препаратами платины и включения в курс лечения препарата Панавир® (вагинальные суппозитории) – оригинального отечественного противовирусного препарата растительного происхождения с иммуномодулирующими свойствами, способствующего индукции синтеза интерферона. Комбинированную химиотерапию паклитакселем (175 мг) и цисплатином (75 мг) проводили в 3 курса (каждый последующий курс через 21 день). Панавир включали в схему химиотерапии с началом каждого курса (по 10 вагинальных суппозиториев, по 0,2 мг активного вещества). Оперативное вмешательство проводили через 21 день после окончания 3-го курса химиотерапии.
Средний возраст всех обследованных больных при РШМ составил 32±5,43 года: у больных с удалением матки по Вертгейму – 32,2±5,61 года, у больных с радикальной трахелэктомией – 31,2±4,87 года.
По клиническим особенностям опухоли во всех группах были представлены следующими формами: экзофитная, экзофитно-язвенная, эндофитная, эндофитно-язвенная, смешанная и опухоль, растущая из цервикального канала. По гистологическому строению все опухоли были представлены плоскоклеточным неороговевающим или ороговевающим раком, аденокарциномами различной степени дифференцированности и cancer in situ. Все пациентки из всех групп в полной мере получали симптоматическое лечение и коррекцию сопутствующих заболеваний.
Для патоморфологического изучения биоптаты ЛУ, забранные во время оперативного вмешательства, фиксировали в 10% растворе забуференного нейтрального формалина, затем после стандартной проводки заливали в парафин. Срезы окрашивали гематоксилином и эозином и по Ван Гизону по общепринятым методикам. Препараты исследовали в микроскопе Axioimager M1 (Carl Zeiss, Германия) при увеличении до 1000 раз.
С помощью морфометрического анализа в ЛУ оценивали объемную плотность (в %) капсулы, соединительной ткани отдельно в корковом и мозговом веществе, подкапсульного синуса, поверхностной и глубокой коры, лимфоидных узелков без центров и со светлыми центрами, мозговых синусов и мякотных тяжей. Морфометрические исследования проводили на изображениях, полученных с помощью цифровой видеокамеры и программного обеспечения Axiovision (Carl Zeiss, Германия) при увеличении в 200 раз.
Статистическую обработку полученных данных выполняли с помощью программы MS Excel 7.0 (Microsoft, США), вычисляли среднее значение, его ошибку. Значимость различий определяли с помощью критерия Стьюдента. Статистически значимыми считали различия при p<0,05.
Результаты исследования и их обсуждение
По результатам биопсии шейки матки группы больных по видам примененных операций – расширенная экстирпация матки по Вертгейму и органосохраняющая радикальная трахелэктомия – значительно друг от друга не отличались. Преобладали (около 2/3 от всех наблюдений) пациентки с плоскоклеточным неороговевающим раком (таблица 1), несколько реже встречались женщины с плоскоклеточным ороговевающим раком; аденокарцинома и cancer in situ были представлены единичными случаями.
|
Таблица 1 Патоморфологический анализ операционного материала при раке шейки матки |
||
|
Диагноз |
Виды операций |
|
|
расширенная экстирпация матки по Вертгейму |
органосохраняющая радикальная трахелэктомия |
|
|
Cancer in situ |
2,6% |
10% |
|
Плоскоклеточный неороговевающий рак |
55,8% |
80% |
|
Плоскоклеточный ороговевающий рак |
29,9% |
10% |
|
Умеренно дифференцированная аденокарцинома |
11,7% |
0 |
|
Размер образования (см2) |
6,69±4,65 |
9,67±4,04 |
|
Глубина инвазии (см) |
0,629±0,367 |
0,446±0,164 |
|
Реактивная гиперплазия лимфатического узла |
14,3% |
0 |
|
Жировая трансформация лимфатического узла |
9,1% |
0 |
|
Отек лимфатического узла |
2,6% |
0 |
|
Метастазы в лимфатический узел |
11,7% |
0 |
По результатам гинекологического осмотра женщин с РШМ выявлено, что у больных, которым затем была выполнена радикальная трахелэктомия, практически в 2 раза чаще встречалась опухоль, выглядевшая как эрозия шейки матки. В группе пациенток, подвергшихся в дальнейшем экстирпации матки с транспозицией яичников, значительно чаще были обнаружены экзофитно-язвенная и эндофитно-язвенная формы рака, а также формы опухоли, растущие из цервикального канала.
При ранней диагностике РШМ опухоль не выходит за пределы слизистой оболочки, выглядит как эрозия шейки матки, в таких случаях женщинам можно выполнять органосохраняющую операцию радикальной трахелэктомии. При позднем обнаружении опухоли в процесс вовлечен более обширный массив тканей, сама опухоль занимает больший объем, кровоснабжение опухолевой ткани нарушается и ее поверхность изъязвляется. В результате визуально выявляется опухоль с изъязвлением, растущая экзофитно или эндофитно или занимающая полость канала шейки матки.
Контактное кровотечение из опухоли значительно чаще регистрировалось у женщин, подвергавшихся в дальнейшем экстирпации матки с транспозицией яичников, относительно пациенток, которым далее выполняли органосохраняющую операцию радикальной трахелэктомии (40,3 против 15% соответственно).
При больших опухолях в патологический процесс вовлекаются и стенки кровеносных сосудов. При малейшем воздействии, в том числе и при прикосновении к таким участкам, из опухоли начинается кровотечение. То есть контактное кровотечение из шейки матки при РШМ свидетельствует о прорастании опухолью стенок кровеносных сосудов, распространении процесса как минимум на подслизистую оболочку органа.
В параметрии у 11,7% женщин, которым затем выполняли экстирпацию матки по Вертгейму с транспозицией яичников, были обнаружены инфильтрация, уплотнения и болезненность. Параметрий у всех больных, которым в дальнейшем была сделана радикальная трахелэктомия, был свободен и не имел патологических признаков. Симптомы поражения параметрия появляются в результате или прогрессирования опухолевого процесса, или присоединения инфекции. И в том и в другом случаях это является признаком распространенного РШМ, при котором целесообразна расширенная экстирпация матки по Вертгейму с транспозицией яичников.
У пациенток с РШМ без неоадъювантной терапии в подвздошных ЛУ содержалось большое число широких лимфоидных узелков как с центрами размножения, так и без центров, и часто была расширена паракортикальная зона (рисунок 1а). То есть были выявлены характерные для ЛУ онкологических больных без метастазов явления паракортикальной и фолликулярной гиперплазии [13]. Кроме того, в корковом и мозговом веществе ЛУ у больных без предварительной химиотерапии формировались многочисленные тонкие прослойки соединительной ткани (рисунок 1б). Появление таких соединительнотканных прослоек, вероятно, обусловлено длительным воспалительным процессом в регионе лимфосбора до возникновения опухоли и при ее инфильтративном росте.
а 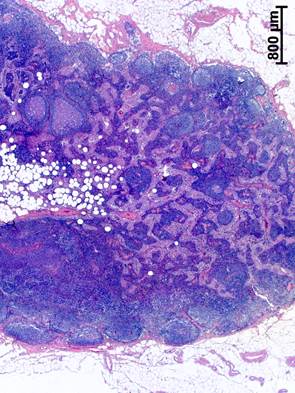 б
б 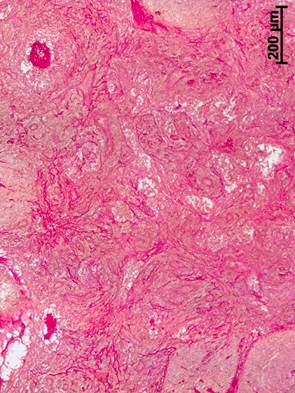
Рис. 1. Подвздошный лимфатический узел больной при РШМ, удаленный во время радикальной трахелэктомии без неоадъювантной терапии:
а – расширение паракортикальной зоны. Окраска гематоксилином и эозином; б – прослойки соединительной ткани в корковом веществе. Окраска по Ван Гизону
У пациенток с РШМ после экстирпации матки по Вертгейму с транспозицией яичников и неоадъювантной химиотерапией в подвздошных ЛУ отмечалось выраженное уменьшение коркового и мозгового вещества (рисунок 2а), усиливались процессы склеротической трансформации как коркового, так мозгового вещества (рисунок 2б).
а 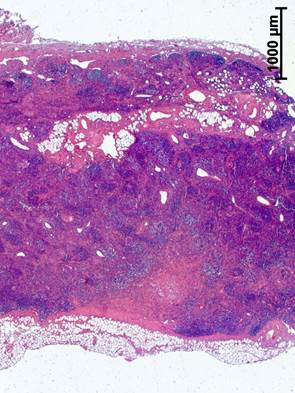 б
б 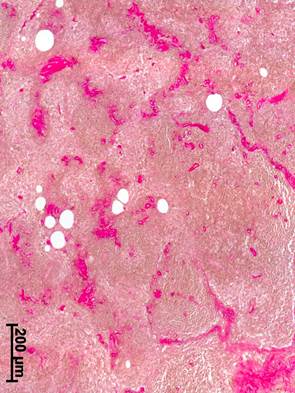
Рис. 2. Подвздошный лимфатический узел больной при РШМ, удаленный во время экстирпации матки по Вертгейму с транспозицией яичников после неоадъювантной химиотерапии: а – лимфоидные узелки и синусная система практически отсутствуют. Окраска гематоксилином и эозином; б – многочисленные прослойки соединительной ткани. Окраска по Ван Гизону
У больных с РШМ после экстирпации матки по Вертгейму с транспозицией яичников после неоадъювантной химиотерапии в сочетании с иммунотерапией в корковом веществе ЛУ объем соединительной ткани также был увеличен, в результате чего отмечалась фрагментация коркового вещества (рисунок 3а). Прослойки соединительной ткани формировались в основном периваскулярно и вокруг лимфоидных фолликулов, не проникая в них (рисунок 3б). Следует отметить значительное уменьшение объема мозгового вещества и его фиброзирование.
а 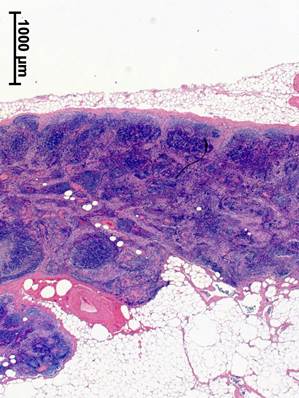 б
б 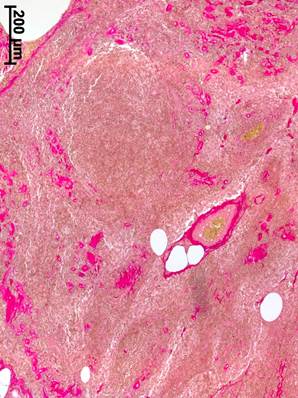
Рис. 3. Подвздошный лимфатической узел больной с РШМ, удаленный во время экстирпации матки по Вертгейму с транспозицией яичников после неоадъювантной химио- и иммунотерапии: а – широкие лимфоидные фолликулы без герминативных центров в корковом веществе, отсутствие мозговых синусов. Окраска гематоксилином и эозином; б – отсутствие соединительной ткани в лимфоидных узелках без центров размножения. Окраска по Ван Гизону
Данные морфометрического анализа подтверждают значительное склерозирование всех структурных отделов общих подвздошных ЛУ у пациенток с РШМ после экстирпации матки по Вертгейму с транспозицией яичников и с неоадъювантной химиотерапией, в том числе дополненной иммунотерапией (таблица 2). Так, объемная плотность соединительной ткани в корковом веществе возросла при обоих видах лечения соответственно в 3,9 и 4,2 раза по сравнению с экстирпацией матки по Вертгейму с транспозицией яичников без неоадъювантной химиотерапии и в 4 и 4,4 раза по сравнению с трахелэктомией без неоадъювантной химиотерапии.
Таблица 2
Объемная плотность (в %) структурных отделов общих подвздошных лимфатических узлов различных групп больных при раке шейки матки (M±m)
|
Структурный отдел |
Трахелэктомия без неоадъювантной терапии |
Экстирпация матки по Вертгейму с транспозицией яичников |
||
|
без неоадъювантного лечения |
химиотерапия |
сочетание химио- и иммунотерапии |
||
|
Капсула |
1,73±0,79 |
1,72±0,79 |
3,78±0,94 |
3,01±1,41 |
|
Соединительная ткань в корковом веществе |
1,47±0,52 |
1,56±0,51 |
6,01±1,41* |
6,50±2,12 |
|
Соединительная ткань в мозговом веществе |
0,93±0,88 |
1,96±0,68 |
11,60±1,69* |
12,01±1,41* |
|
Краевой синус |
1,07±0,13 |
0,80±0,12 |
0,56±0,11 |
0,50±0,11 |
|
Корковое плато |
14,10±1,41 |
15,40±1,76 |
14,40±1,24 |
13,50±2,12 |
|
Паракортикальная зона |
31,30±4,50 |
29,70±3,31 |
38,80±4,80 |
31,50±4,95 |
|
Узелки без центра размножения |
3,20±0,78 |
3,24±0,72 |
1,94±1,66 |
3,50±1,12 |
|
Узелки с центром размножения |
12,7±0,98 |
12,60±1,41 |
8,72±1,49 |
11,50±0,71 |
|
Мякотные тяжи |
15,70±1,45 |
15,30±1,1 |
6,78±4,91 |
8,50±4,95 |
|
Мозговые синусы |
17,80±2,54 |
17,7±1,875 |
7,44±5,26 |
9,50±3,543 |
|
Примечание: * – р<0,05 по сравнению с оперативными вмешательствами без неоадъювантной химиотерапии. |
||||
Объемная плотность соединительнотканных прослоек в мозговом веществе ЛУ у больных после экстирпации матки по Вертгейму с транспозицией яичников после неоадъювантной химиотерапии и ее сочетания с иммунотерапией была больше соответственно в 12,5 и 12,9 раза, чем у пациенток после трахелэктомии без неоадъювантной терапии. После экстирпации матки по Вертгейму с неоадъювантной химиотерапией и сочетанием с иммуномодулятором данный показатель был также выше соответственно в 5,9 и 6,1 раза, чем у пациенток с экстирпацией матки без предварительного введения цитостатиков.
Скорее всего, увеличение объема соединительной ткани в корковом и мозговом веществе ЛУ больных с РШМ после химиотерапии обусловлено гибелью большого числа митотически активных клеток под действием цитостатиков [14] и склерозом таких участков паренхимы. То есть соединительнотканные прослойки замещают фрагменты ЛУ с большим числом погибших клеток.
Необходимо отметить, что в группе больных после химиотерапии во многих наблюдениях (5 из 15; 33,3%) в ЛУ не были найдены лимфоидные узелки без герминативных центров. В других группах пациенток, в том числе и после сочетания химиотерапии с введением иммуномодулятора, подобные фолликулы присутствовали во всех наблюдениях. Именно в лимфоидных узелках без герминативных центров содержится множество митотически активных клеток, особенно в условиях постоянной стимуляции антигенами из опухоли и сопутствующего воспалительного очага. Заметно снижалась у пациенток с РШМ, у которых применялась неоадъювантная химиотерапия, объемная плотность узелков без центров размножения и узелков с центрами размножения (соответственно в 1,7 и 1,4 раза) по сравнению с пациентками, у которых химиотерапия не применялась (таблица 2). Цитостатики, ингибируя делящиеся клетки, приводят к исчезновению таких лимфоидных узелков. В остальных зонах ЛУ митотическая активность выражена в меньшей степени, поэтому другие структурные отделы в меньшей степени склерозированы после введения препаратов для химиотерапии.
Лимфатические узлы, дренирующие первичную опухоль, имеют важное значение для инициации эффективного противоопухолевого Т-клеточного иммунного ответа [15]. Тем не менее иммуносупрессивные факторы, обусловленные раком, химио- и лучевой терапией, вызывают иммунодефицит опухолевых ЛУ, позволяя опухолевым клеткам проникать в лимфатические сосуды и метастазировать. Иммуномодуляторы, добавленные в схему химиотерапии, стимулируют оставшиеся неповрежденными иммунокомпетентные клетки ЛУ. Вследствие активирующего действия иммуномодулирующих веществ структура ЛУ в нашем исследовании восстанавливалась быстрее, на что указывала нормализация объемной плотности лимфоидных узелков без герминативных центров. Быстрее также восстанавливались обусловленные этими узелками защитные функции ЛУ. Вместе с тем заместительный склероз у больных данной группы существенно не уменьшался.
Изменения ЛУ при развитии злокачественных опухолей, как правило, стереотипны и проявляются в виде паракортикальной гиперплазии, фолликулярной реакции с появлением герминативных центров и синусного гистиоцитоза. Прогностическое значение паракортикальной гиперплазии большинство авторов рассматривает как благоприятный признак, поскольку она отражает пролиферацию основных противоопухолевых клеточных элементов – Т-лимфоцитов. Относительно других иммуноморфологических реакций, особенно фолликулярной гиперплазии, единого мнения не существует [13].
Заключение
По данным комплексного патоморфологического анализа, неоадъювантная химиотерапия у больных с РШМ вызывает значительную склеротическую трансформацию коркового и мозгового вещества общих подвздошных ЛУ. Объемная плотность соединительной ткани в этих отделах ЛУ возрастает в 3,9–12,9 раза по сравнению с пациентками после трахелэктомии без неоадъювантной терапии. Под действием цитостатиков заметно уменьшается объемная плотность структур с высокой митотической активностью – лимфоидных узелков без центров размножения. Введение иммуномодулятора в схему химиотерапии не предупреждает и не снижает степень фиброзирования ЛУ, но способствует восстановлению практически на исходном уровне количественных морфологических показателей лимфоидных узелков без герминативных центров.



