Травматические повреждения печени и селезенки по тяжести течения, сложности диагностики, лечения, высокой летальности обоснованно считают наиболее опасными среди травм органов брюшной полости [1, 2]. В настоящее время выросло количество бытовых, производственных травм. Продолжает оставаться высоким число военных конфликтов, а также различного рода катастроф. При этом в 3,3–10,0% всех случаев выявляются повреждения живота. Травма живота в 26,7–40,8% наблюдений сопровождается травмой паренхиматозных органов. Среди последних наибольший процент приходится на печень. При этом следует иметь в виду тот факт, что статистические данные клиницистов о числе травм печени значительно меньше фактического их числа, так как часть пострадавших погибает на месте происшествия или по пути следования в медицинское учреждение [3].
Состояние больного с травмой печени в 75% случаев осложняется развитием шока. Тяжесть состояния пострадавшего определяется объемом кровопотери, поэтому обеспечение адекватного гемостаза является первостепенной задачей при оказании медицинской помощи [4, 5].
Как известно, в хирургии для достижения местного гемостаза используются различные методы:
1) механические способы: тампонада, лигирование, ручной или скрепочный шов, клипирование;
2) физические способы: электрокоагуляция, фотокоагуляция, лазерная, ультразвуковая, радиочастотная, микроволновая, аргоноплазменная коагуляция и т.д.;
3) химические способы: аппликационные гемостатические средства, растворы и пр. [6].
Среди прочих локальных средств стоит выделить так называемые раневые покрытия, которые в настоящее время активно разрабатываются и внедряются многими хирургическими школами, как отечественными, так и зарубежными. Раневые покрытия используют для лечения различных видов поверхностных повреждений и травм, в свою очередь также сопровождающихся кровотечением или истечением иных биологических жидкостей и обладающих выраженным статическим эффектом и высокой сорбционной способностью. Также одним из широко разрабатываемых направлений современной хирургии являются исследования в области гемостаза в хирургии. За последние 30 лет был сделан качественный скачок в производстве средств, обладающих локальной кровоостанавливающей активностью, о чем свидетельствует увеличение количества публикаций по данной тематике и патентов на изобретения как в Российской Федерации (РФ), так и за рубежом [7]. Как правило, локальные гемостатические средства представляют собой губчатую структуру и могут иметь в своем составе системные кровоостанавливающие средства, антибактериальные средства и пр. Однако, несмотря на активное внедрение в практическую медицину и исследование отдельных известных компонентов, механизм действия указанных средств в целом зачастую остается неясен. Но не стоит уменьшать важность интраоперационной профилактики кровотечения, которая достигается с использованием системных коагулянтов.
Широкое распространение получили в настоящее время не только локальные гемостатики, но и средства общего действия на систему гемостаза, что связано с ростом числа пациентов, у которых диагностирована патология свертывающей и противосвертывающей систем крови [8]. Методами диагностики таких заболеваний являются различные коагулологические тесты, которые позволяют верифицировать отклонение от нормы значений показателей работы указанных выше систем. Большинство тестов осуществляются посредством аппаратного измерения с помощью автоматических или полуавтоматических коагулометров, которыми оснащены клинико-диагностические лаборатории первичного звена оказания помощи населению в Российской Федерации [9].
Помимо средств, оказывающих кровоостанавливающий эффект, выделяют и антигемостатические средства – антикоагулянты, которые активно используются в сердечно-сосудистой хирургии для предотвращения формирования тромбов. Особенно актуально их применение при реконструктивных оперативных вмешательствах, связанных с замещением участка сосудистого русла эндопротезом [10].
Согласно вышесказанному определяется необходимость в тестировании и экспериментальной апробации эффективности использования всех указанных групп средств (а также различных их форм применения) способами in vitro, а не классическими способами экспериментов in vivo на лабораторных животных.
Поэтому целью нашего исследования являлась разработка способа сравнительного изучения влияния растворов и средств на процесс образования сгустка крови в условиях in vitro.
Материалы и методы исследования
Исследование проводили под наблюдением регионального этического комитета при ФГБОУ ВО «Курский государственный медицинский университет» Минздрава России согласно действующим международным этическим нормам. Каждый донор-доброволец подписывал информированное добровольное согласие на медицинское вмешательство. В стерильных условиях операционного блока лаборатории экспериментальной хирургии и онкологии научно-исследовательского института экспериментальной медицины ФГБОУ ВО «Курский государственный медицинский университет» Минздрава России в утренние часы натощак у 10 здоровых доноров-добровольцев (юношей 19–23 лет), не имеющих в анамнезе патологии системы гемостаза, забирали кровь из кубитальной вены. Для этого использовали вакуумные пробирки (вакутайнеры, производитель – Hebei Xinle SCI&TECH CO., LTD, Xinle, Shijiazhuang, China), содержащие 3,2%-ный раствор цитрата натрия. Соотношение объемов крови и цитрата натрия – 9:1. Перемешивание крови с антикоагулянтом производили аккуратным переворачиванием вакутайнера 3 раза.
Затем производили рекальцификацию стабилизированной цитратом крови: в отдельную пробирку добавляли с помощью микропипетки 0,1 мл раствора тромбопластина, 0,1 мл 5%-ного раствора кальция хлорида, затем вносили 0,5 мл цитратной крови.
Далее кровь из пробирки дозировали микропипеткой в объеме 200 мкл в кювету коагулометра АПГ2-02-П (производитель – ООО ЭМКО, г. Москва, Россия), в которую после этого помещали стальной шарик и вносили тестируемые образцы хирургических материалов стандартного размера (цилиндрической формы с радиусом 0,5 см и высотой 0,2 см). Последние помещали в кювету таким образом, чтобы верхний край «цилиндра» соответствовал месту перехода узкой части кюветы в широкую (т.е. у верхней границы ее измерительной части) и был полностью, на всю толщину погружен в кровь, плотно прилегал к стенкам кюветы, но не препятствовал вращению металлического шарика, расположенного на дне кюветы (рис.).
Подготовку материалов и стандартизацию их размеров производили с помощью инструмента для биопсии кожи – Dermo-Punch (диаметр 0,5 см) и пластины-трафарета с отверстием диаметром 0,5 см и толщиной 0,2 см. Из полотна хирургического материала с помощью Dermo-Punch получали цилиндр диаметром 0,5 см, равным внутреннему сечению Dermo-Punch и кюветы коагулометра соответственно. Затем получившийся цилиндр помещали в отверстие пластины трафарета, окно которой имеет форму круга с диаметром 0,5 см (равным внутреннему сечению Dermo-Punch и кюветы коагулометра), толщиной стенки 0,2 см, отсекали скальпелем выступающую над уровнем поверхности пластины часть цилиндра, тем самым определяя толщину тестируемого образца.
Апробацию способа проводили на образцах, обладающих согласно данным производителя гемостатическим эффектом (обусловленным физико-механическими и химическими свойствами образца): губка гемостатическая коллагеновая (состав: коллаген, субстанция – раствор 2%-ный – 49 г (0,98 г сухого коллагена) нитрофурал (фурацилин) – 0,0075 г, борная кислота – 0,0125; размеры 50х50x7 мм; производитель: ОАО «Лужский завод “Белкозин”», г. Луга, Россия); а также на материалах, априори не имеющих кровоостанавливающей активности (гемостатическая активность которых может быть обусловлена лишь структурными, а не химическими особенностями образца): губка бытовая (состав: поролон; размеры 130х90х50 мм, производитель: ООО «Поролон-Техно», г. Москва, Россия).
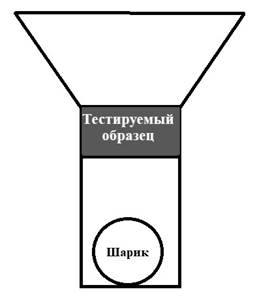
Схема кюветы коагулометра с размещенным внутри тестируемым образцом и металлическим шариком
Запуск таймера коагулометра (время начала исследования) производили вручную после установки кювет в измерительные ячейки аппарата согласно инструкции к коагулометру АПГ2-02-П.
Исследования проводили в следующих группах:
- контрольная – исследуемый материал не вносили в кювету коагулометра;
- первая экспериментальная группа – кровь донора + губка гемостатическая коллагеновая производства ОАО «Лужский завод “Белкозин”»;
- вторая экспериментальная группа – кровь донора + губка бытовая поролоновая производства ООО «Поролон-Техно».
С кровью каждого донора производили по три опыта. В каждой экспериментальной группе выполняли по 10 коагулометрических исследований (согласно числу доноров). Каждое исследование включало в себя оценку времени свертывания в двух кюветах коагулометра одновременно, что позволило увеличить точность и снизить погрешности исследования. Также учитывали время от начала рекальцификации крови (с помощью секундомера засекали время с момента введения в пробу растворов кальция хлорида и тромбопластина) до помещения в пробу хирургических материалов, которое впоследствии суммировали с показателями прибора.
Затем проводили статистическую обработку данных. После определения показателей описательной статистики (расчет средних арифметических, стандартных отклонений и средних ошибок средних) для определения достоверности отличий средних производили расчет критерия Манна–Уитни при допустимом для медико-биологических исследований уровне р≤0,05. В качестве программной среды для обработки данных использовали лицензионные версии программы Statistica (версия 6.0) и редактора электронных таблиц Microsoft Excel 2010.
Результаты исследования и их обсуждение
Согласно полученным результатам исследования, которые представлены в таблице, можно говорить о том, что наибольшее значение среднего времени свертывания крови характерно для второй экспериментальной группы – 90,9 секунды, наименьшее – для первой экспериментальной группы – 71,7 секунды против значений контрольной группы – 94,6 секунды. Среднее время свертывания крови во второй экспериментальной группе на 3,7 секунды больше, чем в контрольной, а в первой экспериментальной группе на 22,9 секунды меньше по сравнению с контрольной группой. Время свертывания крови во второй экспериментальной группе на 19,2 секунды больше, чем в первой. Указанные различия были статистически достоверны (р≤0,05).
Показатели времени свертывания крови доноров при внесении тестируемых образцов
|
Наименование группы
|
Стабилизированная кровь (контроль) |
Губка гемостатическая коллагеновая |
Губка бытовая поролоновая |
|
№ группы |
0 |
1 |
2 |
|
М |
94,6 |
71,7 |
90,9 |
|
m |
12,9 |
6,9 |
13,6 |
|
p |
***р3≤ 0,05 |
*р1 ≤ 0,05 |
**р2≤ 0,05 |
Примечания:
*р1 – достоверность отличия средних значений времени свертывания крови в кюветах с губкой гемостатической коллагеновой «Белкозин» по отношению к кюветам с губкой бытовой поролоновой.
**р2 - достоверность отличия средних значений времени свертывания крови в кюветах с губкой бытовой поролоновой по отношению к кюветам со стабилизированной рекальцифицированной кровью.
***р3 - достоверность отличия средних значений времени свертывания крови в кюветах с губкой гемостатической коллагеновой «Белкозин» по отношению к кюветам со стабилизированной рекальцифицированной кровью.
Следовательно, опираясь на полученные результаты, можно говорить о том, что предложенная методика, основанная на оценке изменений значений времени свертывания рекальцифицированной крови доноров-добровольцев аппаратным способом, чувствительна к химическому составу тестируемых средств, а не только к пространственной организации их внутренней структуры. Это обусловливает практическую значимость способа сравнительного изучения влияния хирургических материалов на процесс образования сгустка крови in vitro, которая заключается в оценке влияния различных химических компонентов на кровоостанавливающую активность средств медицинского назначения (гемостатических имплантов, шовных материалов и пр.), используемых для выполнения инвазивных процедур (таких как наложение швов, погружение в полости организма и др.).
Заключение. Таким образом, разработанная методика сравнительного изучения влияния хирургических материалов на процесс образования сгустка крови in vitro обладает технической простотой, точностью, объективностью и возможностью использования в скрининговых исследованиях на этапе отбора перспективных экспериментальных образцов из общего числа гемостатических имплантов. Об этом свидетельствуют полученные результаты, согласно которым можно отметить, что наибольшее значение среднего времени свертывания крови характерно для средств, не обладающих кровоостанавливающей активностью (в нашем исследовании это губка поролоновая), в то время как наименьшее значение времени свертывания принадлежит средству, обладающему гемостатическим эффектом (состав которого представлен в основном волокнами коллагена) и давно укрепившемуся на отечественном рынке. Одним из важных преимуществ разработанной методики перед существующими является то, что она позволяет проводить исследования в отдаленные сроки с момента взятия крови от донора благодаря ее консервации в пробирках, содержащих цитрат натрия. Также представленный в данной работе способ обладает важным экономическим плюсом, так как не требует дополнительных затрат на содержание и выхаживание лабораторных животных, которых, как правило, используют в качестве объекта исследования при тестировании различных видов раневых покрытий и гемостатических имплантов.



