В связи с усиленными темпами освоения Крайнего Севера в настоящее время вопрос адаптации организма человека к жизни в северных широтах, где он подвергается воздействию низких природных температур, вновь становится актуальным [1; 2].
Известно, что на негативное воздействие различных факторов окружающей природной среды организм человека отвечает мобилизацией адаптационных механизмов регуляции функционирования систем, в том числе и системы крови, что может проявляться изменением её клеточного состава [3; 4]. В осуществлении защитной реакции организма большую роль играют лейкоциты, которые обеспечивают неспецифический и специфический клеточный иммунитет организма и отвечают на воздействия любых стресс-факторов. При длительном или чрезвычайно сильном воздействии неблагоприятных факторов происходят изменения иммунологической реактивности, приводящие к снижению адаптационных возможностей организма, к развитию транзиторных или стойких форм вторичной иммунной недостаточности [5].
Дисбаланс иммунной системы оказывает влияние на формирование, характер течения и исходы многих патологических процессов. Наиболее высокие уровни заболеваемости в условиях Крайнего Севера приходятся на болезни органов дыхания, нервной системы, органов чувств и системы кровообращения [1; 6; 7].
Таким образом, актуальность исследования механизмов адаптации системы крови и реакций иммунных органов на холодовое воздействие продиктована необходимостью поиска путей повышения сопротивляемости организма к низким температурам, разработки мер профилактики и коррекции нарушений иммунного ответа организма людей, постоянно и временно проживающих в условиях Заполярья, в том числе и Республики Саха (Якутия). Эта медико-социальная проблема требует глубокой и всесторонней проработки, прежде всего, на теоретическом уровне.
Данное исследование является частью комплексной работы, связанной с изучением механизмов дезадаптации в условиях Арктики и Субарктики. Данная работа проводится с учетом приоритетных направлений научной платформы «Иммунология» государственной программы «Стратегия развития медицинской науки в Российской Федерации на период до 2025 года».
Целью исследования является изучение изменений клеточного состава крови крыс в зависимости от времени их экспозиции в условиях холодового воздействия.
Материалы и методы исследования. Исследование проводили на 40 беспородных крысах-самцах массой тела 200-300 г. Выбор пола животных был продиктован необходимостью получения стабильных результатов, исключая влияние циклических изменений, характерных для организма самок. Методом случайной выборки животные были распределены на контрольную группу и опытную, разделенную на 4 подгруппы по 8 особей в каждой. Животные находились в стандартных условиях вивария, соответствующих требованиям санитарно-эпидемиологических правил СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» (2014). Экспозицию опытных крыс производили в холодильных камерах при температуре -20 ºС с соблюдением адекватных условий влажности и вентиляции в течение 60 минут ежедневно на протяжении 30 суток.
Протокол экспериментальной части исследований, использованный на этапах содержания животных, моделирования патологических процессов и выведения их из опыта, соответствовал принципам биологической этики, изложенным в Международных рекомендациях по проведению медико-биологических исследований с использованием животных (1985); Европейской конвенции о защите позвоночных животных, используемых для экспериментов или иных научных целей (Страсбург, 1986); Приказе МЗ СССР № 755 от 12.08.1977 г. «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных»; Приказе МЗ РФ № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» [8].
Исследования проводили сразу после получения проб крови на 7-е (1-я подгруппа),
14-е (2-я подгруппа), 21-е (3-я подгруппа), 30-е сутки (4-я подгруппа) после начала эксперимента. Животных выводили из опыта методом декапитации с соблюдением требований гуманности, согласно Приложению № 4 «О порядке проведения эвтаназии (умерщвления) животного» к Правилам проведения работ с использованием экспериментальных животных (приложение к Приказу МЗ СССР № 755 от 12.08.1977). Кровь получали во время декапитации животного. Гематологические исследования проводили на автоматизированном гематологическом анализаторе AbacusJunior 30, биохимические исследования сыворотки крови – на биохимическом анализаторе Mindray BA-88A с применением растворов HigtTehnology.
Статистическую обработку данных осуществляли с использованием пакета программ Statistica 6.0. После проверки вариационных рядов на правильность распределения значимость различий между ними определяли параметрическим методом с расчётом средней арифметической, ошибки средней арифметической (М±m) и t-критерия Стьюдента. Различие считали значимым при р <0,05.
Работа выполнена в Медицинском институте СВФУ им. М.К. Аммосова, исследование крови и сывороток крови выполнено в научно-исследовательской клинико-диагностической лаборатории для сельскохозяйственных и домашних животных Якутской ГСХА.
Результаты исследования и их обсуждение. В результате проведенных исследований установлены показатели периферической крови контрольных и опытных групп животных до и после воздействия холода. Показатели контрольной группы животных, содержавшихся в оптимальных условиях температуры, соответствуют физиологической норме [8], в то время как результаты, полученные у крыс, подвергавшихся холодовому воздействию, свидетельствуют об изменениях количественного состава всех форменных элементов периферической крови в разные сроки эксперимента (табл.).
Динамика показателей периферической крови крыс, подвергнутых холодовому воздействию
|
Показатели, ед. изм. |
Контрольная группа |
Опытные подгруппы (n = 32) |
|||
|
7-е сутки |
14-е сутки |
21-е сутки |
30-е сутки |
||
|
Лейкоциты, 10?/л |
14,50±1,32 |
9,36±2,47 |
15,96±2,49 |
6,91±1,24* |
6,99±0,62* |
|
Лимфоциты, % |
57,87±1,26 |
78,57±2,74* |
72,97±2,60* |
60,37±,15 |
79,75±2,15* |
|
MID, % |
14,4±1,98 |
11,52±1,18 |
15,01±0,61 |
7,88±1,44* |
4,91±1,44* |
|
Гранулоциты,% |
25,91±2,05 |
9,9±2,24* |
13,92±2,61* |
25,97±4,1 |
13,83±0,75* |
|
Эритроциты, 10¹²/л |
7,59±1,17 |
6,98±0,38 |
7,2±0,65 |
8,09±1,09 |
5,97±1,29 |
|
Гемоглобин, г/л |
127,75±1,93 |
127,75±6,87 |
132,62±10,83 |
140,12±14,82 |
120,5±13,77 |
|
Гематокрит, % |
43,29±0,72 |
41,73±2,40 |
40,33±3,67 |
58,24±5,99* |
46,14±6,8 |
|
MCV, фл |
57,25±0,52 |
59,62±0,69 |
57,62±0,66 |
66,1±0,56* |
66,07±1,05 |
|
МСН, пг |
17,41±0,22 |
18,32±0,21* |
17,86±0,25 |
15,.47±0,23* |
17,61±0,15 |
|
МСНС, г/л |
310,87±4,6 |
306,62±3,33 |
305,87±3,88 |
233,25±3,03* |
262,62±3,58* |
|
RDWc, % |
18,18±0,28 |
17,3±0,34 |
17,61±0,32 |
16,03±0,33* |
15,21±0,46* |
|
Тромбоциты, 10?/л |
931,7±36,27 |
860,87±56,4 |
885,62±76,79 |
354,62±119,09* |
483,75±111,02 |
Примечание: n - число наблюдений; * – статистически значимое отличие от данных контрольной группы (p<0,05).
Результаты исследования свидетельствуют о том, что холодовое воздействие оказывает влияние на количество клеток, обеспечивающих реакции неспецифического и специфического иммунного ответа. Уже на 7-е сутки эксперимента наблюдается тенденция снижения общего количества лейкоцитов крови (на 35,5%), которое переходит в значимое на 21-е и 30-е сутки (на 52,3% и 51,8% соответственно), несмотря на то что на 14-е сутки отмечается незначительное повышение числа клеток (на 10,1%) по сравнению с данными контрольной группы (табл., рис. 1).

Рис. 1. Общее количество лейкоцитов (х10?/л) у опытных животных в сравнении с контрольной группой в разные сроки эксперимента
В то же время количество лимфоцитов остается повышенным в течение всего эксперимента, статистически значимо возрастая на 7, 14 и 30-е сутки (на 35,7, 26,1 и 37,8% соответственно) (рис. 2).
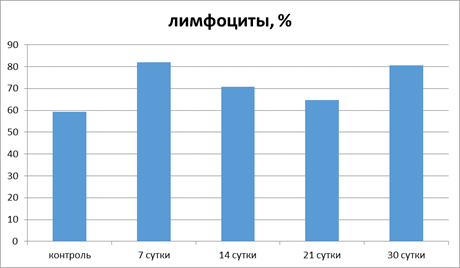
Рис. 2. Изменения относительного количества лимфоцитов в разные сроки эксперимента
в сравнении с контрольной группой
MID – показатель, отражающий содержание смеси моноцитов, эозинофилов, базофилов и незрелых клеток, достоверно снижается на 21-е сутки на 45,3%; на 30-е сутки – на 65,9% по сравнению с контрольной группой. Количество гранулоцитов (эозинофилов, нейтрофилов и базофилов) статистически значимо снижается на 7, 14 и 30-е сутки (на 61,8, 46,3 и 46,6% соответственно), а на 21-е сутки эксперимента соответствует контрольной величине (рис. 3).
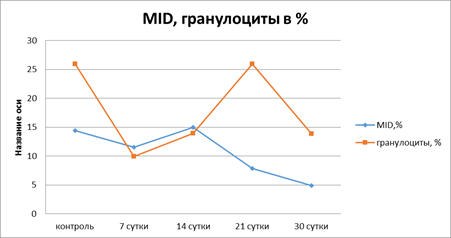
Рис. 3. Динамика изменений относительных показателей MID и гранулоцитов
в разные сроки эксперимента по сравнению с контрольной группой
Значительное снижение общего количества лейкоцитов как на 7-е, так и на 21-е и 30-е сутки эксперимента свидетельствует о том, что холодовое воздействие действительно является стрессовым фактором для теплокровных животных. Это соответствует результатам, полученным Е.Г. Костоломовой, согласно которым популяции изолированных иммунокомпетентных клеток (ИКК) по-разному реагируют на длительность холодовой экспозиции [9]. Кратковременное охлаждение является фактором, активирующим функциональную активность моноцитов и нейтрофилов, а длительное - угнетающим. В исследованиях В.М. Николаева также отмечалось, что при адаптации крыс к гипотермии изменяются показатели неспецифического клеточного иммунитета, связанные с фагоцитарной активностью лейкоцитов [10]. Статистически значимое уменьшение среднего числа поглощённых частиц лейкоцитами как в первой, так и во второй группах экспериментальных животных свидетельствует об угнетении неспецифического клеточного иммунитета при воздействии отрицательных температур. Будем полагать, что в нашем эксперименте экспозиция крыс в условиях низкой температуры в течение от 7 до 30 суток, сопровождавшаяся подавлением активности лейкоцитов, являлась достаточно длительной. Однако увеличение числа лейкоцитов на 14-е сутки (на 10,1% по отношению к контролю и на 45,6% относительно показателя на 7-е сутки) связано с кратковременной стимуляцией лейкоцитопоэза. В экспериментальных работах И.И. Шахматова на крысах-самцах линии Вистар, подвергнутых комбинированному (холодовому) плаванию в воде при температуре +7 °С, показано повышение количества лейкоцитов преимущественно за счет резкого нарастания гранулоцитов. Авторы утверждают, что в результате действия холодового фактора стимулируется специфический иммунный ответ, а реакции неспецифического ответа, опосредованные лейкоцитами, – подавляются [11].
Обращает на себя внимание существенное снижение количества тромбоцитов в периферической крови после воздействия холода на организм. Так, на 21-е сутки эксперимента отмечалось статистически значимое снижение количества тромбоцитов до 354,62±119,09 (х10?/л) по сравнению с контрольными показателями. Значительное снижение тромбоцитов отмечалось и на 30-е сутки эксперимента. Наблюдаемые нами изменения в гематологическом статусе данных животных согласуются с литературными данными, в которых описано уменьшение числа тромбоцитов, как реакция на стресс. Уменьшение количества тромбоцитов при чрезмерном холодовом воздействии объясняется непосредственным участием их в воспалительных и репаративных процессах. При тяжелом холодовом повреждении тканей происходит превалирование их потребления над продукцией, что приводит к снижению количества кровяных пластинок и появлению незрелых молодых форм с низким ферментативным и медиаторным потенциалом, что, в свою очередь, реализуется в снижении их адгезивно-агрегационной способности [12].
Повышение гематокрита, эритроцитов – одна из количественных характеристик физиологической «подстройки» организма к новым условиям жизни. Повышенный гематокрит и одновременное усиление синтеза эритропоэтина, стимулирующего созревание эритроцитов, может быть одним из признаков реакции на стресс, в нашем случае на холодовой [3].
Заключение. Таким образом, холодовое воздействие является стрессом, выражающимся в реакции со стороны всего клеточного состава крови. В результате действия холодового фактора стимулируется специфический иммунный ответ, на что указывает увеличение в крови количества лимфоцитов, а реакции неспецифического ответа, опосредованные другими видами лейкоцитами, – подавляются. Уменьшение количества тромбоцитов также представляется как целесообразная реакция организма в ответ на холодовое воздействие, так как тромбоциты принимают непосредственное участие в репаративных процессах, наблюдающихся при повреждении ткани холодом. Повышенный показатель гематокрита свидетельствует об увеличении доли форменных элементов крови относительно плазмы и является достоверным критерием ответной реакции на стресс.
Дальнейшие исследования коснутся изучения процессов пролиферации и дифференцировки иммунокомпетентных клеток органов и тканей лимфоидного комплекса (селезенка, тимус, лимфатические узлы, МАЛТ полых органов) при холодовой нагрузке.



