Разлитой гнойный перитонит (РГП) – проблема хирургов всего мира. Прогрессивное развитие современной медицинской науки, поиск новых методов оперативного лечения, а также динамическое пополнение знаний относительно патофизиологических особенностей течения и прогрессирования осложненных форм перитонита до сих пор не позволяют уверенно сказать, что хирурги обладают единым алгоритмом лечения данного заболевания и, соответственно, способностью уменьшить уровень заболеваемости и летальности. [1]
По данным ряда исследований, уровень заболеваемости РГП варьирует от 15-25% среди заболеваний общехирургического профиля, а уровень летальности составляет от 30 до 60%, в случае разлитого гнойного перитонита, отягощенного присоединением сепсиса или септического шока, показатель летального исхода возрастает до 95% [2-4]. К сожалению, невозможно объективно оценить каждый случай развития РГП и факт смерти пациента, но можно сделать вывод, что хирурги ещё недостаточно понимают, как управлять этим заболеванием. В последние несколько лет в хирургическом сообществе всего мира принята парадигма, что интраоперационная санация брюшной полости – это один из ключевых моментов в лечении РГП и профилактике абдоминального сепсиса и других осложнений.
Цель исследования
Качественное и количественное сравнение методов санации брюшной полости на изготовленной трехмерной полимерной модели брюшной полости, построенной на основании КТ-снимков реального пациента, в условиях смоделированного распространенного гнойного перитонита.
Материалы и методы исследования
Экспериментальное подтверждение эффективности вакуум-инстилляционной терапии стерильным физиологическим раствором через оригинальное инстилляционно-дренажное устройство (ИДУ) в сочетании с периоперационной барботажной обработкой построено на основных последовательных задачах:
1) создать трехмерную полимерную модель брюшной полости, которая анатомически соответствует КТ-параметрам брюшной полости реального пациента и содержит в себе модель тонкого кишечника, желудка и печени;
2) определить химический состав раствора для инстилляции в брюшную полость;
3) разработать метод газирования стерильного инстилляционного раствора;
4) установить оптимальный режим вакуумирования и инстилляции при использовании ИДУ в режиме барботажа;
5) получить раствор, аналогичный гнойному содержимому брюшной полости при РГП по следующим параметрам: плотность, вязкость, растворимость;
6) оценить эффективность санации брюшной полости путем инстилляции газированного стерильного 0,9% физиологического раствора температурой +37-42 °С.
7) оценить эффективность санации брюшной полости путем инстилляции барботируемого стерильного 0,9% физиологического раствора температурой +37-42 °С.
Эксперимент проведён на базе лаборатории кафедры и клиники хирургических болезней им. А.М. Дыхно с курсом эндоскопии и эндохирургии ПО Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого.
Оценка эффективности санации проводилась по следующим критериям:
1) плотность полученного раствора после санации;
2) вязкость полученного раствора после санации;
3) время инстилляции и объём раствора, затраченные на полное очищение брюшной полости от моделируемого гнойного содержимого;
4) визуальный контроль чистоты моделируемой брюшной полости.
Инстилляция коллоидных растворов во время абдоминальной санации является рутинным методом в практике большинства хирургов. Как правило, предполагается, что инстилляционный раствор позволяет сократить количество микробных единиц и отмыть некротизированные ткани, желчь, кровь, которые способствуют росту бактерий. Чаще всего на практике для промывания ран и брюшной полости применяется 0,9% физиологический раствор (ФР). Несмотря на это, в литературе нет ни одного клинического исследования с весомой доказательной базой, что данный раствор является абсолютно безопасным при инстилляции брюшной полости. При анализе экспериментальных исследований (in vitro и in vivo) сделан вывод, что ФР всё же оказывает цитотоксичный эффект на мезотелиальные клетки брюшины, что стимулирует процессы адгезирования и спайкообразования [5]. В связи с отсутствием альтернативного варианта, ФР используется в клинической практике. Применение физиологического раствора оправданно, поскольку показатели смертности и количества осложнений значительно выше, если не санировать брюшную полость в условиях РГП вообще.
Традиционные технологии санации гнойных полостей? представляют собой «нежное» орошение и последующее пассивное омывание находящихся в них густых и вязких патологических биологических субстанций растворами плазмозамещающих и антисептических средств, которые используются при температуре +20 – +26 °С, то есть холодными, и при кислотности со значениями рН менее 7,0, то есть кислыми. При этом охлаждение и закисление уплотняют гнойные массы. В связи с этим общепринятая технология санации гнойных полостей представляет собой локальное фармакохолодовое воздействие, которое замедляет разжижение густого гноя. Поэтому полная санация полостей? достигается сегодня в гнойных отделениях хирургических клиник не ранее, чем через несколько дней, а порой и месяцев ежедневного «промывания» [6; 7]. Отсюда можно сделать вывод, что нагревание обычных санирующих растворов до температуры тела и защелачивание их до рН 8,5 должно повышать эффективность разжижения густого липкого гноя [8].
В последние 20 лет активно развивается метод открытого ведения брюшной полости. Открытый живот (англ. open abdomen) – это методика лечения перитонита, при которой брюшная полость после выполнения всех хирургических манипуляций остается открытой с возможностью последующей релапаротомии «по плану» или по «требованию». Метод подразумевает наличие временного закрытия брюшной полости для отграничения внутренних органов и лапаротомной раны от окружающей среды. Для этого использовались такие способы, как сумка Богота, патч Виттманна, вакуум Баркера, которые сопряжены с высоким уровнем системных и локальных осложнений: адгезирование кишечника, энтероатмосферная фистула, неконтролируемая потеря жидкости, эвисцерации, кровотечение, потеря домена, контаминация хирургической раны с последующим развитием абдоминального сепсиса [7; 9]. Поэтому в конце 90-х годов был предложен метод лечения ран отрицательным давлением, который предотвращает потерю домена, т.е. латерализацию краев лапаротомной раны, контаминирование брюшной полости, но, несмотря на это, он также сопряжен с вышеуказанными осложнениями, но значительно в меньшей степени [9]. Применение отрицательного давления является одним из приоритетных направлений в хирургии. На основании чего выбран данный метод для ведения пациентов с открытым животом. Одним из таких методов является вакуум-ассистированная терапия с проведением перитонеальной санации физиологическим раствором через оригинальное инстилляционно-дренажное устройство (ИДУ) в сочетании с периоперационной барботажной обработкой. Модель брюшной полости выполнена на 3D-принтере Hori 3D с использованием полилактида на основании КТ-снимков брюшной полости.
В брюшную полость погружаются органы и распределяются согласно классической анатомии. В боковые каналы справа и слева, в подпеченочное пространство, межпетлевые пространства наливается раствор, моделирующий гнойное содержимое. В брюшную полость укладывается оригинальное ИДУ, которое представляет собой «полидренажную» систему: 6 силиконовых трубок помещаются в боковые каналы, подпеченочное пространство и между петель кишечника. Эти 6 трубок соединяются в один порт, который сообщает их с дренажной трубкой, выведенной через разрез размером 1 см (на модели он представлен) ниже лапаротомной раны. В ходе проведения первого этапа исследования использовался абдоминальный комплект VivanoMedAbdominalKit в сочетании с аппаратом VivanoTec. Поверх внутренних органов накладывается стерильная абдоминальная повязка, которая состоит из фенестрированной неадгезивной пленки Hartmann (VivanoMedAbdominal). Затем сверху укладывается полипропиленовая губка Hartmann (VivanoMedFoam) таким образом, чтобы края моделируемой лапаротомной раны располагались поверх неё. В случае если все 2 слоя уложены верно, губка и рана покрываются сверху прозрачной адгезивной пленкой для изоляции содержимого брюшной полости и фиксации повязки. В центре, над губкой, делается крестообразный разрез размером до 3 см. На область разреза наклеивается порт VivanoTecPort, который соединен с вакуумным устройством Hartmann VivanoTec посредством трубок. Дренажная трубка ИДУ соединяется с источником подачи раствора (рис. 1). Если всё установлено верно, то начинается режим «вакуум-инстиллят». Все перечисленные действия выполняются аналогично для каждого типа растворов.
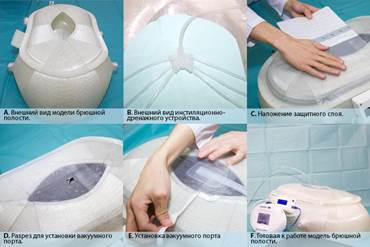
Рис. 1. Этапы установки вакуумного аппарата и ИДУ
Приготовление раствора, моделирующего гнойное содержимое брюшной полости.
В 7,5 л воды температурой 7-10 °С растворяется 175 г пищевого картофельного крахмала и размешивается до гомогенного раствора. Затем полученный раствор доводится до кипения с экспозицией 10 минут. Остывший раствор объёмом 700 мл наливается в моделируемую брюшную полость с преимущественным распределением по отлогим местам и межпетельно (рис. 2).
Приготовление инстилляционного газированного раствора (раствор 1).
Инстилляционный раствор предварительно насыщается углекислотой с помощью обтурационно-проводниковой системы, подключенной к баллону с углекислотой под контролем манометра. Предельный объем растворенного газа составляет 3 литра. При подаче данного раствора при избыточном давлении в 1 атм. и скорости потока 0.75 л/минуту ИДУ распределяет инстилляционный раствор с одинаковой скоростью, с последующим выделением части растворенного газа в виде мелких пузырьков, которые обволакивают детрит, придавая ему положительную плавучесть – эффект флотации. Время инстилляции составляет 15 секунд. Расход инстилляционного раствора уменьшился в два раза по сравнению с традиционным.
Приготовление негазированного инстилляционного раствора (раствор 2).
Инстилляционный раствор предварительно не насыщается углекислотой и подается под давлением в 1 атм. со скоростью 0,75 л/мин в импульсном режиме. Такой режим подразумевает, что 15 секунд подается смесь газа и раствора через ИДУ, затем в течение 30 секунд происходит выравнивание давления в резервуаре с раствором. При прохождении такого раствора через ИДУ неконтролируемо меняется его плотность, резко изменяется скорость потока, что вызывает эффект, близкий к действию гидроударного насоса. В результате отсутствует ламинарный поток, детрит отмывается в большем количестве и выводится через вакуум. Расход инстилляционного раствора уменьшился более чем в три раза по сравнению с традиционной методикой санации.
С целью профилактики внутрибрюшного компартмента превентивно устанавливался ПВХ-дренаж, перекрываемый на этапах создания локального отрицательного давления (ЛОД).
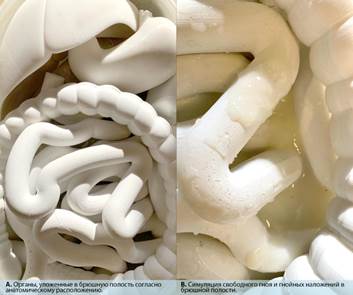
Рис. 2. Внешний вид раствора, моделирующего гнойное содержимое брюшной полости
Результаты исследования и их обсуждение
Плотность растворов рассчитывалась по классической формуле путем произведения массы раствора на его объём. Полученные значения отражены в таблице 1. Согласно полученным результатам раствор 2 имеет плотность меньше, чем у раствора 1, что, в свою очередь, говорит о низкой концентрации крахмала и, соответственно, высоком потенциале санационной обработки.
Таблица 1
Динамика изменения плотности инстилляционного раствора после инстилляции
|
Т1инстил |
Т2инстил |
Т3инстил |
||||
|
Плотность гноя до, г/см3 |
Плотность гноя после, г/см3 |
Плотность гноя до, г/см3 |
Плотность гноя после, г/см3 |
Плотность гноя до, г/см3 |
Плотность гноя после, г/см3 |
|
|
Раствор 1 |
1,8 |
1,5 |
1,8 |
1,5 |
1,8 |
1,18 |
|
Раствор 2 |
1,8 |
1,22 |
1,8 |
0,9 |
1,8 |
0,9 |
Вязкость раствора измерялась с помощью вискозиметра Брукфильда DV2TLV в системе СИ (L2/T, т.е. (кг х сек)/м3). Использование именно такого типа вискозиметра обосновано его главной технической особенностью: за счёт медленного движения ротора и оси создается ламинарное течение исследуемого раствора, благодаря чему фиксируемые показатели получаются более точными. В ходе исследования установлено, что вязкость каждого раствора после инстилляции уменьшается (табл. 2). При этом показатели вязкости раствора 2 уменьшаются в два раза и приближаются к значению воды, что также говорит о высоком потенциале санационной обработки.
Таблица 2
Динамика изменения вязкости инстилляционного раствора после инстилляции
|
Т1инстил |
Т2инстил |
Т3инстил |
||||
|
Вязкость гноя до |
Вязкость гноя после |
Вязкость гноя до |
Вязкость гноя после |
Вязкость гноя до |
Вязкость гноя после |
|
|
Раствор 1 |
987 |
712 |
987 |
709 |
987 |
602 |
|
Раствор 2 |
962 |
613 |
962 |
428 |
962 |
212 |
Во время традиционной санации брюшной полости, независимо от вида оперативного вмешательства, хирург в первую очередь визуально оценивает чистоту брюшной полости. Несмотря на то что оценка весьма субъективна, она является неотъемлемой частью интраоперационного ведения пациента. При оценке эффективности санации брюшной полости дополнительно использовался качественный показатель, основанный на визуальной оценке чистоты брюшной полости, выраженной в градации от одного до четырёх плюсов (табл. 3).
Таблица 3
Визуальная оценка чистоты брюшной полости после вакуум-инстилляционной терапии
|
Т1инстил |
Т2инстил |
Т3инстил |
|
|
Визуальная оценка чистоты БП |
Визуальная оценка чистоты БП |
Визуальная оценка чистоты БП |
|
|
Раствор 1 |
+ |
++ |
++ |
|
Раствор 2 |
+++ |
+++ |
++++ |
Примечания:
+ - заметно окрашивание на тканях, комки крахмала остаются в отлогих местах брюшной полости и межпетельно;
++ - окрашивание тканей четко не заметно, на тканях остаются мелкие комки крахмала, которые легко удаляются;
+++ - окрашивания тканей нет, небольшие наложения крахмала в виде тонкого слоя, который легко удаляется водой;
++++ - окрашивания тканей нет, наложения крахмала не определяются.
При промывании брюшной полости по традиционной методике для достижения визуального эффекта, сравнимого с действием раствора 1, необходимо 5 л раствора, а в сравнении с раствором 2 – до 7,2 л раствора.
Выводы
В ходе выполненного экспериментального исследования на трехмерной полимерной модели брюшной полости с использованием вакуум-инстилляционной системы и ИДУ наглядно и количественно доказано, что применение раствора, через который импульсно подается углекислый газ, повышает эффективность санации брюшной полости. Гной в отлогих местах и межпетельных пространствах становится менее плотным и вязким, менее адгезивным, что облегчает его эвакуацию из брюшной полости через вакуумный аппарат. Можно предположить, что это прогностически более эффективный метод санации, который уменьшает риск возникновения таких осложнений, как абдоминальный сепсис и септический шок. Необходимо проведение клинического исследования для подтверждения полученных нами результатов.
Исследование выполнено при поддержке Краевого государственного автономного учреждения «Красноярский краевой фонд поддержки научной и научно-технической деятельности» в рамках реализации проекта «Разработка оборудования для новой технологии лечения распространенного гнойного перитонита с помощью периоперационной барботажной вакуум-инстилляционной санации брюшной полости».



